접수일:2009년 3월 7일, 승인일:2009년 4월 16일
책임저자:신 수 156-707 서울시 동작구 보라매길 31-1 서울대학교 보라매병원 진단검사의학과
제대혈 특성에 영향을 주는 산모 및 태아측 요인 분석
이혜련1ㆍ노은연2,4ㆍ윤종현1,2,4ㆍ한규섭1,2,4ㆍ김병재3,4ㆍ황규리3ㆍ전혜원3ㆍ홍정자4ㆍ신 수1,2,4
서울대학교 의과대학 검사의학교실1, 보라매병원 진단검사의학과2, 산부인과3, 서울특별시 보라매병원 공여제대혈은행4
= Abstract =
Analysis of Maternal and Neonatal Factors Affecting Hematopoietic Parameters of Cord Blood
Hye Ryun Lee1, Eun Youn Roh2,4, Jong Hyun Yoon1,2,4, Kyou Sup Han1,2,4, Byung Jae Kim3,4, Kyu Ri Hwang3, Hye Won Jeon3, Jung Ja Hong4, Sue Shin1,2,4
Department of Laboratory Medicine, Seoul National University College of Medicine1, Departments of Laboratory Medicine2, Obstetrics and Gynecology3, Boramae Hospital Seoul Metropolitan Government Public Cord Blood Bank (Allcord),
Boramae Hospital4, Seoul, Korea
Background: Cord blood (CB) is a useful source of hematopoietic stem cells. In public CB banks, only CB units with good hematopoietic potential are processed and stored because the processing and storage of CB are cost-consuming and labor-intensive procedures. Presently, we sought to determine factors correlated with, and influential to, hematopoietic parameters of CB units donated from Korean neonates and their mothers.
Methods: A total of 1,696 CB units that were donated and processed from August 1 – December 31, 2007 were enrolled. Donated CB volume, total nucleated cells (TNC), total mononucleated cells (MNC), CD34+ cells after processing, and cell viability before and after processing were analyzed according to sex and delivery method. We also determined whether maternal age, neonatal factors (gestational age, birth weight, sex, delivery method), CB volume, and processing time were correlated with hematopoietic parameters of CB.
Results: CB of female neonates had significantly higher mean TNC and CB obtained from vaginal delivery had significantly higher mean TNC, MNC, and CD34+ cells. The counts of TNC, MNC, and CD34+ cells were significantly positively correlated with CB volume, gestational age, and birth weight. Counts of TNC, MNC, and CD34+ cells, and pre- and post-viability of CB were significantly negatively correlated with processing time.
Conclusion: The present data provide a baseline for standard methods of collection, processing, and storage in cord blood banking. (Korean J Blood Transfus 2009;20:1-13)
Key words: Cord blood, Transplantation, Hematopoietic parameters, Maternal factors, Neonatal factors
서 론
제대혈에 줄기세포가 풍부함이 밝혀지고, 최초 의 제대혈 이식이 1988년 이루어지면서, 골수와 말초조혈모세포를 대체할 조혈모세포 공급원으 로 주목 받기 시작하였다.1) 1993년 뉴욕제대혈은 행이 설립된 이후,2) 전세계적으로 제대혈은행의 운영과 제대혈 조혈모세포이식이 활발히 이루어 져 지금까지 세계적으로 8,000예, 국내에서는 300 예 이상의 제대혈 이식이 시행되었다.3) 저장 제 대혈은 골수 기증과 달리 공여 거부의 가능성이 없고, 감염성 질환에 대한 검사를 완료한 검체를 냉동보관하고 있으므로 신속하게 이용할 수 있으 며, 면역학적으로 미성숙한 제대혈의 특성으로 이식편대숙주반응의 위험성이 적어 조직적합성 항원(HLA) 6개 중 4개만 맞아도 이식이 가능하 고, 기존의 단점이었던 양적인 부족은 최근 좋은 성적을 보이는 두 단위 동시이식으로 극복되고 있어, 명실상부한 조혈모세포 이식의 주 치료재 원으로 주목받고 있다.4-11)
비혈연간 제대혈 조혈모세포이식을 목적으로 하는 공여제대혈은행은 이식에 적합한 제대혈의 대단위 확보가 중요하면서도 제대혈의 처리 및 저장과정에 많은 비용과 노력이 소요되기 때문 에, 기증된 제대혈이 이식에 적합한지 확인한 후 저장여부를 결정하게 된다. 기증된 제대혈의 이 식 적합성 여부를 판정하기 위해서 산모의 의학 병력기록과 제대혈 채취기록의 검토를 비롯하여 제대혈 총유핵세포수와 총단핵세포수 및 세포생 존율, CD34 양성 세포수, 미생물 배양검사 및 제 대혈과 산모혈액의 감염성 질환 선별검사 등을 확인하게 되는데, 이 중 총유핵세포수와 CD34 양 성 세포수는 조직적합성항원(HLA)과 함께 제대 혈을 비롯한 조혈모세포이식에서 이식 성적을 결 정하는 주요 인자로 알려져 있다.12-15) 최근 일부
외국의 제대혈은행에서는 기증된 제대혈의 총유 핵세포수, CD34 양성 세포수와 기증한 산모와 신 생아 변수 사이의 상관성을 분석함으로써 이식에 적합한 제대혈 수집과 관리에 이용하고 있다.16-19) 국내에서는 2006년 보건복지부의 제대혈은행 표 준업무지침을 통해 기준이 제시된 이래, 이 기준 에 맞는 기증 제대혈에 대한 기초 연구는 실시되 지 않은 상태이다.
이에 저자들은 본 연구에서 공여제대혈은행에 기증하여 이식용으로 저장된 대단위의 한국인 신 생아 제대혈을 대상으로, 총유핵세포수, 총단핵 세포수, CD34 양성 세포수와 같은 조혈모세포 관 련 수치들과 기증한 산모의 연령, 신생아의 제태 연령과 출생 체중, 제대혈량, 그리고 제대혈 처리 시간 사이의 상관성을 분석하고자 하였다.
대상 및 방법
1. 대상
2007년 8월 1일부터 12월 31일까지 제대혈 기 증에 서면으로 동의한 산모로부터 채취한 제대혈 중 저장에 적합한 제대혈 검체 1,696단위를 대상 으로 하였다. 대상군에 포함된 신생아는 모두 한 국인 부모 사이에서 출생한 재태연령 36∼42주 사이의 만삭분만 신생아였으며, 산모는 해당 임 신 및 출산과 관련한 합병증이 없었다.
2. 방법
1) 채취
서울특별시립 보라매병원 의학연구윤리심의 위원회(Institutional review board, IRB)의 심의를 통과한 기증 동의서에 자발적으로 동의 및 서명 한 산모에게서 출산 시 분만을 담당한 산부인과 의사가 태아 만출 직후 태반이 나오기 전에 제대
를 결찰하고 항응고제(citrate phosphate dextrose adenine, CPDA-1 24.5 mL)가 포함된 채취백에 채 취절차에 따라 제대혈을 채취하였으며, 채취된 제대혈은 운송 담당자에 의해 실온 24시간 이내 에 제대혈은행으로 운반되었다.
2) 제대혈과 기증자 관련 정보
산모의 연령과 신생아의 재태연령, 출생 체중, 성별과 분만방법에 대한 정보는 제대혈과 함께 접수된 ‘제대혈 채취 기록지’를 이용하였다.
3) 검사
채취백의 제대혈의 무게를 측정하고, 10분 이 상 잘 혼합하고 1 mL를 채취하여 처리 전-세포수 와 처리 전-세포생존도를 검사하였다. 제대혈은 행의 업무지침에 따라 처리한 농축제대혈 0.5 mL 에서는 처리 후-총유핵세포수, 총단핵세포수, CD34 양성 세포수를 검사하였다. 냉동보존제 처리 후 냉동 직전 소량의 제대혈을 채취하여 처리 후-세 포생존도를 검사하였다.
(1) 총유핵세포수(total nucleated cell, TNC)와 총단핵세포수(total mononucleated cell, MNC) 검사: 자동혈구분석기 XE-2100 (Sysmex, Kobe, Japan)을 이용하여 제대혈 처리 후의 백혈구수, 림프구와 단구의 감별계수를 확인하였다. 총단핵 세포수는 총유핵세포 중 림프구와 단구에 해당하 는 세포수로 하였다.
(2) CD34 양성 세포수(CD34+ cells) 검사: 처리 후 농축제대혈의 CD34 양성 세포수를 유세포분 석기 FACSaria (BD, Biosciences, San Jose, CA, USA)를 이용하여 확인하였다. 검사는 ISHAGE 방법에 따라서, 7-ADD (BD, Biosciences, San Jose, CA, USA)로 죽은 세포를 제외한 후, FITC-CD45 단클론항체(BD, Biosciences, San Jose, CA, USA) 로 백혈구 분획을 gaiting하고 PE-CD34 단클론항 체(BD, Biosciences, San Jose, CA, USA)로 CD34 양성 세포수를 산정하였다.
(3) 세포생존도(cell viability) 검사: 처리 전과 후, 0.4% trypan blue 염색법으로 검푸르게 염색되 는 세포를 제외하여 생존 세포의 분율을 산정하 였다.
4) 처리시간(Processing time)
제대혈이 채취된 시점부터 제대혈은행에 운반 되어 처리 후 동결 저장되기까지의 시간을 측정 하였다.
5) 통계 분석
독립표본 T 검정을 이용하여 신생아의 성별과 분만방법에 따른 채취된 제대혈량, 제대혈의 총 유핵세포수, 총단핵세포수, CD34 양성 세포수, 처리 전과 후의 세포생존도를 비교하였고, 상관 분석과 다변량분석을 이용하여 산모의 연령과 신 생아의 재태연령, 출생 체중, 성별과 분만방법, 제대혈량과 제대혈의 처리 후 총유핵세포수, 총 단핵세포수, CD34 양성 세포수, 그리고 처리 전 과 후의 세포생존도 사이의 상관성을 평가하였 다.
결 과
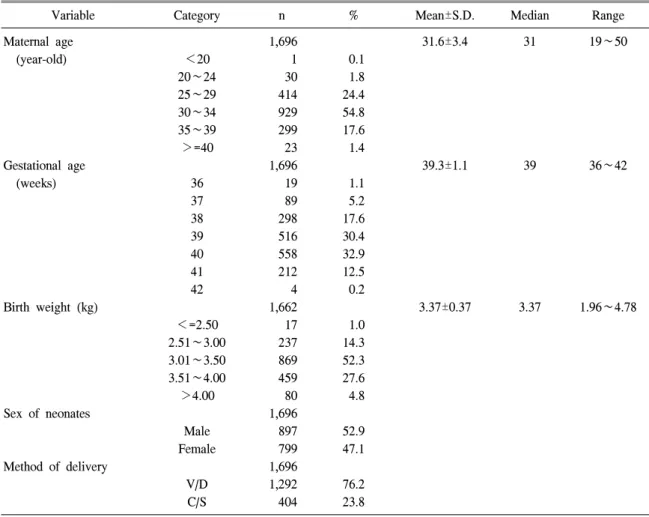
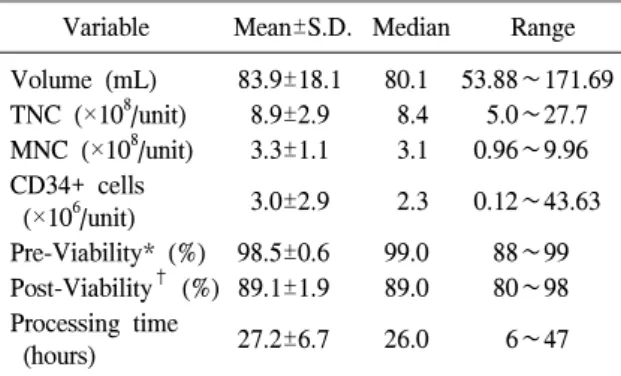
1,696명의 신생아 중 남아는 897명(52.9%), 여 아는 799명(47.1%)이었으며, 질식분만으로 출생 한 신생아는 1,292명(76.2%), 제왕절개로 출생한 신생아는 404명(23.8%)이었다. 신생아 성별과 분 만방법을 포함하여 제대혈을 기증한 산모의 연령 과 신생아의 재태연령, 출생 체중의 분포는 Table 1과 같으며, 제대혈량과 처리 후 총유핵세포수, 총단핵세포수, CD34 양성 세포수, 처리 전과 후 의 세포생존도, 그리고 처리 시간은 Table 2와 같 다.
신생아 성별과 분만방법에 따라 제대혈량과 처 리 후 총유핵세포수, 총단핵세포수, CD34 양성 세포수, 그리고 처리 전과 후의 세포생존도의 평
Variable Category n % Mean±S.D. Median Range
Maternal age 1,696 31.6±3.4 31 19∼50
(year-old) <20 1 0.1
20∼24 30 1.8
25∼29 414 24.4
30∼34 929 54.8
35∼39 299 17.6
>=40 23 1.4
Gestational age 1,696 39.3±1.1 39 36∼42
(weeks) 36 19 1.1
37 89 5.2
38 298 17.6
39 516 30.4
40 558 32.9
41 212 12.5
42 4 0.2
Birth weight (kg) 1,662 3.37±0.37 3.37 1.96∼4.78
<=2.50 17 1.0
2.51∼3.00 237 14.3
3.01∼3.50 869 52.3
3.51∼4.00 459 27.6
>4.00 80 4.8
Sex of neonates 1,696
Male 897 52.9
Female 799 47.1
Method of delivery 1,696
V/D 1,292 76.2
C/S 404 23.8
Abbreviations: GA, gestational age; V/D, vaginal delivery; C/S, Cesarean section.
Table 1. Obstetric characteristics of mothers and neonates
균값의 비교는 Table 3에 제시하였다. 신생아 성 별에 따른 비교에서 보면, 총 제대혈량의 차이는 없었으나 제대혈의 처리 후 총유핵세포수는 여아 의 제대혈에서 더 많았다(P=0.010). 성별에 따른 분만방법의 차이는 없었고, 체중은 남아에서 유 의하게 높았다(남아, 3.40±0.37 kg; 여아, 3.34±
0.36 kg, P=0.002). 분만방법에 따른 비교에서 보 면, 총 제대혈량의 차이는 없었으나 질식분만으 로 태어난 신생아의 제대혈에서 처리 후 총유핵
세포수(P<0.001), 총단핵세포수(P<0.001), CD34 양성 세포수(P=0.009)가 더 많았다. 분만방법에 따른 성별의 차이는 없었고, 제왕절개로 태어난 신생아에서 질식분만시보다 출생체중이 더 높았 다(질식분만, 3.35±0.34 kg; 제왕절개, 3.45±0.44 kg, P<0.001). 세포생존도는 제왕절개로 태어난 신생아 제대혈에서 더 높았다(처리 전, P= 0.001;
처리 후, P=0.016).
채취된 제대혈량은 산모의 연령(P=0.041)과 신
Table 2. Characteristics of 1,696 cord blood units Variable Mean±S.D. Median Range Volume (mL) 83.9±18.1 80.1 53.88∼171.69 TNC (×108/unit) 8.9±2.9 8.4 5.0∼27.7 MNC (×108/unit) 3.3±1.1 3.1 0.96∼9.96 CD34+ cells
3.0±2.9 2.3 0.12∼43.63 (×106/unit)
Pre-Viability* (%) 98.5±0.6 99.0 88∼99 Post-Viability† (%) 89.1±1.9 89.0 80∼98 Processing time
27.2±6.7 26.0 6∼47 (hours)
Abbreviations: TNC, total nucleated cells; MNC, mononu- cleated cells.
*cell viability before processing of cord blood unit, †cell viability after processing of cord blood unit.
Table 3. Mean of cellular and progenitor cell contents of the cord blood units according to sex of neonates and method of delivery
Sex of neonates Method of delivery
–––––––––––––––––––––––––––––––––– P –––––––––––––––––––––––––––––––––– P Male (n=897) Female (n=799) V/D (n=1292) C/S (n=404)
Volume (mL) 84.5 83.2 0.132 84.1 83.1 0.345
TNC (×108/unit) 8.8 9.1 0.010 9.3 7.8 <0.001
MNC (×108/unit) 3.3 3.3 0.529 3.4 2.9 <0.001
CD34+ cells (×106/unit) 3.1 3.0 0.551 3.1 2.8 0.009
Pre-Viability* (%) 98.5 98.5 0.640 98.5 98.6 0.001
Post-Viability† (%) 89.1 89.2 0.280 89.1 89.3 0.016
Abbreviations: See Table 1 and 2.
*cell viability before processing of cord blood unit, †cell viability after processing of cord blood unit.
생아의 출생 체중(P<0.001)과 유의한 연관성이 있었으며, 재태연령(P=0.173)과는 연관성이 없었 다(Fig. 1).
제대혈량이 증가할수록 총유핵세포수(r=0.436, P<0.001), 총단핵세포수(r=0.398, P<0.001), CD34 양성 세포수(r=0.274, P<0.001)가 모두 증가하여 제대혈량과 모두 연관성이 있는 것으로 나타났
다.
총유핵세포수와 총단핵세포수는 모두 신생아의 재태연령(P<0.001)과 출생 체중(각각 P<0.001, P=0.005)과 연관성을 보였지만, 산모의 연령(각각 P=0.096, P=0.266)과는 무관하였다(Fig. 2, 3).
CD34 양성 세포수의 경우도 신생아의 재태연령 (P=0.021)과 출생 체중(P<0.001)과 연관성을 보 였지만, 산모의 연령(P=0.575)과는 무관하였다 (Fig. 4).
산모의 연령을 34세를 기준으로 34세 이하의 산모 그룹과 35세 이상의 산모 그룹으로 나누어 제대혈량, 총유핵세포수, 총단핵세포수, CD34 양 성 세포수의 평균값에서 차이가 있는지를 독립표 본 T 검정으로 분석한 결과 두 그룹 사이에서 유 의한 차이는 나타나지 않았다.
제대혈 처리시간을 각각 12, 24, 36시간 기준으 로 전, 후 그룹에서의 총유핵세포수, 총단핵세포 수, CD34 양성 세포수, 그리고 처리 전과 후의 세 포생존도를 비교해 본 결과, 12시간을 기준으로 두 그룹에서 처리 전과 후의 세포생존도에서 유 의한 차이가 나타났으며(각각 P=0.001, P=0.003), 24시간을 기준으로 두 그룹에서 총유핵세포수
(P=0.035), 총단핵세포수(P<0.001), CD34 양성 세포수(P=0.023), 그리고 처리 전과 후의 세포생 존도(P<0.001) 모두에서 유의한 차이가 있었다.
고 찰
제대혈이 골수와 말초조혈모세포를 대체할 조 혈모세포 공급원으로 주목 받기 시작하면서 제대 혈의 중요성은 커지고 있지만, 검체의 특성상 양 이 충분하지 않고 제대혈의 처리 및 저장과정에
많은 비용과 노력이 소요되기 때문에 이식에 적 합한 기증자와 제대혈 확보가 중요하다. 국외의 많은 제대혈은행에서는 그 동안 각 은행에 기증 된 제대혈의 수집부터 처리, 보관, 기증에 대한 경험과 제대혈과 관련된 검사결과에 대한 데이터 베이스를 통해 제대혈 관리에 필요한 방안들을 제시하고 있다. 2005년 발표된 미국의 Cord Blood Transplantation (COBLT) 연구16)에서는 3곳의 공 여제대혈은행에 기증된 제대혈의 검사결과와 제 대혈을 기증한 산모의 인종과 연령, 그리고 신생 Fig. 1. Volume of cord blood unit (mL) by maternal age (A), gestational age (B) and birth weight (C). Bar represents mean and 95 percent confidence limits and r means Spearman correlation coefficient.
아의 재태연령, 출생 체중, 성별과 분만방법과의 연관성 분석을 통해 제대혈 수집과 관리에 이용 하고 있다. 이 연구에 따르면, 채취된 제대혈량과 총유핵세포수가 질식분만으로 태어난 신생아의 제대혈에서보다 제왕절개로 태어난 신생아의 제 대혈에서 유의하게 높게 나타났으며, 신생아의 출생 체중이 클수록 제대혈량과 총유핵세포수, 그리고 CD34 양성 세포수가 높다고 보고했다.
CD34 양성 세포수의 경우, 신생아의 재태연령이 증가할수록 감소했으며, 산모의 연령과는 관련이
없었다. 이 연구는 다인종 국가인 특성을 고려하 여 특정 인종에서 비슷한 양의 제대혈에서 총유 핵세포수가 유의하게 더 낮다는 것을 확인함으로 써 인종에 따라 제대혈 채취 시에 채취하는 양에 대해서 다른 기준을 적용할 수 있는 기초를 마련 했다.
본 연구에서도 신생아의 출생 체중이 클수록 제대혈량, 총유핵세포수, 총단핵세포수, CD34 양 성 세포수가 증가하였으며, 신생아 재태연령이 낮을수록 CD34 양성 세포수가 증가하는 것을 알 Fig. 2. Total nucleated cells (TNC, ×108/unit) by maternal age (A), gestational age (B) and birth weight (C). Bar represents mean and 95 percent confidence limits and r means Spearman correlation coefficient.
수 있었다. COBLT 연구와 본 연구에서 나타난 신생아 출생 체중과 제대혈량, 총유핵세포수, CD34 양성 세포수 사이의 연관성과 재태연령과 CD34 양성 세포수 사이의 연관성은 기존의 연구 결과와도 일치하였다.17-21) 본 연구에서는 COBLT 연구와는 달리 신생아의 성별뿐만 아니라 분만방 법에 따른 그룹간에도 제대혈량에서는 유의한 차 이를 보이지 않았으나, 질식분만으로 태어난 신 생아의 제대혈에서 총유핵세포수와 총단핵세포 수, 그리고 CD34 양성 세포수가 통계적으로 유의
하게 더 높은 수치를 보였다. 이러한 차이는 제대 혈 채취 방법에 따른 차이로 보이는데, 본 연구에 서는 제대혈을 태아 만출 직후 태반이 나오기 전 에 제대를 결찰하고 채취하는 in utero 방법으로 채취한 반면, COBLT 연구에서는 태반이 나온 후 에 제대혈을 채취하는 ex utero 방법으로 채취한 차이가 있었다. 본 연구처럼 in utero 방법으로만 제대혈을 채취한 연구에서 보면, 본 연구와 동일 하게 질식분만으로 태어난 신생아의 제대혈에서 제왕절개로 태어난 신생아의 제대혈보다 총유핵 Fig. 3. Mononucleated cells (MNC, ×108/unit) by maternal age (A), gestational age (B) and birth weight (C). Bar represents mean and 95 percent confidence limits and r means Spearman correlation coefficient.
세포수가 더 높았다.21) 또한, 질식분만으로 태어 난 신생아만을 대상으로 제대혈 채취 방법을 in utero 방법과 ex utero 방법으로 하여 비교한 연구 에 따르면, in utero 방법으로 채취된 제대혈량이 더 많았으며, 총유핵세포도 유의하게 많았다.22) 제대혈 채취 방법에 따른 총유핵세포수의 차이를 연구한 다른 연구 결과를 보면, 분만방법과는 무 관하게 ex utero 방법에 비해서 in utero 방법으로 채취한 제대혈에서 총유핵세포수가 유의하게 높 은 것을 알 수 있었다.23) 따라서, 본 연구에서는
모든 제대혈을 in utero 방법으로 채취하였기 때 문에 COBLT 연구와 차이가 나타났을 것으로 생 각된다.
제대혈 채취 방법이 모두 동일하고 분만방법이 나 성별에 따른 제대혈의 양에는 차이가 없었지 만, 제왕절개로 태어난 신생아의 제대혈에서 총 유핵세포와 CD34 양성 세포수가 더 낮게 나타났 으며, 남아의 제대혈에서 여아의 제대혈과 비교 시 CD34 양성 세포수에서 유의한 차이는 없었으 나 총유핵세포수는 더 낮았다. 분만방법과 신생 Fig. 4. CD34+ cells (×106/unit) by maternal age (A), gestational age (B) and birth weight (C). Bars show mean and 95 percent confidence limits (mean±S.D.) and r means Spearman correlation.
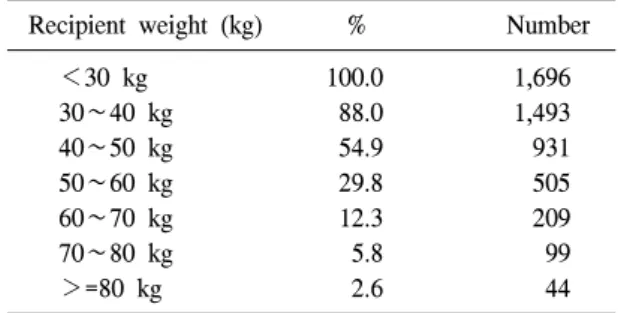
Table 4. Proportion of stored cord blood units suitable for transplantation to recipients of given weights (minimal suitable cell dose: 2×107 TNC/kg)
Recipient weight (kg) % Number
<30 kg 100.0 1,696
30∼40 kg 88.0 1,493
40∼50 kg 54.9 931
50∼60 kg 29.8 505
60∼70 kg 12.3 209
70∼80 kg 5.8 99
>=80 kg 2.6 44
아의 성별이 총유핵세포수 또는 CD34 양성 세포 수에 영향을 주는지에 대해서는 연구마다 다르게 보고하고 있는데,16,17,20,23,24) 본 연구에서는 남아나 제왕절개의 경우와 같이 출생 체중이 높았던 그 룹에서 총유핵세포수, 총단핵세포수, 그리고 CD34 양성 세포수가 낮게 나타났다. 그 이유를 본 연구 항목만으로 한정하여 해석하면, 성별에 따른 출 생 체중의 차이보다는 재태연령의 증가가 혈액학 적 수치에 미치는 영향이 더 많은 것으로 추정할 수 있다. 따라서, 본 연구 결과만을 고려한다면 향후 한국인 신생아를 대상으로 제대혈 채집 시 에는 제왕절개로 태어난 신생아와 남아의 경우에 는 채집하는 제대혈량을 더 증가시켜 한 단위 제 대혈 내의 총유핵세포수와 CD34 양성 세포수를 증가시키는 방법을 고려할 필요가 있겠다. 왜냐 하면, 제대혈의 총유핵세포수와 CD34 양성 세포 수는 제대혈을 비롯한 조혈모세포이식에서 이식 초기 성적을 결정하는 주요 인자로, 조직적합성 항원(HLA)과 함께 제대혈 선택의 기준이 되기 때
문이다.12-15) 현재 대부분의 이식센터에서는 주입
되는 제대혈 세포수의 기준을 냉동 전 검사결과 2×107 TNC/kg 이상 또는 해동 후 검사결과 1.5×
107 TNC/kg 이상으로 정하고 있으며,25) 처리 후 총유핵세포수가 5×108개 미만인 경우에는 이식 에 부적합한 제대혈로 폐기하고 있다. 실제 2006 년 5월 개소 이래 2008년 2월까지 공여제대혈은 행에 기증 의사를 밝힌 제대혈 중 처리에 들어간 7,796단위의 제대혈 중에서 약 8%에 해당하는 622단위의 제대혈이 총유핵세포수 부족으로 부 적합 판정을 받았는데 이것은 부적합 판정을 받 은 제대혈의 약 47%에 해당한다. 또한, 1,696단위 의 제대혈에 대해서 이식 가능한 최소 총유핵세 포수 기준인 2×107 TNC/kg을 기준으로 이식이 가 능한 환자의 몸무게에 대해서 분류해 본 결과, 소 아 몸무게에 해당하는 30 kg 미만의 환자에게는
저장된 제대혈 단위의 100%가 이식이 가능한 반 면 성인 몸무게에 해당하는 60 kg 이상의 환자에 게는 약 12%의 저장 제대혈만이 이식이 가능한 것으로 나타났다(Table 4). 따라서, 이식에 적합한 제대혈의 확보를 위해서는 이식에 적합한 최소한 의 총유핵세포수 이상을 갖고 있는 제대혈의 확 보가 중요하며, 기본적으로는 제대혈을 충분한 양으로 채집하는 것이 가장 중요하다고 볼 수 있 다.
제대혈의 총유핵세포수와 CD34 양성 세포수 는 산모의 연령과는 무관한 것으로 나타났는데, 이러한 결과는 기존 연구 결과와 동일하였다.16,17,24) 현재 국내에서는 보건복지부의 제대혈은행 표준 업무지침에 제시된 기준에 따라서 산모 연령을 20세에서 34세로 제한하고 있는데, 본 연구에서 산모의 연령을 34세 기준으로 두 그룹으로 나누 어 비교했을 때, 총유핵세포수와 CD34 양성 세포 수에서 차이가 없었다. 또한, 35세 이상의 산모가 제대혈을 기증한 산모의 약 20%에 해당하고, 현 재 35세 이상의 고령산모가 늘어나는 사회적인 추세를 반영한다면 산모 연령을 34세에서 더 확 대 가능할 것으로 보인다. 산모 연령을 40세 기준 으로 두 그룹으로 나누어 비교해 보았을 때에도 총유핵세포수, 총단핵세포수, 그리고 CD34 양성
세포수에서 유의한 차이는 없는 것으로 나타났다 하지만, 40세 이상의 산모가 1.4%로 적은 비율이 었고(Table 1) 총유핵세포수와 총단핵세포수, CD34 양성 세포수의 평균값이 40세 이상의 산모 그룹 에서 다른 연령 그룹에 비해 낮은 값을 보였기 때 문에(Fig. 2, 3, 4), 향후 연구가 더 필요할 것으로 보인다.
처리 전과 후의 세포생존도는 제왕절개로 태어 난 신생아의 제대혈에서 더 높은데 이는 제대혈 처리시간이 제왕절개에서 질식분만에 비해 더 짧 기 때문인 것으로 생각된다. 보건복지부의 제대 혈은행 표준업무지침에는 제대혈 처리시간을 36 시간 이내로 규정하고 있지만, 본 연구 결과 24 시간을 기준으로 처리 전과 후의 세포생존도 뿐 만 아니라, 총유핵세포수와 총단핵세포수, 그리 고 CD34 양성 세포수에서 유의한 차이를 나타냈 다. 현재 제대혈 처리시간이 27.2±6.7시간(Table 2)인 것으로 보아 처리시간의 단축 노력이 필요 할 것으로 생각된다.
현재 적용하고 있는 제대혈 관련 기준과 방침 은 대부분 외국의 보고와 사전에 소단위의 제대 혈을 통해 얻은 분석 결과에 기반한 것으로 한국 인 신생아 제대혈을 대상으로 대규모 연구는 진 행되지 않은 상태이다. 저자들은 본 연구에서 기 증된 한국인 신생아의 제대혈을 대상으로, 기증 한 산모와 신생아 변수와 총유핵세포수와 총단핵 세포수, 그리고 CD34 양성 세포수와 같은 제대혈 의 조혈모세포로서의 관련 검사 결과 사이의 상 관성을 분석하여 이식에 적합한 기증 조건을 찾 고자 하였다. 또한, 제대혈 처리시간과의 연관성 을 분석함으로써 적합한 제대혈 처리시간을 확인 할 수 있었다. 본 연구 결과는 대규모의 한국인 신생아 제대혈을 대상으로 상관성을 분석하였다 는데 의의가 있으며, 향후 본 제대혈은행 뿐만 아 니라 다른 제대혈은행의 제대혈 수집과 저장에
관련한 표준화 방침에 반영되어 유용하게 이용될 것이다.
요 약
배경: 제대혈은 조혈모세포의 공급원으로 유용 하나 처리 및 저장 과정에서 많은 비용과 노력이 소요되므로 공여제대혈은행에서는 조혈모세포 로서 이식에 적합한 제대혈에 대해서만 저장 처 리를 시행한다. 본 연구에서는 공여제대혈은행에 기증 및 저장된 대단위의 한국인 신생아 제대혈 을 대상으로 제대혈 조혈모세포 관련 수치에 영 향을 주는 요인들간의 상관성을 분석하고자 하였 다.
방법: 2007년 8월 1일부터 12월 31일까지 이식 용으로 저장 처리된 제대혈 검체 1,696단위를 대 상으로 하였다. 제대혈을 기증한 신생아의 성별 과 분만방법에 따라 제대혈량, 처리 후 총유핵세 포수, 총단핵세포수, CD34 양성 세포수, 그리고 처리 전과 후의 세포생존도를 비교하였다. 또한, 이러한 제대혈의 조혈모세포로서의 변수와 제대 혈을 기증한 산모의 연령과 신생아의 재태연령, 출생 체중, 성별과 분만방법, 그리고 채취된 제대 혈량과 제대혈 처리시간 사이의 상관성을 분석하 였다.
결과: 여아의 제대혈에서 제대혈의 총유핵세포 수가 남아의 제대혈에서보다 더 많았다. 질식분 만으로 태어난 신생아의 제대혈에서 총유핵세포 수, 총단핵세포수, CD34 양성 세포수가 더 많았 다. 제대혈량이 증가할수록 총유핵세포수, 총단 핵세포수, CD34 양성 세포수가 모두 증가하여 제 대혈량과 연관성을 보였다. 총유핵세포수와 총단 핵세포수, 그리고 CD34 양성 세포수는 모두 신생 아의 재태연령과 출생 체중이 증가할수록 증가하 였다. 총유핵세포수, 총단핵세포수, CD34 양성
세포수, 그리고 처리 전과 후의 세포생존도 모두 제대혈 처리시간이 증가할수록 유의한 감소를 보 였다.
결론: 이 결과는 향후 제대혈은행의 제대혈 수 집과 처리, 저장에 관련한 표준화 방침에 반영되 어 유용하게 이용될 것이다.
참고문헌
1. Gluckman E, Broxmeyer HA, Auerbach AD, Friedman HS, Douglas GW, Devergie A, et al.
Hematopoietic reconstitution in a patient with Fanconi's anemia by means of umbilical-cord blood from an HLA-identical sibling. N Engl J Med 1989;321:1174-8
2. Rubinstein P, Taylor PE, Scaradavou A, Adamson JW, Migliaccio G, Emanuel D, et al.
Unrelated placental blood for bone marrow reconstitution: organization of the placental blood program. Blood Cells 1994;20:587-96 3. Lee YH. Cord blood-current status and per-
spective. Korean J Hematol 2007;42:181-96 4. Rocha V, Wagner JE Jr, Sobocinski KA, Klein
JP, Zhang MJ, Horowitz MM, et al. Graft- versus-host disease in children who have received a cord-blood or bone marrow transplant from an HLA-identical sibling.
Eurocord and International Bone Marrow Transplant Registry Working Committee on Alternative Donor and Stem Cell Sources. N Engl J Med 2000;342:1846-54
5. Barker JN, Davies SM, DeFor T, Ramsay NK, Weisdorf DJ, Wagner JE. Survival after transplantation of unrelated donor umbilical cord blood is comparable to that of human leukocyte antigen-matched unrelated donor bone marrow: results of a matched-pair ana- lysis. Blood 2001;97:2957-61
6. Rocha V, Cornish J, Sievers EL, Filipovich A,
Locatelli F, Peters C, et al. Comparison of outcomes of unrelated bone marrow and um- bilical cord blood transplants in children with acute leukemia. Blood 2001;97:2962-71 7. Laughlin MJ, Eapen M, Rubinstein P, Wagner
JE, Zhang MJ, Champlin RE, et al. Outcomes after transplantation of cord blood or bone marrow from unrelated donors in adults with leukemia. N Engl J Med 2004;351:2265-75 8. Rocha V, Labopin M, Sanz G, Arcese W,
Schwerdtfeger R, Bosi A, et al. Transplants of umbilical-cord blood or bone marrow from unrelated donors in adults with acute leuke- mia. N Engl J Med 2004;351:2276-85
9. Warwick R, Armitage S. Cord blood banking.
Best Pract Res Clin Obstet Gynaecol 2004;
18:995-1011
10. Tse W, Laughlin MJ. Umbilical cord blood transplantation: a new alternative option.
Hematology Am Soc Hematol Educ Program 2005:377-83
11. Brunstein CG, Setubal DC, Wagner JE.
Expanding the role of umbilical cord blood transplantation. Br J Haematol 2007;137:20-35 12. Rubinstein P, Carrier C, Scaradavou A,
Kurtzberg J, Adamson J, Migliaccio AR, et al.
Outcomes among 562 recipients of placental- blood transplants from unrelated donors. N Engl J Med 1998;339:1565-77
13. Gluckman E, Locatelli F. Umbilical cord blood transplants. Curr Opin Hematol 2000;7:353-7 14. Ballen K, Broxmeyer HE, McCullough J,
Piaciabello W, Rebulla P, Verfaillie CM, et al.
Current status of cord blood banking and transplantation in the United States and Europe. Biol Blood Marrow Transplant 2001;
7:635-45
15. Wagner JE, Barker JN, DeFor TE, Baker KS, Blazar BR, Eide C, et al. Transplantation of unrelated donor umbilical cord blood in 102
patients with malignant and nonmalignant diseases: influence of CD34 cell dose and HLA disparity on treatment-related mortality and survival. Blood 2002;100:1611-8
16. Kurtzberg J, Cairo MS, Fraser JK, Baxter-Lowe L, Cohen G, Carter SL, et al. Results of the cord blood transplantation (COBLT) study unrelated donor banking program. Trans- fusion 2005;45:842-55
17. Ballen KK, Wilson M, Wuu J, Ceredona AM, Hsieh C, Stewart FM, et al. Bigger is better:
maternal and neonatal predictors of hema- topoietic potential of umbilical cord blood units. Bone Marrow Transplant 2001;27:7-14 18. McGuckin CP, Basford C, Hanger K, Habi-
bollah S, Forraz N. Cord blood reve- lations-The importance of being a first born girl, big, on time and to a young mother! Early Hum Dev 2007;83:733-41
19. Jones J, Stevens CE, Rubinstein P, Robertazzi RR, Kerr A, Cabbad MF. Obstetric predictors of placental/umbilical cord blood volume for transplantation. Am J Obstet Gynecol 2003;
188:503-9
20. Nakagawa R, Watanabe T, Kawano Y, Kanai S, Suzuya H, Kaneko M, et al. Analysis of maternal and neonatal factors that influence the nucleated and CD34+ cell yield for cord
blood banking. Transfusion 2004;44:262-7 21. Mohyeddin Bonab MA, Alimoghaddam KA,
Goliaei ZA, Ghavamzadeh AR. Which factors can affect cord blood variables? Transfusion 2004;44:690-3
22. Solves P, Moraga R, Saucedo E, Perales A, Soler MA, Larrea L, et al. Comparison between two strategies for umbilical cord blood collection. Bone Marrow Transplant 2003;31:269-73
23. Solves P, Perales A, Mirabet V, Blasco I, Blanquer A, Planelles D, et al. Optimizing donor selection in a cord blood bank. Eur J Haematol 2004;72:107-12
24. Mancinelli F, Tamburini A, Spagnoli A, Malerba C, Suppo G, Lasorella R, et al.
Optimizing umbilical cord blood collection:
impact of obstetric factors versus quality of cord blood units. Transplant Proc 2006;38:
1174-6
25. Kögler G, Callejas J, Sorg RV, Fischer J, Migliaccio AR, Wernet P. The effect of different thawing methods, growth factor combinations and media on the ex vivo expansion of umbilical cord blood primitive and committed progenitors. Bone Marrow Transplant 1998;21:233-41