임상검체로부터 분리된 Acinetobacter baumannii에서 Metallo-β-lactamase 유전자 검출과 Pulsed Field Gel Electrophoresis의 형별
원광보건대학 임상병리과․순천대학교 대학원 생물학과1
김신무․김은철1․최수연
Typing by Pulsed Field Gel Electrophoresis and Detection of Metallo-β-lactamase Gene Against Acinetobacter baumannii from Clinical Specimens
Kim, Shin Moo., Kim, Eun Cheol1., Choi, Su Youn
Department of Clinical Laboratory Science, Wonkwang Health Science College, Iksan, 570-750, Korea Department of Biology, Graduate School, Sunchon University, Sunchon 540-742, Korea1
We used modified Hodge and EDTA-disk synergy tests for the screening metallo-β-lactamase producing A.
baumannii isolated from a lot of imipenem-resistant clinical strains during the period of 2002-2003 in partial University Hospital, Jeonbuk, Korea. We applied PCR to detect the blaIMP-1 and blaVIM-2 gene metallo-β -lactamase. Antimicrobial susceptibility testing was performed by disk diffusion and agar dilution methods according to National Committee for Clinical Laboratory Standards. Metallo-β-lactamase-producing A.
baumannii by PCR were detected from 6 strains (7.6%) of 79 A. baumannii, while those were 1.3% in IMP-1 type and 6.3% in VIM-2 type. After DNA fingerprinting pattern of pulsed field gel electrophoresis (PFGE), 2 strains showed the same genotype. The MIC range of imipenem against VIM-2 type imipenem-resistant A.
baumannii was 8-32 ㎍/ml, and MIC50 and MIC90 were 8 and 16 ㎍/ml. respectively, but that of imipenem against IMP-1 type A. baumanni was 2 ㎍/ml. To ciprofloxacin, 50% of the metallo-β-lactamase producing A. baumannii were resistant, while all were resistant to ampicillin, cefazolin, cefotaxime and cephalothin.
It is concluded from this study that the modified Hodge and EDTA-disk synergy tests are simple tests for screening metallo-β-lactamase-producing A. baumannii, and IMP-1 and VIM-2 metallo-β-lactamase producing A. baumannii strains in Wonkwang University were rarely detected, thus, the PCR-aided rapid detection will be helpful for the early recognition of emerging blaIMP-1 and blaVIM-2 gene positive clinical isolates which demonstrate consistent resistance to carbapenm, and the PFGE method is useful for epidemiological studies of A. baumannii strains
Key Words: Metallo-β-lactamase, blaIMP-1, blaVIM-2, Imipenem-resistant A. baumannii, MIC 임상병리검사과학회지 : 35권 제2호, 90-98, 2003
1)
교신저자 : 김신무, (우)570-750 전북 익산시 신룡동 344-2, 원광보건대학 임상병리과 Tel : 063-840-1211
E-mail : smkim@wkhc.ac.kr
* 이 논문은 2003년 원광보건대학 연구비 지원에 의해서 연구되었음
I. 서 론
여러 β-lactam 항균제 중에서 carbapenem 항균제는 그 람음성균이 생성하는 β-lactamase에 안정하였다 (Jacoby 등, 1991). 그러나 근년에 임상검체에서 분리되는 Entero- bacteriaceae나 acinetobacter, pseudomonas 등에서 car- bapenem 내성균주가 증가하고 있고, 그들 균주 중에는 penicillin류와 cephalosporin류의 광범위 β-lactam 항균제 는 물론 carbapenem 항균제를 가수분해하는 새로운 metallo-β-lactamase 생성균주가 보고 되고 있다 (Ito 등, 1995; Osano 등, 1994; Senda 등, 1995). 이러한 항균제 내성균의 출현으로 기회성 감염증이나 원내감염의 원인 균으로 문제가 되고 있다 (Riccio 등, 2000). 세균의 내성 획득기전은 항균제의 표적부위의 변화, 효소에 의한 항균 제의 불활화, 세포내에 항균제 투과성의 저하, 세포 외에 항균제 유출 등이 알려지고 있다. 근년에 문제가 되고 있 는 내성 기전으로서는 이와같이 carbapenem을 분해하는 IMP형과 VIM형의 metallo-β-lactamase 생성균주이다.
Metallo-β-lactamase는 Bush의 분류에서는 group 3, Ambler분류에서는 class B로 분류하였고 (Bush 등, 1995), 종래의 penicillinase나 cephalosporinase와는 달리 활성에 Zn++을 필요로 한다. 제3세대 cephem계나 carba- penem계 항균제를 분해하기 때문에 이 효소 생성균은 거 의 β-lactam계열의 항균제에 내성이므로 감염증 치료시에 문제가 되고 있다. 이 metallo-β-lactamase는 Galleni 등 (2001)은 B1, B2 및 B3의 subclass로 나누었고, 또한 imipenem을 가수분해하는 효소라는 의미에서 IMP-1으로 명명된 IMP-1형 metallo-β-lactamase는 1988년에 일본에 서 처음 발견되었으며(Watanabe 등, 1991), 계속해서 Acinetobacter baumannii와 P. aeruginosa 뿐만 아니라 Serratia marcescens와 다른 Enterobacteriaceae에서도 보 고되고 있고, 국내에서도 분리하였다 (Poirel 등, 2000).
현재까지 IMP형은 1-8형까지 알려지고 있다 (Chu 등, 2001).
한편 Lauretti 등 (1999)이 이태리의 Verona에서 분리된 P. aeruginosa가 생성한 새로운 metallo-β-lactamase를 VIM-1이라고 하였고, 이어서 이 효소의 변종인 VIM-2도 프랑스의 Poirel 등 (2000)이, VIM-3는 대만의 Yan 등 (2001)이 분리 보고하였다. 우리나라에서는 VIM-2를 생 성하는 A. baumannii, P. aeruginosa, P. putida 및 S.
marcescens가 분리된 바 있다 (Lee 등, 2002). 또한 acinetobacter는 근년에 중요한 원내 감염균으로 증가되고
있다 (Siegman-Igra 등, 1993). Acinetobacter 균종에 의한 전파방지를 위해서 여러 가지의 역학적인 시험이 이용되 고 있는데 여기에는 전통적으로 항균제 감수성 시험, 생 물형, 혈청형, 파지형이 있으나 (Bouvet 등, 1990) 재현성, 형별역, 식별역이 부족하기 때문에 최근에는 plasmid형, ribotyping, pulsed field gel electrophoresis (PFGE)와 arbitrarily primed PCR에 의한 유전체 DNA 분석 등의 분 자형이 역학 조사에 이용되고 있다 (Dijkshoon 등, 1993;
Gouby 등, 1992; Seifert 등, 1994).
본 연구에서는 전북 일부 대학병원 환자에서 분리된 imipenem 내성 A. baumanni균주로부터 Hodge 변법과 EDTA-disk synergy 시험으로 metallo-β-lactamase 생성균 주를 검출하기 위해서 간이법으로 사용할 수 있는지를 검토하였고, PCR시험으로 blaIMP-1과 blaVIM-2유전자 me- tallo-β-lactamase 생성주의 분포와 역학조사 목적으로 PFGE법을 이용할 수 있는지와 항균제 감수성 양상을 알 아보고자 하였다.
II. 재료 및 방법
균주. 2002년부터 2003년까지 전북 일부 대학병원 환 자의 검체에서 분리된 imipenem내성 A. baumannii 79균 주를 대상으로 하였으며, 균종 동정은 Vitek GNI card (bio Meriux Vitek Inc, Hazelwood, MO, USA)로 하였으 며, 확인은 전통적인 생화학적 방법과 항균제 감수성 시 험 즉 디스크 확산법과 한천희석법으로 하였다.
Metallo-β-lactamase 선별시험. Carbapenemase생성을 위해서는 Hodge변법 (Lee 등, 2001)으로, metallo-β -lactamase 선별을 위해서는 EDTA-disk synergy법 (Lee 등, 2001)으로 시험하였으며, 특히 두가지 시험이 모두 양 성이면 metallo-β-lactamase 시험 양성으로 판독하였다.
Hodge 변법은 지시 세균인 E. coli ATCC 25922를 식염 수를 써서 McFarland 0.5관 탁도로 맞추고 Mueller- Hinton한천에 면봉으로 고르게 접종하였다. 물기가 마른 뒤에 배지 중앙에 imipenem디스크 (30 ㎍, BBL) 놓을 자 리를 정하고 그 곳으로부터 배양접시 가장자리를 향해 carbapenemase생성이 의심되는 시험세균을 진하게 획선 접종하였다. 배양한 접시에 4개의 시험세균을 접종하여 35℃에 15분간 두었다가 imipenem디스크를 중앙에 놓고 하루밤 배양하였다. 결과는 지시 세균의 억제대가 들어가 면 양성으로 판독하여 carbapenemase 생성균으로 선별하
Gene Primer Oligonucleotide sequence (5'-3')
product size (bp)
Base
start Base end
blaIMP-1 IMP1-F 5' cgggtggggcgttgttccta 3'
336 1294
1608
1313 IMP1-R 5' cccgggcctggataaaaaactt 3' 1629
blaVIM-2 VIM2-F 5' ccgcgtctatcatggctatt 3'
757
2299 2318
VIM2-R 5' acgactgagcgatttgtgtgc 3' 3035 3055
Table 1. Oligonucleotide sequences of primers used in this study
였다. EDTA-disk synergy 시험은 carbapenemase 생성이 의심되는 세균을 식염수를 써서 McFarland 0.5관의 탁도 로 희석하고 Mueller-Hinton배지에 면봉으로 접종하였다.
표면이 마른 뒤에 imipenem디스크를 놓고, 적당한 두께 의 여과지로 만들어서 멸균한 디스크를 그 가장자리로부 터 가장자리까지 10 mm되게 놓았다. 빈 디스크에 0.5 M EDTA 10 μL를 넣었다. 35℃에서 하룻 밤 배양 후에 두 디스크 사이의 억제대가 상승효과에 의한 억제대의 현상 이 커지면 양성으로 판독하였다.
Metallo-β-lactamase 유전형 시험. 중합연쇄반응 (polymerase chain reaction, PCR)으로 시험하였다.
blaIMP-1 유전자와 blaVIM-2 유전자의 검출을 위해 이들의
유전자 부위만을 특이하게 증폭시킬 수 있는 primer를 선 택하였으며 (Poirel 등, 2000), 이 primer합성은 제노텍 회 사 (Genotek Co, Daejeon)에 의뢰하여 사용하였다 (Table 1).
시험세균을 tryptic soy agar (TSA, Difco)에 접종하여 37℃에서 하룻 밤 배양한 집락을 증류수 50 ul에 부유시 키고 98℃에서 20분간 가열한 후 이 균액을 DNA추출액 으로 사용하였다. DNA추출액 2 ul, 혼합 primer 2 ul, PCR 혼합액(deoxynucleotide triphosphate, dNTP; Taq polymerase, 10x buffer) 4 ul, 8-MOP 12 ul 즉 총 20 ul를 혼합하여 premix를 만들었다. 이를 Gene Amp PCR system 9600(Perkin-Elmer Centus Corp., Norwalk, CT, USA)으로 94℃에서 5분간, predenaturation, 94℃로 45초 간 denaturation, 55℃로 45초간 annealing, 72℃에서 45초 간 extension, 72℃로 5분간 last extension하는 30 cycle의 PCR을 시행하였다. PCR에 의한 증폭산물 5 ul를 2%
agarose gel(Promega, Madision, W1, USA)의 홈에 넣고 20분간 전기영동하여 band가 있는지를 확인하였다.
PFGE. PFGE는 Seifert 등 (1994)의 방법으로 시험하였 다. 제1일에는 A. baumannii균주를 Mueller-Hinton agar에 접종하여 37℃에서 하룻밤 배양하고, 제2일에는 배양된
집락을 소량 취하여 saline-EDTA 1 ml에 풀어 vortex 혼 합기로 13,000rpm, 5분간 원심하여 상층액 버리고 Pett IV용액을 130 ul씩 넣어서 부유시켰다. 완전히 vortex mixer로 혼합 후 37℃ 항온수조에 담가 두었다. InCert agarose를 증류수로 2% (0.1g/5ml)되게 하여 5분간 가압 멸균하여 52-53℃에 보온한 후 검체당 145 ul로 계산하였 다. Mold를 준비해두기 위해 서로 맞물리게 될 안쪽은 알 코올솜으로 깨끗이 닦아두었다. 위의 부유액에 lysozy- me(10 mg/ml) 1-2 ul를 넣어 조심스럽게 혼합 후 52-53℃
로 보온한 agarose 145 ul를 넣어 기포가 생기지 않도록 혼합한 다음 mold에 채웠다. 실온에 10분간 두었다가 4℃ 냉장고에 10분간 넣어 완전히 굳혔다. 새로운 microtube에 lysis 용액 1 ml씩 넣었다. 이때 1 검체당 lysis용액 1 ml에 lysozyme 1 ul의 비율로 준비하였다. 즉 검체 10개라면 lysis 용액 10 ml에 lysozyme 10 ul를 섞은 것을 각각 1 ml씩 분주하였다. 이때 lysozyme은 한번 녹 이면 다시 사용 할 수 없다. Plug를 자르기 위한 배양접 시, 슬라이드, 칼을 알코올솜으로 소독하여 준비하였다.
Mold에서 plug를 떼어내, 칼로 3등분하여 겹친 다음 lysis 용액 1 ml에 조심스럽게 넣었다. 37℃에 1시간 넣어두었 다. 다음 단계를 위해 항온수조는 50℃로 맞춰두었다.
Lysis 용액을 버리고, ES 용액을 1.5 ml씩 넣었다. 이때 1 검체당 ES 용액 1.5 ml에 10 mg/ml proteinase K 15 ul의 비율로 준비하였다. 즉 검체가 10개라면 ES 용액 15 ml 에 10 mg/ml, proteinase K 150 ul 섞은 것을 각각 1.5 ml 씩 분주하고 50℃ 항온수조에서 하룻밤 두었다. 제3일에 micropipette으로 위의 용액을 조심스럽게 제거하고 PMSF가 들어간 TE buffer 1.5 ml넣고 실온에서 4시간 회 전시켰다. TE buffer를 제거하고 1 mM EDTA pH 8.0 1.5 ml 넣고 10분 이상 회전시켰다. 액체를 버리고 이를 3회 반복하여 씻은 후 최종 1 mM EDTA pH 8.0 1.5 ml씩 넣 고 plug 하나를 꺼내 반으로 자른 뒤 하나는 1 mM EDTA pH 8.0 1.5 ml에 넣어 냉장 보관하고 남은 하나는
0.1 mM EDTA로 채워진 새로운 시험관에 옮겼다. 실온 에서 20분 이상 회전 후 위의 용액을 제거하고 1.5ml 의 restriction buffer를 넣고 실온에서 30분이상 회전시켰다.
다음 단계를 위한 제한 효소는 반응 5분전에 만들었다.
균주수 만큼의 제한효소를 만드는 데 1 검체당 restriction buffer 10x 10 ul, 증류수 79 ul, BSA 0.1% 10 ul, SMA I 1 ul의 비율로 준비하였다. 즉 검체 10개라면 restriction buffer 10x 100 ul, 증류수 790 ul, BSA 0.1% 100 ul, Sma I 10 ul의 비율로 섞었다. 여분의 용액을 완전히 제거한 후 제한 효소를 각각에 100 ul씩 넣고 plug가 밑으로 잘 가라 앉았는지 불빛에서 확인하여 30℃에서 18시간 이상 반응시켰다. 제4일에 위의 용액에 추가로 100 mM EDTA 100 ul씩 넣고 반응을 중단시키기 위하여 4℃에 보관하였 다. 전기영동의 gel제조는 1g의 gold agarose에 0.5x TB buffer 100 ml를 넣고 121℃에서 5분간 가압멸균 후 잘 섞었다. 55℃정도 되면 틀에 붓고 실온에서 1시간 굳힌 후 4℃에서 5분간 두었다. Comb을 빼고 plug를 반으로 잘라서 well에 넣었다. 최종 2% incert agarose로 간격을 메꾸었다.
전기 영동은 새 0.5x TB buffer 2000ml를 영동조에 넣 었다. Gel을 넣기 1시간 전에 전기를 키고 14℃로 냉각 시켰다. 전기 영동은 PAE : 0.5 / 30 sec, 6V, 20시간 하였 다. 염색은 ethidium bromide 0.5 ug/ml로 30분간 염색하 고 흐르는 수돗물로 20분간 탈색 시켰고, UV tran- silluminator를 이용하여 사진을 촬영하였다.
유사도 및 Dendrogram. 본 실험에서 PFGE의 균주간 의 군집분석은 DNA 절편 양상을 분석하여 띠가 있으면 1, 없으면 0으로 계수화하여 character matrix를 작성하였 다. 작성된 정보를 통계프로그램인 NTSYS-pc (numerical taxonomy system과 multivariate analysis system, version 1.51, Applied Biostatistics Inc, USA)에서 Dice의 coeffi- cient법으로 유사성지수 (similarity value)를 구하고 unweighted pair-group method, arithmetic average (UPGMA)법으로 시행한 다음 dendrogram (phylogenetic tree 구조)을 그려서 균주들 간의 유사성 및 유전자형을 구했다. 유사성 지수는 0에서 1의 범위로 표현되는데, 1 인 경우는 두 균주가 유전적으로 같음을 의미하고, 0인 경우는 유전적으로 상동성이 없음을 시사한다.
항균제 감수성 시험. 항균제 감수성 시험은 NCCLS 디스크 확산시험법과 한천희석법으로 하였다 (NCCLS, 2001). Imipenem에 대한 감수성은 imipenem 10 ㎍ 디스 크를 사용하여 시험하였다. 한천희석법에 의한 MIC시험
에 사용한 항균제는 ampicillin, cephazolin, cefotaxime 및 cephalothin (Sigma Chemical Co., St. Louis, Mo.)과 ciprofloxacin (Miles Pharmaceuticals Vast Haven) 및 imipenem (Merk Sharp & Dohme)이었다. 항균제를 규정 된 용제로 녹이고 Mueller-Hinton 한천배지에 0.5-128 ㎍ /ml농도로 만들었다. 시험세균은 tryptic soy broth(TSB, Difco)에 접종하여 35℃, 2시간 배양 후 Densitometer로 McFarland 0.5관 탁도에 맞추고 이어서 식염수로 1 : 10 되게 희석하였다. 시험세균의 접종은 Steers replicator를 써서 접종하였으며, 35℃ 공기환경에서 약 20시간 배양 후에 관찰하고, 세균의 증식을 완전히 억제시킨 최소의 항균제 농도를 최소억제농도(minimum inhibitory concen- tration, MIC)로 정하였다. 감수성 시험의 정도관리를 E.
coli ATCC 25922와 Pseudomonas aeruginosa ATCC 27853으로 동시에 시험하였다.
III. 결 과
Metallo-β-lactamase 생성 A. baumannii균주의 선별.
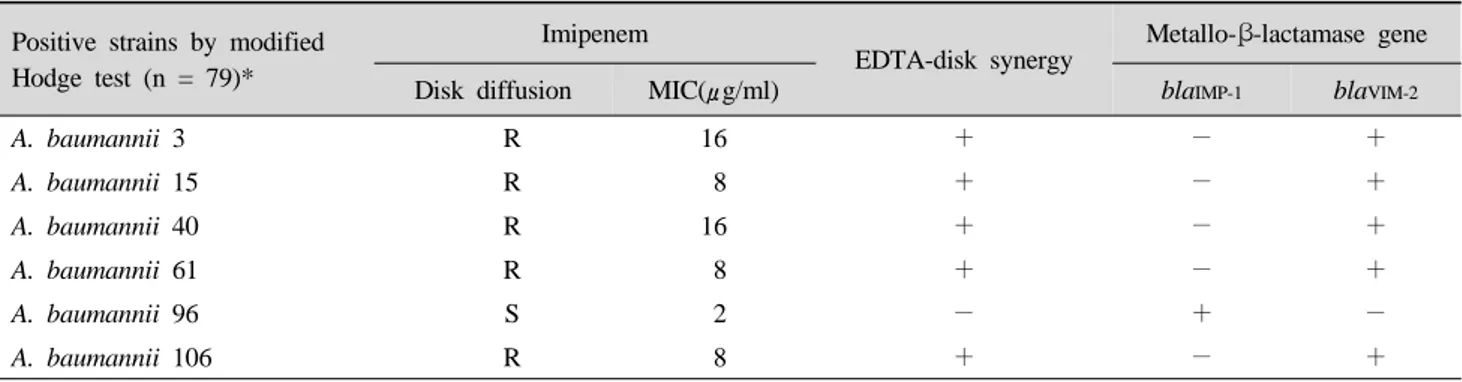
Imipenem 내성 A. baumannii 79균주 중 carbapenemase 선별을 위한 Hodge 변법에서는 6주가 양성이었고, me- tallo-β-lactamase 선별을 위한 imipenem-EDTA synergy 시험에서는 5주가 양성이었다. 한편 Hodge 변법 시험 양 성인 6균주 가운데 imipenem에 5균주가 내성이었고, 1주 가 감수성인 반면, imipenem-EDTA synergy 시험 음성을 보였다 (Table 2, Fig. 1-2).
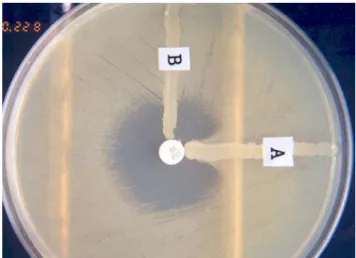
Fig. 1. Modified Hodge test. A, imipenem-hydrolysing strain which distorted the inhibition zone; B, imipenem non- hydrolysing strain with no effect on the zone.
Positive strains by modified Hodge test (n = 79)*
Imipenem
EDTA-disk synergy
Metallo-β-lactamase gene
Disk diffusion MIC(μg/ml) blaIMP-1 blaVIM-2
A. baumannii 3 R 16 + - +
A. baumannii 15 R 8 + - +
A. baumannii 40 R 16 + - +
A. baumannii 61 R 8 + - +
A. baumannii 96 S 2 - + -
A. baumannii 106 R 8 + - +
*No. of isolates tested
Table 2. Comparision of metallo-β-lactamase-producing of A. baumannii by imipenem disk diffusion, agar dilution, modified Hodge and EDTA-disk synergy tests
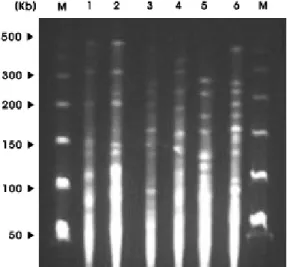
Fig. 3. PCR detection of blaIMP-1 and blaVIM-2
in A. baumannii. Lane: M, size marker; lanes 1-5, 757 bp PCR product of blaVIM-2 gene;
lane 6, negative control (without bacteria);
lane 7, positive control of blaVIM-2 gene; lane 8, 336 bp PCR product of bla IMP-1 gene; lane 9, negative control (without bacteria); lane 10, positive control of bla IMP-1 gene
Fig. 2. EDTA-disk synergy test. A synergistic inhibition zone is shown between an imipenem disk (right) and an EDTA disk (left) by blaVIM-2 gene metallo-β-lactamase producing strain.
PCR에 의한 blaIMP-1와 blaVIM-2 유전자 검출. A. bauma- nnii 79균주 중 metallo-β- lactamase 생성주는 6주이고, 이 중 blaIMP-1 유전자는 1주가, blaVIM-2 유전자는 5주가 양성 반응을 보였다 (Table 2, Fig. 3).
PFGE의 분석. Metallo-β-lactamase 생성 A. baumannii 6균주의 유전적 상관성을 분석하기 위하여 PFGE의 전기 영동 양상을 비교하였다. Genomic DNA를 Sma Ⅰ으로 처리한 후 전기영동한 결과 균주에 따라서 50 - 500 kb범 위에서 9-12개의 띠가 생성되었고, 유사도를 dendrogram
으로 분석할 때에 유전형 Ⅰ-Ⅳ형까지 즉 4종류의 띠 양 상으로 분류되었다 (Fig. 4-5). 유전형 Ⅰ형에 포함된 1과 4균주는 유사도가 87%, Ⅰ형과 Ⅱ형과는 79%이며, Ⅰ,
Ⅱ형 과 Ⅲ형과는 62%, Ⅰ, Ⅱ, Ⅲ형과 Ⅳ형은 17%의 유 사도를 보였다.
항균제 감수성. Table 3에는 blaIMP-1와 blaVIM-2 유전자 양성 A. baumannii 6균주에 대한 감수성 결과이다.
Imipenem에 대해서는 1주가 MIC 2 ㎍/ml이었고, cipro- floxacin에 대해서는 2주가 ≥0.25 ㎍/ml, 1주가 ≥0.5 ㎍ /ml로 감수성을 보였고, ampicillin, cefazolin, cefotaxime 및 cephalothin에 대해서는 모두 내성이었다.
IV. 고 찰
근년에 carbapenem계 항균제를 포함한 대부분의 β -lactam계 항균제에 대해서 내성을 보이는 다제 내성균의 출현이 문제되고 있다. 다제내성 원인중의 일부가 metallo-β-lactamase의 IMP-1과 VIM-2형이다. IMP-1형은 일본에서 P. aeruginosa, S. marcescens, Enterobacter cloacae, Citrobacter freundii, P. stuzeri, Achromobacter xylosoxidans, Klebsiella pneumoniae, P. putida 등에서 자
Fig. 4. Representative PFGE patterns of 6 strains in the metallo- β-lactamase - producing A. baumannii after digestion with Sma
Ⅰ. Lane M, pulse marker; lanes 1-5, blaVIM-2 gene positive; lane 6, blaIMP-1 gene positive.
Fig. 5. Dendrogram analysis of 6 strains in the metallo-β -lactamase -producing A. baumannii by PFGE. Lanes 1-5, blaVIM-2 gene positive; lane 6, blaIMP-1 gene positive.
주 보고되고 있고(Iyobe 등, 2000), VIM-2형효소를 생성 하는 P. aeruginosa는 프랑스에서 (Poirel 등, 2000a), 한국 에서는 P. aeruginosa, P. putida, A. baumannii, Acine- tobacter genomospecies 3, S. marcescens, imipenem-내성 Morganella morganii에서 검출되었다(Lee 등, 2002).
본 연구에서는 임상검체에서 분리된 A. baumannii균주 로부터 metallo-β-lactamase의 선별시험과 IMP-1과 VIM-2형의 유전자 blaIMP-1 blaVIM-2 보유상황을 검토하고, 이 유전형에 양성인 균주에 대하여 PFGE법으로 유전형 을 분류하였고, 항균제 감수성의 양성을 파악하였다. 즉 carbapenemase 생성 선별시험으로 Lee 등 (2001b)의 Hodge 변법을 사용하여 임상균주 A. baumannii 79균주 중 7.6%가 양성을 보였다. 이 시험은 metallo-β-lactamase 생성 균주 뿐만 아니라 IMI-1, Sme-1, NmcA, β-lactamase
등 class A의 비금속성 carbapenemase생성 균주도 이 시 험에서 양성반응을 보인다. Nakano 등 (2001)은 일본에서 분리된 그람음성 간균 중 ceftazidime의 MIC가 ≥25 ㎍ /ml인 균주 중에서 PCR로 blaIMP-1을 검출하였는데, P.
aeruginosa는 23.5%, S. marcescens는 50%가 양성이었고, E. cloacae 40주 중에는 양성이 없었다. blaIMP-1 양성인 균 주 중에는 imipenem의 MIC가 3.1 ㎍/ml로 감수성인 균주 가 2주가 있었다. 본 실험에서는 1균주에서만 blaIMP-1 양 성으로 매우 낮았다.
EDTA-disk synergy 시험은 metallo-β-lactamase의 활 성이 EDTA에 의해서 억제되는 원리를 이용하여 이 효소 를 생성하는 균주를 선별하며, 따라서 class A의 비금속 성 carbapenem 가수분해 효소를 생성하는 균주는 이 시 험에서 음성반응을 보인다. 본 연구에서 임상균주 A.
baumannii 79균주 중 5균주 (6.3%)가 imipenem-EDTA 디 스크 synergy 시유전자를 검출하였다. 저자들은 임상균주 imipenem 내성 A. baumannii 79균주 중 bla VIM-2는 5주가 양성이었고, blaIMP-1은 1주가 양성이었는데 imipenem의 MIC가 2 ㎍/ml로 감염 양성을 보였고, 다른 5균주는 MIC가 8-16 ㎍/ml 이었다.
Metallo-β-lactamase의 유전형을 확인하기 위해서 PCR 에 의해서 blaIMP-1과 blaVIM-2의 수성을 보여 Nakano 등 (2001)의 결과와 동일하였다. 일본에서는 IMP-1 생성인 그람음성세균이 흔한 것으로 보고되었는데 (Ito 등, 1995), 국내에서 Yum 등 (2002)은 imipenem 내성 Acinetobacter 균종 28주 중 1주의 A. baumannii에서 IMP-1 생성을, VIM-2는 11주를 보고한 반면, 김 등 (2002)은 대상균주 21주에서 9주의 IMP-1을, 8주의 VIM-2를 검출하였다. 일본을 비롯한 그리스, 프랑스, 대 만(Yan 등, 2001), 이태리, 포르투갈 및 세계 여러나라에 서 IMP와 VIM형의 metallo-β-lactamase 생성 그람음성균 이 증가 추세에 있다(정 등, 2002). blaIMP-1과 blaVIM-2의 유전자에 대한 본 연구의 결과는 비록 낮은 비율로 검출 되었지만 국내 환자의 결과와 함께 carbapenem에 대한 내성을 획득한 세균의 감염이 확산되고 있음을 시사하였 다.
이 연구에서 metallo-β-lactamase 생성 A. baumannii균 주의 유전적 관련성을 알기 위해서 PFGE를 제한효소인 Sma Ⅰ으로 시행한 후 DNA 띠 양상을 Molecular Analyst Software에 의해서 해석되었고, Tenover 등(1995) 과 Baron 등 (1995)의 기준에 의해에 4개의 유전형으로 분류되었으며, 이 중 유전형 Ⅱ-Ⅳ형은 서로 다른 유래균 I
II III IV
주로 사료되었으나, Ⅰ형에 속한 두 균주는 유사도가 87%로 동일한 유래의 가능성이 높았다.
blaIMP-1 및 blaVIM-2의 유전자는 플라스미드 DNA상에 존재하기 때문에 in vitro에서 유전자가 다른 균종으로 전 달될 가능성이 높다고 알려지고 있고 (Watanabe 등, 1991; Ito 등, 1995; Arakawa 등, 1995; Bandoh 등, 1992), intergron에 삽입된 gene cassette로서 관찰되는데 이 사실 은 이들 유전자가 다른 균종으로 쉽게 전달될 수 있다 (Peter, 1999). 이 연구에서 임상검체에서 분리된 A.
baumannii균주로부터 이러한 유전자가 검출되었기 때문 에 앞으로 많은 균주나 다른 균종으로 내성유전자가 전 파될 가능성이 있기 때문에 그 동향을 주시할 필요가 있 다고 사료된다.
Carbapenem항균제는 여러 β-lactam제에 내성인 세균의 감염치료에 쓸 수 있는 귀중한 항균제이다. 그러나 carbapenem사용이 늘어감에 따라 내성균 출현이 보고되 기 시작하였다(Livingstone 등, 1995). 현재 carbapenem의 내성은 주로 acinetobacter와 pseudomonas에서 관찰되지 만 Enterobacteriaceae 일부 균종에서도 보고되고 있다.
Yum 등 (2002)은 blaIMP-1과 blaVIM-2 유전자 생성 imipenem 내성 A. baumannii와 A. genomospecies 3으로 부터 imipenem MIC가 8-32 ㎍/ml이라고 하였다. 본 연구 에서는 blaVIM-2형 생성 imipenem내성 A. baumannii의 imipenem MIC는 8-16 ㎍/ml로 Yum 등 (2002)의 결과와 비슷하였으나, blaIMP-1유전자 생성 A. baumannii의 imipenem MIC는 2 ㎍/ml로 감수성을 보여 차이가 있었 고, 김 등 (2002)의 보고와는 비슷하였다. 또한 이 시험에 서 ciprofloxacin의 MIC는 ≥0.25-64 ㎍/ml인 반면 시험된 ampicillin, cefazolin, cefotaxime, cephalothin은 MIC가 64
㎍/ml 이상으로 모두 내성을 보였다. 항균제 감수성 시험 에서 imipenem에 감수성을 보인 균주 중에서도 metallo-β -lactamase 생성 A. baumannii가 검출되면 carbapenem항 균제의 치료제로서 사용할 수 없기 때문에 acinetobacter, pseudomonas, Enterobacteraceae 등의 감염증 환자에서 blaIMP-1과 blaVIM-2형 등의 유전자 검출이 필요하겠으며, 이러한 내성균으로부터 전파방지에 필요한 역학적인 조 사가 신속하게 이루어져야 하겠다.
V. 결 론
2002년부터 2003년까지 전북 일부대학 병원 환자검체
에서 분리된 imipenem 내성 A. baumannii 균주로부터 Hodge변법 및 EDTA-disk synergy 시험으로 metallo-β- lactamase생성 균주를 선별하였고, PCR법으로 metallo-β -lactamase 유전자 blaIMP-1과 blaVIM-2를 검출하였으며, 또 한 PFGE방법으로 유전형을 분석하였다. 한편 metallo-β -lactamase 생성 균주에 대해서 디스크 확산법과 한천희 석법으로 항균제 감수성 시험을 하였다. Imipenem내성 A. baumannii 79균주 중 carbapenem 선별을 위한 Hodge 변법은 6주(7.6%)가 양성이었으나 metallo-β-lactamase 선 별을 위한 EDTA disk synergy 시험에서는 5주 (6.3%)가 양성이었다. PCR에 의해서 imipenem내성 A. baumannii 79균주 중 6균주 (7.6%)가 metallo-β-lactamase 생성 균주 이었고, blaIMP-1 유전자 검출에서는 1주 (1.3%)가, blaVIM-2
유전자는 5주 (6.3%)가 양성이었다. Metallo-β-lactamase 생성 A. baumannii 6균주에 대한 유전적 관련성을 알기위 해서 PFGE에 의해 제한효소 처리 DNA띠 양상으로 dendrogram으로 분석한 바 PFGEⅠ-Ⅳ형으로 분류되었 고, 이 중 Ⅰ형에 속한 1과 4균주의 유전자형이 유사한 양상을 보여 동일균 유래주의 가능성이 높다고 생각되었 다. Imipenem에 대한 MIC는 blaIMP-1 유전자 양성 1주에 서 2 ㎍/ml이었고, blaVIM-2 유전자 양성균주에서는 8-16
㎍/ml이었다. 또한 ciprofloxacin에 대한 MIC는 3균주가 각각≥0.25 ㎍/ml, 2-64 ㎍/ml이었다. 한편 시험된 am- picillin, cefazolin, cefotaxime, cephalothin은 64 -≥128 ㎍ /ml이었다. 이상의 결과로 Hodge변법과 EDTA-disk synergy 시험은 metallo-β-lactamase선별시험으로 간단히 사용할 수 있음을 알 수 있었고, 전북원광대학병원 환자 검체에서 metallo-β-lactamase 생성 A. baumannii가 검출 되어 carbapenem 내성균 중에 IMP-1과 VIM-2유전자가 확인되었으며, PFGE법으로 A. baumannii의 역학적 시험 에 이용될 수 있으며, 이러한 항균제 내성유전자가 같은 균종이나 다른 균종으로 전파될 가능성이 높기 때문에 그 동향을 감시해야 하겠고, 이 내성세균에 대한 역학적 인 연구와 확산방지의 대책이 시급하다는 결론을 얻었다.
참 고 문 헌
1. Arakawa Y, Murakami M, Suzuki K, Ito H, Wacharotayankun R, Ohsuka S, Kato N, Ohta M. A novel integron-like element carrying the metallo-β -lactamase gene blaIMP. Antimicrob Agents Chemother
39: 1612-1615, 1995
2. Bandoh K, Watanabe K, Muto Y, Tanaka Y, Kato N, Ueno K. Conjugal transfer of imipenem resistance in Bacteroides fragilis J Antibiot 43: 542-547, 1992 3. Bouvet PJM, Jeanjean PA, Vieu JF, Dijkshoorn L.
Species, biotype, and bacteriophage type deter- minations compared with cell envelope protein profiles for typing Acinetobacter strains. J Clin Microbiol 28:
170-176, 1990
4. Bush K, George AJ, Antone AM. A functional classification scheme for β-lactamases and its correlation with molecular structure. Antimicrob Agents Chemother 39: 1211-33, 1995
5. Chu YW, Afzal-Shah M, Houang ETS, Palepou MFI, Lyon DJ, Woofdford N, Livermore DM. IMP-4, a novel matallo-β-lactamase from nosocomial Acineto- bacter spp. collected in Hong Kong between 1994 and 1998. Antimicrob Agents Chemother 45: 710-714, 2001
6. Dijkshoon L, Aucken HM, Gerner-Smidt P, Kaufmann ME, Ursing J, Pitt TL. Correlation of typing methods for Acinetobacter isolates from hospi- tal outbreaks. J Clin Microbiol 31: 702-705, 1993 7. Gallenni M, Lamotte-Brsseur J, Rossolini GM,
Spencer J, Dideberg O, Frere J-M. The metallo-β -lactamase working group : Standard numbering scheme for class b β-lactamase. Antimicrob Agents Chemother 45: 660-663, 2001
8. Gouby A, Carles-Nurit MJ, Bouziges N, Bourg G, Mesnard R, Bouvet PJ. Use of pulsed field gel electrophoresis for investigation of hospital outbreaks of Acinetobacter baumannii. J Clin Microbiol 30:
1588-1591, 1992
9. Ito H, Arakawa Y, Ohsuka S, Wacharotayankun R, Kato N, Ohta M. Plasmid- mediated dissemination of the metallo-β-lactamase gene blaIMP among clinically isolated strains of Serratia marcescens. Antimicrob Agents Chemother 39: 824-829, 1995
10. Iyobe S, Kusadokoro H, Ozaki J, Matsumura N, Minami S, Haruta S, et al. Amino acid substitutions in a variant of IMP-1 metallo-β-lactamase. Antimicrob Agents Chemother 44: 2023-2027, 2000
11. Jacoby SM, Medeiros. More extended-spectrum β -lactamases. Antimicrobiol Agents Chemother 35:
1697-1704, 1991
12. National Committee for Clinical Laboratory Standards : Performance standards for antimicrobial disk susce- ptibility testing. Eleventh informational supplement.
M100-S11, NCCLS, Wayne, PA, 2001
13. Lauretti L, Riccio ML, Mazzariol A, Cornaglia G, Amicosante G, Fontana R, Rossolini GM. Cloning and characterization of blaVIM, a new intergron-borne metallo-β-lactamase gene from a Pseudomonas aeru- ginosa clinical isolate. Antimicrob Agents Chemother 43: 1584-1590, 1999
14. Lee K, Chong Y, Shin HB, KIM YA, Yong D, Yum JH. Modified Hodge and EDTA-disk synergy tests to screen metallo-β-lactamase-producing strains of Pseudomonas aeruginosa and Acinetobacter species.
Clin Microbiol Infect 7: 88-91, 2001b
15. Lee K, Chong Y, Shin HB, Yong D, Yum JH.
Modified Hodge and EDTA-disk synergy tests to screen metallo-β-lactamase-producing strains of Pseu- domonas and Acinetobacter species. Clin Microbiol Infect 7: 204-207, 2001
16. Lee K, Lim JB, Yum JH, Yong D, Chong Y, Kim JM, Livermore DM. blaVIM-2 cassette-contaning novel integrons in metallo-β-lactamase-producing Pseudomonas aeruginosa and Pseudomonas putida isolates disseminated in a Korean hospital. Antimicrob Agents Chemother 46: 1053-1058, 2002
17. Livingstone D, Gill MJ, Wise R. Mechanism of resistance to the carbapenems J Antimicrobiol Chemother 35: 1-5, 1995
18. Nakano T, Hiramatsu K, Hirata N, Murakami J, Ichimiya T, Tokimatsu I, Yamagata E, Yamakami Y, Yamasaki T, Nagai H, Kadota J, Nasu M, Nakano T, Saikawa T. Clinical characterization of blaIMP- posi- tive gram-negative rods isolated cases. J Japanese Assoc Infect Dis 75: 946-954, 2001
19. Osano E, Arakawa Y, Wacharotayankun R, Ohta M, Horii T, Ito H, Yoshimura F, Kato N. Molecular characterization of an enterobacterial metallo-β -lactamase found in a clinical isolate of Serratia
marcescens. Antimicrob Agents Chemother 38: 71-78, 1994
20. Peter MB. Intergron and gene cassettes. a genetic construction kit for bacteria. J Antimicrob Chemother 43: 1-4, 1999
21. Poirel L, Nass T, Nicolas D, Collet L, Bellais S, Cavallo JD, Nordmann P. Characterization of VIM-2, a carbapenem-hydrolyzing metallo-β-lactamase and its plasmid and integronborne gene from a Pseudomonas aeruginosa clinical isolate in France. Antimicrob Agents Chemother 44: 891-897, 2000
22. Riccio ML. Franceschini N, Boschi L, Caravelli B, Cornaglia G, Fontana R,Amicosante G, Rossolini GM.
Characterization of the metallo-β-alctamase deter- minant of Acinetobacter baumannii AC-54/97 reveals the existence of blaIMP allelic variants carried by gene cassettes of different phylogeny. Antimicrob Agents Chemother 44: 1229-1235, 2000
23. Seifert H, Schulze A, Baginski R, Pulverer G.
Comparision of four different methods for epidemio- logic typing of Acinetobacter baumannii. J Clin Microbiol 32: 1816-1819, 1994
24. Senda K, Arakawa Y, Ichiyama S, Ito H, Nakashima K, Shimokata K, Ohta M. Multifocal proliferation of carbapenem resistant Pseudomonas aeruginosa pro- ducing plasmid-mediated metallo-β-lactamase. Can J Infect Dis 6: 335C (abstr 1242), 1995
25. Siegman-Igra Y, Bar-Yosef S, Gorea A, Avram J.
Nosocomial Acinetobacter meningitis secondary to invasive procedures: report of 25 cases and review.
Clin Infect Dis 17: 843-849, 1993
26. Tenover FC, Arbeit RD, Goering RV, Mickelsen PA, Murray BE, Persing DH, Swaminathan B. Interpreting chromosomal DNA restriction patte군 produced by pulsed field gel electrophoresis : Criteria for bacterial strain typing. J Clin Microbiol 33: 2233-2239, 1995 27. Watanabe M, Iyobe S, Inoue M, Mitsuhashi S.
Transferable imipenem resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother 35: 147- 151, 1991
28. Yan JJ, Hsueh PR, Ko WC, Luh KT, Tsai SH, Wu HM, Wu J-J. Metallo-β-lactamases in clinical Pseudomonas isolates in Taiwan and identification of VIM-3, a novel variant of the VIM-2 enzyme.
Antimicrob Agents Chemother 45: 2224-2228, 2001 29. Yum JH, Yi K, Lee H, Yong D, Lee K, Kim JM,
Rossolini Chong Y. Molecular characterization of metallo-β-lactamase-producing Acinetobacter bauman- nii and Acinetobacter genomospecies 3 from Korea:
identification of two new integrons carrying the bla(VIM-2 gene cassettes. J Antimicrob Chemother 49: 837-840, 2002
30. 김지혜, 정석훈, 김빛나, 정태전, 김택상, 김종철, 전병 찬. 임상검체에서 분리된 imipenem 내성 Acineobacter 생성 metallo-β-lactamase의 유전형. 감염 34: 360-366, 2002
31. 정윤섭, 이경원, 염종화, 용동은, 정소영. 세균의 새로 운 항균제 내성과 기전. P121-148, 서흥출판사, 서울 2002