1 단백질 인산화(Protein phosphorylation)와 세포 신호 전달(cellular signal transduction)
단백질은 세포 내에서 성장, 분화, 사멸을 비롯한 모든 생명현상을 조절하는 능력을 지니고 있으며, DNA 상의 유전 정보로부터 전사(transcription) 및 번역(translation) 과 정을 거쳐서 만들어진다. 만들어진 단백질은 세포의 구
성 성분으로써 세포 골격 형성 등의 기능도 수행하지만, 많은 단백질들은 활성을 가지고 있고, 이들 활성의 조절 은 세포 내 기능 조절을 위한 세포 신호 전달에 매우 중 요한 역할을 담당한다. 단백질이 세포 내 신호전달을 조 절하기 위해서는 그 활성이 조절되어야 하는데, 전체적 인 단백질 양의 조절 또는 활성의 on/off을 통해서 이루어 진다. 단백질 양의 조절에는 또 다른 단백질인 단백질 분해효소(protease)나 ubiquitination system 등이 사용되며,
다양한 세포 기능 조절 기작으로서의 단백질 인산화
건국대학교 동물생명공학과 안재연․이응룡․김장용․조쌍구
Protein Phosphorylation as a Regulatory Mechanism of Various Cellular Function
Jae Yeon Ahn, Eung-Ryoung Lee, Jang-Yong Kim and Ssang-Goo Cho Department of Animal Biotechnology and RCTCP, Konkuk University, Seoul 143-701, Korea
Lots of oncogenics factors including signaling molecules, reactive oxygen species, and receptor proteins are closely involved in protein phosphorylation. Protein phosphorylation is probably one of the most studied post-translational modification mechanism which is very important for regulating the activities of important regulatory proteins in cellular signaling pathways. Here, we shortly presented recent advances in the protein phosphorylation research. Despite of the many studies, more extensive and specific research tools are needed for more comprehensive understanding of the exact molecular targets and functions of the cellular kinases. Recently, several proteomics tools are developed to analyze the phosphoproteomes or kinomes and this highthroughput study on the protein phosphorylation would be very helpful for understanding the mechanisms of many cellular functions such as cell cycle, aging, cancer or neurodegeneration. For the proteomics study, more works are needed to be done with phosphopeptides, but phosphopeptides are difficult to analyse due to the poor ionising capacity under standard MALDI conditions. Several methods have been developed to deal with the low sensitivity and specificity of the phosphopeptide analysis. The optimisation of the approach is described for a standard model peptide and protein. (Cancer Prev Res 11, 1-8, 2006)
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ Key Words: Phosphorylation, MAPK, Proteomics, ROS, PI3K, CDK
Correspondence to:Ssang-Goo Cho
Department of Animal Biotechnology and RCTCP, Konkuk University, 1 Hwayang-dong, Gwangjin-gu, Seoul 143-701, Korea
Tel: +82-2-450-4207, Fax: +82-2-455-1044 E-mail: ssangoo@konkuk.ac.kr
책임저자:조쌍구, ꂕ 143-701, 서울시 광진구 화양동 1번지 건국대학교 동물생명공학과
Tel: 02-450-4207, Fax: 02-455-1044 E-mail: ssangoo@konkuk.ac.kr
접수일:2005년 10월 28일, 게재승인일:2005년 11월 30일
활성화 또는 비활성화의 유도를 위해서는 인산화(pho- sphorylation), glycosylation, methylation, acetylation, protein- protein interaction 등 다양한 modification 방법이 사용된다.
이와 같이 post-translational modification은 세포 내 신호 전 달에 매우 중요한 역할을 수행하는데, 이 중에서 단백질 인산화(protein phosphorylation)는 protein kinase와 phospho- protein phosphatase에 의해서 일어나는 가역적이며 역동 적인 과정으로, 세포 외부와 내부의 환경으로부터 유도 되는 signal이 핵내의 유전자 발현에 영향을 미치는 주된 작용기전이다.1)
인산화에 의한 단백질의 post-translational modification은 세포 상태의 조절에 이용되는 단백질 활성 조절 방법 중 가장 널리 알려진 일반적인 방법으로 세포의 대사, 성장, 분화와 세포막 전이를 포함한 세포 신호전달기작에 중 요한 영향을 미친다. 세포 외부의 신호는 세포막에 존재 하면서 intracellular kinase domain을 가지는 수용체 단백질 로부터 시작되는데, 외부 신호 전달 물질에 의해 활성화 된 수용체의 kinase domain들은 세포질 내의 기질(substra- te)들을 인산화시키며 핵내에서 인산화반응이 종결될 때 까지 또 다른 추가적인 인산화 반응들이 일어나도록 한 다. 전사인자들은 성장 조절 인산화 신호들의 주요 목표 물(recepient)이며, 이러한 전사인자들은 유전자 발현에 영향을 미치게 된다. 인산화와 탈인산화는 특히 전사인 자들의 활성과정에 신속한 변화가 일어날 수 있도록 하 는 주된 작용기전인데, 이와 같은 인산화 상태를 조절하 는 것은 여러 가지 조절 기전에 의해서 전사인자들의 기 능을 바꿀 수 있다. 예를 들어 nuclear localization 시간의 길이를 조절하거나, 크로마틴의 구조를 바꾸거나, 전사 기전 내에서의 단백질간의 상호작용을 조절하는 방법 등이 있는데, 인산화에 의해서 조절되는 수많은 전사인 자들 가운데 몇 가지는 노화과정의 작용 기전을 이해하 는 데 중요한 정보를 제공해 주고 있어, 본 논문에서는 이에 대한 내용을 살펴보고자 한다. 또한, 최근에 활성화 산소(Reactive Oxygen Species; ROS)와 관련된 단백질 인산 화 및 인산화 효소의 기질 특이성에 대한 연구가 활발히 진행되고 있고, 단백질 인산화를 체계적으로 분석하는 기법들이 활발하게 개발되고 있어, 이들에 대해서도 간 단히 살펴보고자 한다.
세포 노화와 세포 주기 조절 단백질들의 인산화
현재까지 세포의 성장과 노화에 작용하는 주된 기전 을 밝히기 위한 활발한 연구가 이루어져서, 세포 주기 및 세포 노화를 조절하는 단백질들에 대한 상세하고 심
도 있는 정보들이 쏟아지고 있다. 세포 주기의 진행에 작용하는 단백질 인자들은 인산화에 의해서 정확하게 조절되며, 세포 주기 진행 과정에서 phosphoester를 가지 고 있는 세포주기 조절인자들은 serine/threonine이나 tyro- sine 잔기들의 인산화에 의해 생겨난다. 인산화 이후의 구조적 변화(conformational change)는 생화학적 활성에 중 요한 영향을 주는데, 본 단락에서는 단백질 인산화가 세 포주기 그리고 세포노화와 어떤 상호 관련성을 나타내 는지 간략하게 설명하고자 한다.
최근까지 노화과정(aging)과 관련된 세포주기 단백질 들의 인산화 상태의 변화는 일부 한정된 숫자만 알려져 왔는데, 이는 부분적으로 노화상태의 비교적 낮은 대사 활성도에 기인하여 phosphate를 단백질에 표지화하기 힘 든 기술적 한계 때문이기도 하다. 단백질인산화가 세포 노화에 중요한 역할을 한다는 증거는 1990년 노화상태 의 인간의 fibroblast에서 낮은 상태의 인산화된 Rb단백질 이 관찰됨으로써 처음 알려졌다.2) 이러한 초기 연구는 SDS-PAGE상에서 mobility shift실험을 통해 확인되었으 며, 더 나아가 앞선 실험에서 확인되지 못한 추가적인 인산화 부위가 확인되었다. 이는 pRb-serine-780 부위이며 in vitro 실험에서 cyclin D1/cdk4의 복합체의 타깃(target)으 로 확인된 부위이다. 이와 관련하여 오랜 기간 세포 노화 과정에서 cdk 비활성화 작용 기전을 확인하려는 많은 노 력들이 이루어져왔으며, p21과 p16 발현의 증가가 일어 난다는 사실이 사람과 쥐의 fibroblast와 melanocyte에서 발견되었다. 증가된 p21과 p16의 발현은 G1/S단계와 관 련된 cdk들을 억제하고 이들과의 결합하는 정도와 관련 이 있으며, 인간 fibroblast 배양에서 homologus recombina- tion에 의해 p21의 발현을 제거하면 세포의 life span이 증 가된다는 연구결과가 발표되었다.3) p21 발현의 억제 자 체로는 노화 상태의 억제에는 부족하지만 fibrotic lineage 의 immortalization에 매우 중요하다는 단서를 제공할 수 있다. 사람의 암에 있어서 흔히 발견되는 p21과 p16 발 현의 소실은 이들 억제자(inhibitor)들이 노화의 checkpo- int에 기여할 것이며 암의 성장을 억제 할 수 있다는 사 실을 입증한다.4)
현재까지, 세포노화와 관련한 cdk inhibitor들의 인산화 상태와 관련된 연구로서 prostatic epithelial cell의 조직 배 양 모델에서 세포노화 과정에서 증가된 p16의 상태와 타 깃 cdk들과의 결합은 인산화 상태의 변화와 상호 관련성 이 있다는 사실이 보고되었다.5) 지금까지 p16의 정확한 인산화 부위는 알려지지 않았지만, 아마도 p16의 인산화 는 세포 내 localization, proteolysis, cdk와의 결합력을 조절 할 것으로 예상된다. p16의 아미노산 서열과 구조를 바
탕으로 이루어진 연구에서 네 가지 인산화 부위를 확인 할 수가 있었는데, 세 개의 serine (S7, S8, 및 S43) 부위와 하나의 threonine (T93) 잔기이다.6) 세포 노화에서 부족한 cyclin의 발현은 cdk 복합체의 억제와 관련성이 없다는 것이 확인되었으며, 이는 노화 상태의 fibroblast에서 cyclinD와 E가 지속적으로 많이 발현되는 것으로 알 수가 있었다. 최근까지 cdk2가 노화에 중요한 역할을 한다는 연구가 활발하게 이루어지고 있으며, cyclinE와의 결합이 노화 상태에서 변화가 없다는 사실이 확인되었다. 이러 한 특정 인산화 부위에 대한 연구는 high throughput method의 발전에 힘입어 비약적인 발전을 거듭하고 있다.
단백질 인산화에 관련된 단백체학적 연구는 세포 노화 과 정을 이해하는데 많은 도움을 줄 것으로 생각된다.
JNK (c-Jun N-terminal protein kinase) 관련 단백질 인산화와 신호전달
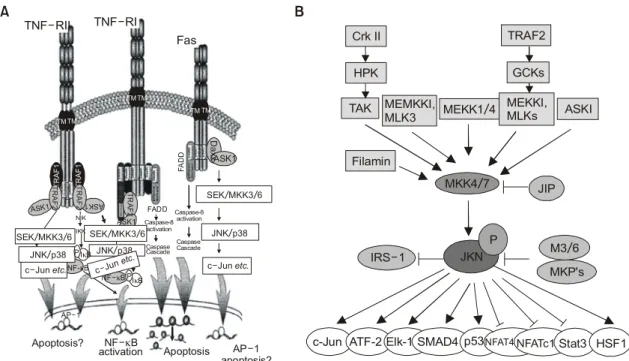
JNK는 p54 microtubule-associated protein kinase로 최초로 정제되었으며, c-Jun의 N-terminal activation domain에 결 합하여 Serine-63과 Serine-73 잔기를 인산화시키는 것으 로 알려졌다(Fig. 1). JNK는 1994년에 처음 cloning 되었으 며, 수많은 형태의 environmental stress와 TNF나 IL-1과 같
은 cytokine들에 의해서 활성화되는 것으로 알려졌다.7) 지금까지 세 가지의 서로 다른 JNK 유전자(JNK1, JNK2, 및 JNK3)들이 발견되었으며, alternative splicing을 통한 10 가지의 이상의 isoform들도 발견되었다.8) JNK 신호전달 과정의 조절에 관여하는 조절 단백질로는 scaffold 단백 질의 일종인 JIP, β-Arrestin2과 Filamin, 그리고 adaptor protein에 속하는 Daxx, CrkII 및 TRAF2 family 등이 있다.
또한, 세포 주기 조절 단백질의 일종인 p21은 γ-irradia- tion에 의한 아폽토시스 과정에서 급속히 유도되고 JNK 에 직접적으로 결합하여 활성을 저해한다는 연구 결과 도 밝혀졌다.
수많은 kinase들이 JNK 신호 전달 과정를 포함한 다양 한 신호전달 과정에서 아폽토시스 조절자로 작용한다.
Protein kinase B는 PI3K의 downstream으로 survival factor들 이나 growth factor들에 의해서 활성화되는데, serine/threo- nine kinase인 Akt는 아폽토시스를 직접적으로 일으키는 다양한 기질 단백질들을 인산화시킴으로써 아폽토시스 를 억제할 수 있다. 최근에는 ASK1 (apoptosis signalregu- lating kinase 1)이 Akt에 의해서 인산화 됨으로써 JNK 신 호전달 과정의 활성화 및 아폽토시스가 저해된다는 연 구결과도 발표되었다. 이러한 세포 외부의 자극에 의한 다양한 신호 전달 과정들과 관련된 JNK 경로는 세포 내
Fig. 1. (A) JNK signaling pathway. TNF-alpha receptor I, II 및Fas receptor 등을 통한 신호는 TRAF 또는 Daxx와 같은 adaptor 단백질을 경유하여 JNK 신호전달 경로를 활성화시켜 아폽토시스 등의 세포 기능 변화를 유도한다. (B) Regulation of JNK phosphorylation and substrates of JNK. JNK는 다양한 MAPKKK에 의해 활성화되는데, MKK4/7에 의한 JNK의 인산화는 JIP, Filamin, IRS-1 등의 단백질에 의해 조절된다. 인산화된 JNK는 다양한 단백질 기질들을 인산화시킨다.
B
Crk II
HPK
TAK
Filamin
MEKK1 4/ MEMKKI,
MLK3
MEKKI, MLKs ASKI
GCKs TRAF2
MKK4 7/ JIP
M3 6/ MKP's P
IRS 1- JKN
c-Jun ATF-2Elk-1SMAD4 p53NFAT4NFATc1Stat3 HSF1
ASK1 ASK1
TRAF2
ASK1
ASK1
Daxx
JNK p38/ c Jun - etc.
JNK p38/
Caspase-8 activation Caspase
Caspase-8 activation
SEK MKK3 6/ /
JNK p38/
c Jun - etc.
Apoptosis? NF-κB
Apoptosis AP 1 apoptosis?
-
NF-κB I Bκ P
PI Bκ FADD
FADD
A TNF RII- TNF RI-
Fas
TM TM
TM TM
TM TM
TRAF1TRAF2 TRAF1TRAF2
AP 1-
Cascade c J-un etc.
NF- Bκ
SEK MKK3 6/ /
SEK MKK3 6/ / Caspase
Cascade NIK
IKK
activation
기능들을 조절하는데 중요한 역할을 담당하며, 암이나 퇴행성 뇌질환 등과 같은 다양한 질병과 관련하여 질병 치료의 잠재적인 주요 타깃이 될 수 있다.
Kinase들의 docking sites
Protein kinase의 기질에 대한 특이성은 지금까지 docking site라고 알려진 짧은 부위에 의해 결정된다고 알려지고 있는데, docking site는 특이적이고 규격화된 구성단위를 가지고 있으며 단백질 인산화의 효율을 증가시킬 수 있 다(Table 1). 일반적으로 protein kinase는 그들의 기질과 tight complex를 이루고 있다고 알려져 있는데, 이러한 tight complex는 scaffold, 또는 직접적으로 kinase와 그들의 기질의 docking site인 짧은 sequence에 high-affinity interac- tion에 의한 bridge를 이루고 있다. 최근 연구들에서9) docking site는 특이적인 kinase에 의해 직접적으로 인산화 가 일어난다고 보고되었으며, 몇몇 docking site는 kinase
에 대한 affinity를 가진 single substrate를 가진다고 밝혀지 고 있어 docking site sequence로부터 잠재적인 kinase su- bstrate를 예측할 수 있다.
MAPK 경로는 여러 가지 세포 외부의 자극에 의해 활 성화되어 세포의 특정 기질의 인산화에 통해 세포 내 여 러 가지 반응이 일어나도록 전환하는데, MAPK의 sub- family에는 JNK, ERK 그리고 p38 등이 있다. 각각의 subfamily는 다른 생물학적 기능을 가졌지만, 모든 MAPK 는 기질을 인산화시킬 수 있는 Ser/Thr-Pro로 알려진 min- imal consensus sequence를 가지고 있다.10) 감마 도메인으로 도 알려져 있는 c-Jun docking site는 JNK의 특이적인 결 합에 요구되며, c-Jun의 감마 도메인과 거의 동일한 se- quence들이 ERK에 의해서 조절되는 bZIP, ETS 그리고 MDS family 같은 많은 전사인자(transcription factor)들에게 서 확인되어지고 있다. 모든 경우에서 kinase-docking do- main (D-domain)은 MAPK에 의한 기질의 인산화를 증가 시키며, D-domain의 중요성은 MAPK상의 특정 acidic residue를 mutation시킨 실험으로 알 수가 있었다. 흥미롭 게도 MAPK, JNK 그리고 ERK에 의해서 인산화되는 전 사인자들에게서 Leu-Xaa-Leu motif가 발견되었는데, D- domain은 일반적으로 MAPK 인산화 부위로부터 100개의 아미노산 upstream N-말단 부위에 위치해 있다. DEF와 D-domain의 결합은 kinase-substrate의 결합을 안정화시킬 수 있으며 kinase 선택적으로 인산화의 효율을 증가시킬 수 있는 것으로 조사되었다(Fig. 2).
Table 1. Protein kinase docking sites
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ Substrate Docking site Protein kinase ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
ATF2 47-66 JNK
Elk-1 D-domain ERK2, JNK
KX2+X3LXL
Crk SH3 domain Abl (proline-
rich region)
Spi-B 1-108 ERK, JNK
AFAP-110 Protein-rich SH3-containing regions tyrosine kinase
c-Jun Delta-domain JNK2
KX2+X4LXL
p130Cas pYXXP Abl
Mnk2, Rsk LAQRRX4L ERK
NF-AT4 A-2domain Casein kinase
SDASSCES 1α
Mnk1, Msk1 LA+RR ERK, p38
p107, p130, p27, RRLFG Cyclin D-Cdk4 p57, p21, E2F1 (MRAIL in cyclin D)
Msk2/Rskb, Lφ++RK p38
PRAK, MAPKAPK2, MAPKAPK3
MKK4 1-87 MEKK1
LIN-1, Elk-1, FXFP ERK
SAP-1a, SAP-2
MEK1, MEK2 270-307 Raf-1
Protein-rich, insert
ꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏꠏ
Fig. 2. Docking mechanism in MAPK signaling. MAPK의 catalytic domain은 MAPKK docking sequence가 있는 docking pocket을 가지고 있다. 활성화된 MAPK는 인산화가 가능한 기질과 interaction 할 수 있다.
활성화 산소(reactive oxygen species: ROS)는 receptor tyrosine kinase (RTK)의 tyrosine
인산화의 조절자
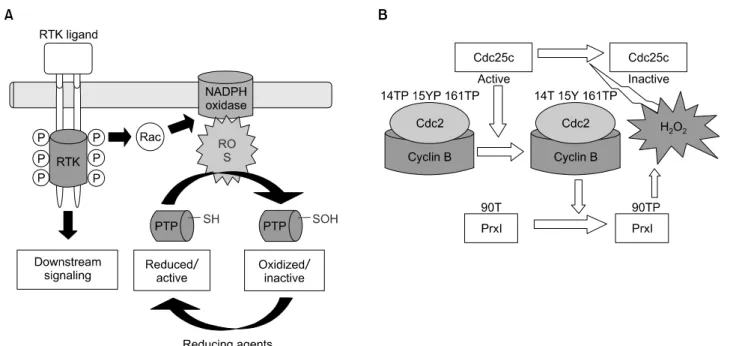
최근 단백질 인산화 연구에서 산화 환원에 의존적인 protein post-translational modification이 세포 내 신호전달 기작에 중요하며, 세포 내 항상성 유지(homeostasis)의 많 은 부분에 관여한다고 보고되고 있다. 이러한 기능은 세 포 성장, 분화 및 아폽토시스와 같은 세포 내 여러 과정 을 조절한다고 보고되고 있으며, 주로 초점이 맞추어진 분야는 인산화와 산화 환원에 의존적인 tyrosine 인산화 신호 전달 경로 사이에서의 receptor tyrosine kinase (RTK) 의 조절자에 대한 연구이다.11) ROS는 세포 성장, 분화 및 아폽토시스의 중요한 조절인자인데, 최근에는 mitochon- drial ROS의 생산이 아폽토시스뿐만 아니라 tumor necrosis factor-α (TNF-α)에 대한 자극,12) hypoxia13) 그리고 integrin 신호전달14)과 같은 세포 내 필수 신호전달에 매우 중요 하다고 알려지고 있다(Fig. 3). 그리고 세포 내 또 다른 ROS의 source는 NADPH oxidase이며, 이는 membrane에서 는 gp91phox와 p22phox를 cytosol에서는 Rac, p67phox, p47phox, 그리고 p40phox와 multi-protein complex를 형성
한다.15) 또한, growth factor의 자극은 세포 내 ROS를 생성 시키고 phosphatidylinositol 3-kinase를 활성화시키는데 이 는 NADPH oxidase의 활성에 의한 small GTPase Rac1의 활 성에 의해 이루어진다고 보고되고 있다. 이러한 세포 내 의 ROS target은 protein tyrosin phosphatase (PTPs)이고 PTP 는 oxidation에 의해 비활성화을 유도하고, 이러한 작용에 의해 RTK 인산화 또는 세포 증식에 대한 활성화를 계속 적으로 유지한다고 보고되고 있으며, 지속적으로 높은 수준의 H2O2는 암 세포에서 많이 찾아볼 수 있다.16) 이러 한 이유는 아마 산화에 의존적인 PTP의 비활성화와 이 에 수반되는 RTK에 의해서 조절되는 세포 증식의 증가 때문일 것으로 생각한다. 또한, phagocyte와 lymphocyte에 서 NADPH oxidase는 산화제를 생성하는데 이는 세포의 방어기작과 염증 반응을 유도하게 된다.
세포 내 ROS는 G-protein-coupled receptors (GPCRs)에 의 한 RTK의 활성화를 유도하는데, 흥미롭게도 H2O2의 생 성은 PTP를 비활성화해서 GPCRs이 RTK를 활성화하도 록 한다. 또한, 항산화제에 의한 H2O2의 생성이 억제되 었을 때 lysophosphatidic acid (LPA)과 angiotensin II에 의한 RTK의 자극과 ERK 활성화를 억제한다. 따라서 세포 내 RTK-활성화 경로에서 PTP redox의 저해는 이러한 GPCRs 로부터 시작된다고 할 수 있다.17) 낮은 농도의 H2O2는
Fig. 3. (A) Reactive oxygen species (ROS) as modulators of receptor tyrosin kinase (RTK) tyrosine phosphorylation, ligand는 RTK의 활성을 유도하고, 이러한 일련의 신호전달 기작은 PI3 Kinase에 의해 조절되는 Rac 활성에 의한 ROS 생성에 기인한다. (B) Inactivation of Prx I by Cdc-2-dependent phosphorylation and the potential significance of the resulting H2O2 accumulation as a mechanism of inhibition of Cdc25C phosphatase. Cdc-2에 의존적 인산화에 의한 Prx I의 불활성화와 H2O2 축적에 따른 잠재적인 Cdc25c phosphatase의 억제 메카니즘의 중요성을 나타낸다.
세포 내 세포 주기 과정과 앞에서도 언급했듯이 세포 증 식을 증가시키는 세포 내 messenger 역할을 하며, 항산화 단백질로 알려진 peroxiredoxin의 활성화에 의한 cdc2에 의한 인산화을 통해 유도하는 messenger로도 알려져 있 다.18,19) 또한, platelet-derived growth factor (PDGF)는 mito- genic 및 migratory 인자이며 세포 내 H2O2 생성을 통한 여러 가지 신호 전달 분자들의 tyrosine 인산화를 조절한 다고 보고되었다. Mammalian 2-Cys peroxiredoxin type II (Prx II; gene symbol Prdx2)는 세포 내 peroxidase이며, PDGF와 epidermal growth factor에 의해 존재하는 세포 내 H2O2 생성을 제거했으며, protein tyrosine phosphatase의 불 활성화을 억제하였다. 이러한 세포 내에서의 H2O2 생성 및 농도의 차이에 의해 여러 가지 단백질들이 인산화되 거나 phosphatase의 활성을 유도해 인산화 수준을 조절할 것이라고 생각한다(Fig. 3).
새로운 단백질 인산화 분석 방법
진핵세포의 신호전달 경로에서 단백질의 인산화는 매 우 중요한 현상이다. 세포신호전달 과정을 이해하기 위 해서 우리는 먼저 서로 다른 조건에서의 인산화 단백질 과 인산화 부위를 조사해야 한다. 왜냐하면 인산화는 역 동적인 과정이며, 세포 신호전달 네트워크에는 이러한 인산화 반응의 정량화가 필요하기 때문이다.
Matrix-associated laser desorption ionisation (MALDI)는 pe- ptide mass fingerprinting 방법에 의해서 단백질 인산화 정 도를 측정하는 성공적인 방법으로써 사용되어져 왔다.
이 기술은 MALDI-time of flight-MS방법에 의해 이론적으 로 알려진 모든 단백질의 절단 부위와 비교하여 펩타이 드의 양을 분석하는 방법이다. 하지만 MALDI-TOF를 이 용한 인산화 펩타이드의 분석은 여러 가지 이유들 때문 에 직접적인 분석 방법이 되기는 어렵다. 첫째, 인산화된 펩타이드의 측정은 일반적으로 positive mode 내의 수많 은 비인산화된 펩타이드나 인산화된 펩타이드의 weak ionization에 의해서 방해를 받을 수 있다. 두 번째로 샘플 내에 있는 isobaric 펩타이드의 존재는 분석을 복잡하게 할 수 있다. 세 번째로 peptide mass fingerprinting은 직접적 인 sequence 정보를 알려주지 않기 때문에 정확한 인산화 부위의 측정은 불가능하다. 마지막으로, 이러한 인산화 의 분석에 사용되는 정제된 단백질이나 펩타이드들은 high performance liquid chromatography (HPLC)나 one or two-dimensional electrophoretic gel 분석 방법이 선행되어져 야 한다. 이러한 난관들을 극복하기 위해서 MALDITOF MS방법에서 인산화 펩타이드들과 특이적으로 반응하는
phophatase를 처리하는 방법이 함께 사용되어져 왔는데, 인산화 펩타이드는 phosphatase의 처리 후에 phosphate (80 Da or multiples)의 소실로 인한 mass shift의 특성에 기초하 여 분석할 수 있다.22) 그러나 MALDI 분석법에서 일반적 인 문제는 완전한 단백질 sequence의 적용 범위를 방해하 는 펩타이드 mixture와 많은 관련이 있다.
한편, MALDI-TOF 분석 방법에서는 한편 인산화 펩타 이드의 serine, threonine, tyrosine의 인산화를 구분할 수가 있다. Positive mode에서 98 Da의 neutral loss를 나타내는 serine이나 threonine 인산화 펩타이드는 단지 80 Da의 loss 를 나타내는 tyrosine 인산화 펩타이드와 구분을 할 수가 있다. MALDI-TOF 분석법에서 IMAC column으로 먼저 인 산화된 펩타이드가 정제된다면 이는 매우 효과적으로 분석이 이루어질 것이다. 이는 MS spectrum에서 suppres- sion effect에 의해 볼 수 없는 펩타이드들을 관찰할 수 있 다. 또한, Quadrupole-TOF, TOF-TOF (MALDI-TOFTOF) 방 법이나 ion trap (MALDI-ion trap) 같은 tandem mass spec- trometers 분석법들과 MALDI 방법을 같이 짝지어서 분석 하면 인산화 펩타이드의 신속한 분석뿐만 아니라 MS/MS sequencing에 의한 인산화 부위의 확인이 빠르게 진행될 수 있다. 이러한 보다 새롭고 발전된 분석법에 의해 더 많은 과학적 발견이 이루어질 것으로 기대된다(Fig. 4).
세포 기능 조절 기전에서 단백질 인산화의 중요성 때 문에 단백질 아미노산 서열 내의 인산화 부위를 보다 빠 르고 신속하게 분석하기 위해서 computational tool이 요 구된다. 이러한 tool들은 새로운 인산화단백질의 아미노 산 서열에 대한 효과적인 분석에 많은 도움이 된다.
PhosphoBase는 실험적으로 분류된 인산화 부위에 대한 데이타베이스이다. 이를 이용하여 인산화 단백질들의 분류와 정확한 인산화 부위에 대한 정보를 공급받을 수 있다. 또한, 특정 펩타이드 상에 작용하는 효소에 관한 kinetic data에 관한 정보도 얻을 수 있다. Swiss-Prot는 또 다른 형태의 단백질 데이터베이스인데, 여기서는 실험 적으로 확인된 인산화 부위와 post-translational modifica- tion으로부터 컴퓨터를 이용한 이론적으로 가능한 인산 화 부위의 annotation이 가능하다.20) NetPhos는 69∼96%
의 민감도를 가지면서 독립적인 단백질 아미노산 서열 상의 인산화 부위를 예측하는 artificial neural network를 제공할 수 있는 분석법이다.21) DIPHOS는 단백질 인산화 부위를 예측할 수 있는 web-based tool로서, 이 방법에서 는 position-specific한 아미노산 frequency와 disorder informa- tion을 이용하여 인산화 부위와 비인산화 부위를 보다 더 정확하게 구분할 수가 있다. 그리고, NetPhosK는 인산화 효소의 인산화 부위에 매우 민감한 특이적인 artificial
neural network algorithm이다. PredPhospho (Prediction of Phosphorylation sites) 프로그램은 통계학적 학습이론의 하 나인 support vector machines (SVM)을 사용하여 단백질에 인산화 되는 부위를 예측하는 시스템인데, SVM은 1995 년에 Vapnik과 Chervonenkis에 의해 제안된 이론으로 생 물학 데이터와 같은 고차원(high-dimension)에서도 수행 능력이 좋은 것으로 알려져 있다. 일부 연구에서 Manning 의 인산화 효소 분류법에 의한 8개의 인산화 효소 집단 중 AGC, CAMK, CMGC 그리고 TK 집단 또는 CDK, CK2, PKA 그리고 PKC 인산화 효소 패밀리에 대한 단백질을 인산화시키는 부위에 대한 예측을 시도했으며 예측의 정확도는 82∼96% 정도로 나타났다. 이 연구에서 데이 터는 단백질의 인산화 부위에 대한 정보는 단백질 데이 터베이스인 SWISS-PROT과 단백질 인산화부위에 대한 데이터베이스인 Phosphobase가 사용되었다.
단백질 인산화 부위를 예측하는 대부분의 연구들은 단지 기질 특이성(substrate specificity)에 초점이 맞추어져 왔는데, 본 단락에서는 단백질 인산화와 관련되는 cataly- tic kinase에 대해 설명하고자 한다. Public domain 상의 data source로부터 알려진 인산화 부위는 annotated protein
kinase에 의해서 분류가 된다. 분석대상들의 민감도를 높 이기 위하여 인산화 부위는 Maximal Dependence De- composition (MDD) 방법에 의해서 다시 cluster되고 sub- group으로 분류가 된다. Hidden Markov Model (HMM)의 profiling 개념에 기초하여 computational model은 인산화 부위의 인산화 효소 특이적 그룹으로부터 분석이 이루 어진다. K-fold cross validation에 의해서 Learned model을 분석한 후, Protein-kinase 특이적인 인산화 부위를 예측할 수 있는 web-based tool을 사용할 수가 있다. 이러한 com- putational tool을 이용한 방법은 더 나은 분석을 위한 밑 거름이 될 것으로 생각한다.
지금까지 설명한 바와 같이 단백질 인산화는 세포 노 화, 세포 주기, 활성화 산소(reactive oxygen species) 등 여러 분야에서 최근 집중적으로 연구가 되고 있다. 또한 아미 노산 서열상의 phospho-acceptor motif들에 관한 연구도 광 범위하게 이루어지고 있으며 수많은 인산화 효소들과 특이적 반응하는 기질들과의 상호 관계에 관해서도 눈 부신 발전을 거듭해 오고 있다. 최근 몇 년 사이 docking interaction에 관한 연구도 많은 진보를 거듭해 오고 있는 데, serine/threonine kinase들인 CDK, MAPK, GSK3 그리고 Fig. 4. Mass-spectrometry에 기초한 전반적인 인산화된 단백질이나 펩타이드를 분석하는 과정과 방법.
PDK1들의 기질 인식에 관한 활발한 연구 결과가 발표되 고 있다. 최신 인산화 부위의 분석 기법 또한 빠른 속도 로 발전되고 있으므로, 이러한 연구 기법들의 발전에 힘 입어 단백질 인산화의 전반적인 분석은 가까운 미래에 많은 연구 분야에 중요한 밑거름이 될 것으로 기대된다.
감사의 글
This work was supported by the Korea Research Foundation Grant funded by the Korean Government (KRF-2005-070- C00095) and a Grant from the ERC program of the Korea Sci- ence & Engineering Foundation (No. R11-2002-100-01000-0).
참 고 문 헌
1) Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S. The protein kinase complement of the human genome.
Science 298, 1912-1934, 2002.
2) Stein GH, Beeson M, Gordon L. Failure to phosphorylate the retinoblastoma gene product in senescent human fibroblasts.
Science 249, 666-669, 1990.
3) Brown JP, Wei W, Sedivy JM. Bypass of senescence after disruption of p21 gene in normal diploid human fibroblasts.
Science 277, 831-834, 1997.
4) Cairns P, Polascik TJ, Eby Y, Tokino K, Califano J, Merlo A, Mao L, Herath J, Jenkins R, Westra W. Frequency of ho- mozygous deletion at p16/CDKN2 in primary human tumors.
Nat Genet 11, 210-212, 1995.
5) Sandhu C, Peehl DM, Slingerland J. p16INK4A mediates cyclin dependent kinase 4 and 6 inhibiton in senescent prosta- tic epithelial cells. Cancer Res 60, 2616-2612, 2000.
6) Blom N, Gammeltoft S, Brunak S. Sequence and structure- based prediction of eukaryotic protein phosphorylation sites.
J Mol Biol 294, 1351-1362, 1999.
7) Kyriakis JM, Banerjee P, Nikolakaki E, Dai T, Rubie EA, Ahmad MF, Avruch J, Woodgett JR. The stress-activated protein kinase subfamily of c-Jun kinases. Nature 369, 156- 160, 1994.
8) Gupta S, Barrett T, Whitmarsh AJ, Cavanagh J, Sluss HK, Derijard B, Davis RJ. Selective interaction of JNK protein kinase isoforms with transcription factors. EMBO J 15, 2760- 2770, 1996.
9) Jacobs D, Glossip D, Xing H, Muslin AJ, Kornfeld K.
Multiple docking sites on substrate proteins form a modular system that mediates recognition by ERK MAPK kinase. Genes Dev 13, 163-175, 1999.
10) Biondi RM, Nebreda AR., Signaling specificity of Ser/Thr protein kinases through docking-site-mediated interactions.
Biochem J 372, 1-13, 2003.
11) Chiarugi P, Cirri P. Redox regulation of protein tyrosine phosphatases during receptor tyrosine kinase signal transduc- tion. Trends in Biochem. Science 28, 509-514, 2003.
12) Sanchez-Alcazar JA, Schneider E, Martinez MA, Carmona P, Hernandez-Munoz I,Siles E, De La Torre P, Ruiz-Cabello J, Garcia I, Solis-Herruzo JA. Tumor necrosis factor increases the steady-state reduction of Cytochrome b of the mitochondrial respiratory chain in metabolically inhibited L929 cells. J Biol Chem 275, 13353-13361, 2000.
13) Vanden Hoek TL, Li C, Shao Z, Schumacker PT, Becker LB.
Significant levels of oxidants are generated by isolated car- diomyocytes during ischemia prior to reperfusion. J Mol Cell Cardiol 29, 2571-2583, 1997.
14) Babior BM. NADPH oxidase: an update. Blood 93, 1464- 1476, 1999.
15) Bae YS, Sung JY, Kim OS, Kim YJ, Hur KC, Kazlauskas A, Rhee SG. Platelet-derived growth factor-induced H2O2
production requires the activation of phosphatidylinositol 3-kinase. J Biol Chem 275, 10527-10531, 2000.
16) Irani K, Xia Y, Zweier JL, Sollott SJ, Der CJ, Fearon ER, Sundaresan M, Finkel T, Goldschmidt-Clermont PJ. Mito- genic signaling mediated by oxidants in Ras-transformed fibro- blasts. Science 275, 1649-1652, 1997.
17) Liebmann C, Bohmer FD. Signal transduction pathways of G protei-coupled receptor and their cross-talk with receptor tyrosine kinases: lessions from bradykinin signaling. Curr Med Chem 7, 911-943, 2000.
18) Greene EL, Houghton O, Collinsworth G, Garnovskaya MN, Nagai T, Sajjad T, Bheemanathini V, Grewal JS, Paul RV, Raymond JR. 5-HT(2A) receptors stimulate mitogen-activated protein kinase via H2O2 generation in rat renal mesangial cells. Am J Physiol Renal Physiol 278, 650-658, 2000.
19) Choi MH, Lee IK, Kim GW, Kim BU, Han YH, Yu DY, Park HS, Kim KY, Lee JS, Choi C, Bae YS, Lee BI, Rhee SG, Kang SW. Regulation of PDGF signalling and vascular remodelling by peroxiredoxin II. Nature 19, 347-353, 2005.
20) Boeckmann B, Bairoch A, Apweiler R, Blatter MC, Estreicher A, Gasteiger E, Martin MJ, Michoud K, O'Donovan C, Phan I, Pilbout S, Schneider M. The SWISS-PROT protein know- ledgebase and its supplement TrEMBL. Nucleic Acids Res 31, 365-370, 2003.
21) Iakoucheva LM, Radivojac P, Brown CJ, O'Connor TR, Sikes JG, Obradovic Z, Dunker AK. The importance of intrinsic disorder for protein phosphorylation. Nucleic Acids Res 32, 1037-1049, 2004.
22) Stensballe A, Andersen S, Jensen ON. Characterization of phosphoproteins from electrophoretic gels by nanoscale Fe affinity chromatography with off-line mass spectrometry anal- ysis. Proteomics 1, 207-222, 2001.