서론
현대 사회에서 나타나고 있는 화석 에너지자원의 고갈 및 지구온난화 문제 등을 효과적으로 해결하기 위해, 전세계적으로 지속 가능한 청정에너지원에 대 한 관심이 높아지고 있으며, 신재생에너지에 대한 연구가 활발히 진행되고 있다. 우리나라에서도 풍 력, 지열, 조력, 바이오연료, 태양에너지 등 여러 신 재생에너지원에 대한 다양한 연구가 진행되고 있으 며, 그 중 무한성과, 청정성 등의 장점을 가지는 태 양에너지원을 적절한 에너지형태로 전환 및 이용하 는 기술에 대한 연구가 활발히 진행되고 있다. 태양 에너지를 전기에너지나 화학에너지 형태로 바꾸는 기술로는 주로 태양전지, 광화학전지 및 광촉매기 술 등으로 나뉠 수 있다[1]. 특히 이산화티탄(TiO2), 아연산화물(ZnO), 주석산화물(SnO2), 스트로튬타이 타네이트(SrTiO3)와 같은 비균일 촉매(Heterogeneous catalysts)를 이용한 광촉매 기술은 스케일-업 가능성 및 높은 경제성으로 인해 많은 관심으로 모우고 있 으며, 현재까지 꾸준한 기술의 발전을 이루어 왔다.
이산화티탄(TiO2)은 자연계에 풍부하게 존재하는 반 도체 물질 중 하나로서, 센서, 에너지저장, 태양전지, 촉매, 광촉매 분야 등 다양하게 사용되고 있다. 특히 이산화티탄은 적절히 높은 광촉매활성과 낮은 독성, 높은 경제성 등의 장점으로 광촉매의 대표적인 물 질로 인식되고 있다[2]. 특히, 1972년 자외선환경에 서 물을 분해하여 수소를 생산할 수 있는 광촉매적 활성이 보고된 이후[3], 물분해, 수소생산, 유해 유기 물 산화와 같은 에너지, 환경분야에서 다양하게 연 구되어 왔다. 이산화티탄의 광촉매 반응의 반응기작 은 다음과 같이 크게 3단계로 이루어진다: (1) 이산화 티탄 밴드갭(Eg 3.0~3.2 ev)보다 높은 빛에너지가 광 촉매에서 흡수되어 전자(electron)와 정공(hole)을 생 성되는 단계, (2) 이러한 전자와 정공은 재결합(Re- combination) 없이 이산화티탄 광촉매표면으로 이 동하는 단계, (3) 마지막으로 표면전자와 정공에 의 해 산화-환원 반응이 일어나는 단계. 일반적으로 이 산화티탄의 광촉매적활성은 밴드갭에너지, 밴드위 치, 기공성, 비표면적, 결정성, 결정상 종류 등의 여
이산화티탄 중공 나노구조체 합성 및 광촉매적 응용
주지봉
한국에너지기술연구원 저탄소공정연구실 선임연구원 jbjoo@kier.re.kr
2002 건국대학교 화학공학과 공학사 2004 서울대학교 응용화학부 공학 석사 2009 서울대학교 화학생물공학부 공학 박사 2009 University of California Riverside, 박사후연구원 현재 한국에너지기술연구원 선임연구원
러 물리/화학적특성에 의해 달라진다고 알려져 있으 며, 지난 수 십년간 이산화티탄 광촉매의 성능을 높 이기 위해, 연구자들은 수 많은 노력을 해 오고 있다.
지난 10년간 다양한 나노소재에 대한 합성방법의 개 발과 발전으로 인하여, 다양한 나노구조체 이산화티 탄 소재가 개발되어 왔으며, 다양한 분야에서 응용 연구가 진행되어 왔다. 그 중 콜로이드 기반 중공 나 노구조체 입자들은 넓은 활성면적, 반응물질의 낮 은 확산저항, 쉬운 기능화 등으로 인해 최근 많은 관 심을 끌고 있다[4]. 지난 몇 년간 이산화티탄 중공 나 노구조체에 대한 많은 진보가 있었으며, 이러한 이 산화티탄 중공 소재를 기반으로 한 다양한 나노구조 체(코어셀, 요크셀, 멀티셀, 하이브리드구조체) 합성 으로 그 영역이 확장되고 있으며[5], 응용에 대한 연 구도 심도있게 진행되고 있다. 본 칼럼에서는 이산 화티탄 중공 나노구조체의 합성과 광촉매적 응용에 관련하여, 최근 연구 추세를 소개하고자 한다. 본 칼 럼에서는 첫번째로, 이산화티탄 중공 나노구조체 제 조의 일반적인 합성 방법을 소개하고, 두번째 이산 화티탄 껍질층(Shell layer)의 특성 조절에 대해서 소 개하며, 세번째 이산화티탄 중공 구조체의 광촉매적 활성에 대하여 토의하고자 한다. 마지막으로 이러한 소재의 다음 연구 분야와 전망과 함께 본 칼럼을 마 무리하고자 한다.
본론
1) 이산화티탄 중공 나노구조체의 제조 그림 1과 같이 일반적으로 이산화티탄 중공 나 노구조체는 자기 중공화(Self-Hollowing)와[6, 7] 주 형제조법(Templated Synthesis)[8-10] 전략으로 제조 된다. 대표적인 자기 중공화를 이용하여 중공 나노 구조체를 제조하는 방법은 특정 조건에서 이산화티 탄 물질의 Ostwald ripening 반응을 이용하는 것이다 [7]. Ostwald ripening은 콜로이드 상태에서 일반적으 로 관찰되는 현상으로서, 작은 졸입자가 용액 속에 용해되어, 큰 입자로 이동 성장하는 현상이다. TiF4 를 이용하여 수열 반응조건에서 특정 온도 및 시간 이후, 결정성 이산화티탄 중공 나노구조체가 생성
되는 현상을 발견된 이후, 이러한 합성전략은 다양 하게 변형되어 사용되어 왔다. 그 반응기작을 자세 히 살펴 보면, TiF4 전구체의 분자들이 반응을 하여, 안정한 구형 TiO2 입자를 생성시킨다. 이후 Ostwald ripening 현상에 의해서 콜로이드 TiO2 코어 부분이 점차적으로 녹아 껍질(shell) 층으로 천천히 침적되어 중공 나노구조체로 변환된다. 이러한 합성 전략은 금속@이산화티탄의 요크셀(Yolk-Shell) 나노구조체 제조에서도 활용될 수 있으며[11, 12], 주석이 포함된 이산화티탄(Sn-TiO2)[13] 및 주석산화물(SnO2)[14] 중 공 나노구조체와 같은 다양한 물질로 확장할 수 있 다. 자기 중공화를 이용한 이산화티탄 중공 산화물 제조법은 표면보호식각(Surface-Protected Etching) 방법이다[6]. 일반적으로 졸-겔방법으로 제조한 콜 로이드 이산화티탄의 경우 그 결정성이 낮고, 화학 적 환경에 따라 입자형태를 변형시킬 수 있다. 먼저 이산화티탄 구형 입자를 졸-겔 방법을 이용하여 합 성한 후, 고분자 물질로 표면을 보호시킨다. 에틸렌 글라이콜과 같은 높은 끓는점을 가지는 용매를 이용 하여, 콜로이드 용액의 온도를 올려 주면, 특정 온도 조건에서 비정질의 이산화티탄이 녹기 시작하며, 고
그림 1. 이산화티탄 중공 나노구조체를 제조하는 일반적인 합성 적 방법을 나타낸 일러스트 (좌) 자기 중공법 (Self-hollowing), (우) 주형 합성법 (Templated synthesis)
분자물질로 표면이 보호된 껍질 부분은 그렇지 않 은 코어 부분보다 상대적으로 안정하기 때문에, 이 산화티탄의 용해가 선택적으로 안쪽부터 일어나고, 속이 빈 중공 나노구조체를 생성시킨다. 제거가 쉬 운 주형을 이용하여, 중공 물질을 제조하는 주형법 (Templated Synthesis)은 이산화티탄 중공 나노구조 체를 제조하는 가장 범용적인 방법이다[1]. 제조하는 방법은 직관적이며, 다음과 같이 3가지 합성 단계로 제조할 수 있다. (1) 첫번째로 제거 가능한 주형 물질 을 제조하고, (2) 나노미터 수준의 이산화티탄층을 주형 물질표면에 증착시킨 이후 (3) 코어 부분의 주 형 물질을 선택적으로 제거하면 이산화티탄 중공 나 노구조체를 제조할 수 있다. 일반적으로 주형물질로 실리카, 고분자, 탄소, 금속 등 다양한 형태가 사용될 수 있으며, 그 중 합성이 쉽고 균일한 크기를 가지는 콜로이드 실리카 구형 입자가 많이 사용된다. 이산 화티탄 중공 나노구조체의 입자 크기는 주형 실리카 입자의 크기를 조절함으로 조절할 수 있으며, 껍질 층 두께는 이산화티탄 전구체를 여러번 증착시키거 나, 합성조건을 조율하여 조절할 수 있다. 주형법을 이용하는 이산화티탄 합성은 재연성이 높으며, 범용 적인 방법이므로 다음 섹션인 특성 조절 및 광촉매 응용 부분은 주형법으로 제조한 샘플을 대상으로 토 의하고자 한다.
2) 이산화티탄 껍질의 결정특성 조절
이산화티탄은 아나타제(anatase), 루타일(Rutile), Brookite(브루카이트)의 세 종류의 결정 형태를 가지 며, 광촉매의 활성 측면에서 결정성이 잘 발달된 아 나타제 이산화티탄 입자가 가장 높은 활성을 보인다 고 알려져 있다. 그러나 일반적으로 타이타니움 알코 올사이드(Titanium Alkoxide) 계열의 화합물을 이용하 여 졸-겔 합성법으로 제조된 콜로이드 이산화티탄입 자의 경우 그 결정 특성이 비정질을 띈다고 알려져있 다. 광촉매적 활용을 고려하면, 활성이 없는 비정질 의 중공 이산화티탄 입자를 아나타제 결정성의 입자 로 변환하는 것은 매우 중요하다. 본 섹션에서는 이 산화티탄의 결정성을 높이기 위해서, 사용될 수 있는
여러가지 합성 방법을 소개하고자 한다.
실리카 표면보호 소성- 이산화티탄 물질에 결정 성을 부여하는 가장 단순한 방법은 열적소성 방법이 다. 일반적으로 비정질의 이산화티탄 소재는 높은 소성 온도조건에서 준 안정적인(Metastable) 아나타 제 결정성으로 결정화된 후, 더 가혹한 소성조건에 서 안정적인 루타일 결정상으로 변한다. 결정성 이 산화티탄 중공 나노구조체를 제조하기 위해서 주형 방법으로 실리카코어 부분을 녹여낸 비정질의 중공 이산화티탄 나노구조체를 단순히 고온의 소성공정 을 거쳐 제조할 수 있을 것이라 생각할 수 있다. 그러
그림 2. (좌) 이산화티탄 중공 나노구조 입자를 제조하기 위한 실 리카 표면 보호 소성 합성법을 나타내는 일러스트 및 (우) 각 합성 단계별 제조된 입자의 전자현미경 사진 (a) SiO2 입자 (b)SiO2@ TiO2 입자, (c) SiO2@TiO2@SiO2 입자 및 (d) 최종 hollow TiO2 입 자. Adapted with permission from ref [10].
나 염기용액(NaOH)으로 식각처리한 비정질의 이산 화티탄 중공 물질은 그 껍질층에 다량의 염기의 금 속양이온(Na+)을 포함하고 있기 때문에, 아나타제 결 정성보다 쇼듐 타이타네이트로 결정화가 된다. 다 른 방법으로 실리카@이산화티탄 코어-셀 입자를 소 성하여 이산화티탄 껍질층을 결정성층으로 만든 후, 실리카 코어 부분을 선택적으로 녹여 결정성 이산화 티탄 중공 입자를 제조할 수 있을 것이다. 그러나, 고 온의 소성 조건에서 나노미터 이산화티탄 껍질층의 결정화 속도가 조절되지 않아, 많은 수의 입자들이 캡슐 형태의 중공 나노입자 구조를 유지하지 못하고 깨어진 형태로 존재하게 되어, 이후 응용 분야에서
제한을 받을 수 있다. 이러한 문제를 해결하기 위해 Yin 그룹에서는 최근 실리카 표면보호 소성법을 개 발하였고, 중형 기공성 중공 이산화티탄 나노 구조 체를 성공적으로 제조하였다[10]. 그림 2와 같이 합 성의 개략적인 방법은 다음과 같다. 주형인 실리카 입자를 제조하고, 나노미터 수준의 비정질 이산화티 탄층이 증착된 SiO2@TiO2 코어셀 입자를 제조한다.
이후 TiO2(이산화티탄)층 표면에 다시 한번 더 실리 카층을 증착하여 SiO2@TiO2@SiO2 제조하여 고온에 서 소성하는 것이다. 실리카는 일반적으로 고운(1000
℃)도 이상의 조건에서도 비정질의 성질을 잘 유지 한다고 알려져 있으며, 바깥 쪽의 실리카층은 고온 소성 조건에서도 안정적으로 이산화티탄의 중공 나 노 구조를 잘 유지시키며, 이산화티탄은 천천히 아 나타제 결정성으로 결정화된다. 소성 이후 실리카층 의 선택적 제거를 통해 이산화티탄 중형기공성 중공 나노구조체를 제조할 수 있다.
실리카 부분 식각 및 재소성- 상기의 실리카 표면 보호 소성법을 이용하여, 중형 기공성 결정성 이산 화티탄 중공 나노 구조체를 제조할 수 있으나, 제일 바깥 쪽 실리카 껍질층은 이산화티탄 결정화 속도를 너무 느리게 하여, 900℃ 이상의 높은 소성 조건에서 도 결정 성장을 5 nm 이하로 제한하여 촉매적 응용 에서 낮은 활성을 보이게 만든다. 이러한 결정 성장 의 한계는 실리카 껍질층에 의한 이산화티탄층이 결 정화될 수 있는 충분한 공간이 부족하기 때문이다.
중공 구조를 유지하면서 결정성을 높은 이산화티탄 입자를 제조하기 위해 Yin 그룹에서는 “실리카 부분 식각 및 재소성”이라는 새로운 합성 공정을 제안하 였다[9]. 실리카 껍질층이 이산화티탄 표면층에 증착 될 때, 실리케이트 물질들은 이산화티탄층에 함침되 어 다른 실리카 영역보다 중합이 적게 되어 쉽게 식 각되어 녹아 나올 수 있는 특성을 가지게 된다. 그림 3과 같이 SiO2@TiO2@SiO2 입자를 고온소성 이후, 이 산화티탄층에 근처에 있는 실리카를 부분적으로 제 거하여 이산화티탄의 결정화에 유리하게끔 공간을 생성시킨 이후, 재소성을 하면 이산화티탄층의 결정 크기가 더 성장하며 입자의 실리카들을 완전히 제거
그림 3. (좌) 이산화티탄 중공 나노구조 입자를 제조하기 위한 실 리카 부분 식각 및 재소성 합성방법을 나타내는 일러스트 및 (우) 각 합성단계별 제조된 입자의 전자현미경 사진 (a) 소성한 SiO2@ TiO2@SiO2 입자 (b)실리카부분식각 이후 SiO2@TiO2@SiO2입자, (c) 재소성한 SiO2@TiO2@SiO2 입자 및 (d) 최종 hollow TiO2 입 자. Adapted with permission from ref [9].
하면 결정 크기가 다양한 이산화티탄층의 중공 나노 구조체를 제조할 수 있다.
무기산 처리에 의한 염기 양이온 제거 및 소성- 실리카 부분 식각 및 재소성 공정으로 결정성이 뛰 어난 이산화티탄 중공 나노 구조체를 제조할 수 있 었지만, 복잡한 합성 방법과 두번의 소성 공정은 소 재 합성의 비용을 증가시키는 단점을 포함하고 있 다. 최근 동 연구팀은 염기 용액으로 실리카를 제거 한 비정질의 이산화티탄 중공 나노 구조체를 무기산 용액을 이용하여 염기 양이온을 제거한 후, 소성을 하여 이산화티탄 중공 나노 구조체를 제조할 수 있 는 쉬운 방법을 제안하였다[8]. 콜로이드 구형 실리
카에 비정질의 이산화티탄을 증착한 SiO2@TiO2 입 자를 염기의 NaOH로 실리카를 식각하는 단계에서 실리카는 수용액에 용해될 수 있는 소듐 실리케이트 로 반응하여 제거되고, 과량의 Na+ 이온은 이산화티 탄층에 남겨지게 된다. 앞서 언급하였듯이, Na+을 제 거하지 않고 소성을 할 경우, 중공입자는 소듐 타이 타네이트로 결정화되면서, 구조적 안정성을 잃어버 려 껍질층들이 깨지게 된다. 하지만, 비정질 이산화 티탄층에 남겨진 Na+ 이온은 무기산 용액으로 쉽게 H+ 이온으로 치환이 된다(그림 4). 수소 이온으로 치 환된 비정질의 이산화티탄 중공 입자는 고온 소성 조건에서 탈수반응과 결정화 반응기작을 통해, 캡슐 형태의 나노 구조를 잘 유지하는 순수한 아나타제 (혹은 루타일) 이산화티탄 중공 나노 입자로 결정화 된다. 그림 4에서 관찰할 수 있듯이, 실제적으로 이 러한 단순한 무기산 처리와 열처리를 통해 고온소성 조건(~950℃) 조건에서도 안정하며, 광촉매 반응에 활성이 높은 결정성을 가지며, 균일한 이산화티탄 중공 나노 입자를 제조할 수 있다.
3) 광촉매적 응용
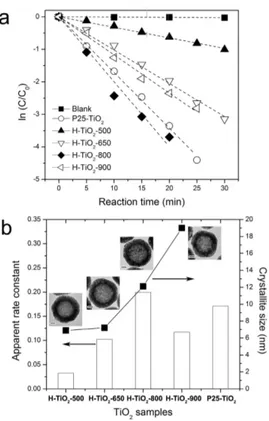
이산화티탄 소재는 다양한 응용분야에 사용되며, 특히 대표적인 광촉매 물질로 알려져 있다. 본 섹션 에서는 이산화티탄 중공 나노구조체의 광촉매적 응 용과 그 활성에 대해서 간략히 언급하고자 한다. 이 산화티탄의 광촉매 활성은 표면적, 표면 특성, 분산 도, 결정성과 결정상 등의 여러가지 물리화학적 특 성에 의해 결정된다. 상기에 언급한 이산화티탄 중 공 나노입자는 상대적으로 넓은 활성 면적과, 수용 액상에서 탁월환 분산도, 그리고 조절가능한 결정 특성을 가지며, 광촉매 소재로 매우 적합하다.[15] 앞 서 언급한 “무기산 처리에 의한 양이온 제거 및 소 성” 방법을 통해 제조된 이산화티탄 중공 입자는 균 일한 입자크기와 소성 조건에 따른 발달된 결정특 성, 탁월한 수용액 분산도를 가지며, 실제적으로 염 료 분자의 광화학적 산화 반응에서 높은 촉매 활성 을 보였다[8]. 그림 5에서 볼 수 있듯이, 800℃ 조건 에서 소성한 이산화티탄 중공 입자가 가장 높은 활
그림 4. (위) 이산화티탄 중공 나노구조 입자를 제조하기 위한 무 기산 처리에 의한 염기 양이온 제거 및 소성방법을 나타내는 일러 스트 및 (아래) 다양한 소성온도에서 2시간 동안 소성 후 제조된 입자의 전자현미경 사진 (a) 소성전 (b) 500℃ (c) 650℃ (d) 800℃
(e) 900℃ (f) 950℃. Adapted with permission from ref [15].
성을 보였으며, 상용 P25-TiO2 촉매 보다 높은 촉매 활성을 보이는 것을 확인하였다. 특히 염료분자의 분해 속도는 광촉매 활성에 가장 중요한 요소인 아 나타제 결정성 정도에 따라 증가되며, 최적의 조건 이 존재하는 것을 확인하였다. 900℃ 이상에서 소성 한 이산화티탄 샘플의 경우, 높은 활성을 띄는 아나 타제가 결정크기가 큰 루타일상으로 성장하여 입자 의 표면적뿐만 아니라 실제 활성 면적도 줄어 들어 그 활성이 감소한 것이다.
결론
이산화티탄 소재의 독특한 물리화학적 특성과 다 양한 응용분야로 인해 재료과학, 물리학, 화학, 공 학 분야에서 매력적인 소재로 알려져 왔다. 지난 10 년간 나노소재 제조 기법의 발달로 인해, 중공 형태 를 가지는 이산화티탄 입자를 성공적으로 제조 할
수 있었다. 본 칼럼에서는 최근 몇 년간 이산화티탄 중공 나노구조체를 제조하는 일반적인 합성적 방법 과, 광촉매적 응용을 간단히 요약하였다. 본 칼럼에 서 요약한 예들은 현재에도 수행되고 있는 수많은 이산화티탄 중공 소재에 대한 연구 중 아주 일부분 에 해당한다. 최근 이슈화 되고 있는 에너지/환경적 응용 및 성능 증가 등의 여러가지 도전적인 문제를 해결하려면, 수많은 연구가 더 수행되어야 한다. 이 러한 과제들은 다음과 같은 주제일 것이다; (1) 경제 성을 가지며 전자-정공 분리가 용이한 가시광선 감 응 이산화티탄 광촉매, (2) 벌크 반응물질 전달이 용 이한 구조를 가지는 이산화티탄 구조, (3) 높은 활성 과 선택도를 위한 선택적 기능화를 가진 이산화티탄 입자. 최근 다양한 합성 방법을 이용하여, 여러 가지 시너지 효과를 가지는 콜로이드 이산화티탄 기반 광 촉매들의 제안은 매우 희망적이다. 기공성이 조절된 이산화티탄 입자, 플라즈모닉 입자와 이산화티탄의 샌드위치 구조의 콜로이드 광촉매, 혹은 이산화티탄 기반 코어셀 광촉매 등은 여러 문헌에서 상용 이산 화티탄 촉매를 능가한 성능을 보이고 있다. 현재까 지는 실험실 수준에서 증가된 활성과 성능, 시너지 효과에 의한 독특한 특성을 보이고 있으나, 여러분 야의 기술들이 융합된다면, 머지 않아, 경제성이 있 으며, 고활성의 나노구조 중공 이산화티탄 기반 광 촉매의 대량생산 및 그 관련 제품들의 실용화, 상업 화가 가능하리라 전망해 본다.
◈ 참고문헌
1. J. B. Joo, Q. Zhang, M. Dahl, F. Zaera and Y. Yin, J.
Mater. Res., 28 (03), 362 (2013)
2. J. B. Joo, R. Dillon, I. Lee, Y. Yin, C. J. Bardeen and F.
Zaera, P. Natl. Acad. Sci. USA., 111 (22), 7942 (2014) 3. A. Fujishima and K. Honda, Nature 238 (5358), 37
(1972)
4. J. B. Joo, A. Vu, Q. Zhang, M. Dahl, M. Gu, F. Zaera and Y. Yin, ChemSusChem 6 (10), 2001 (2013) 5. I. Lee, J. B. Joo, Y. Yin and F. Zaera, Angew. Chem.
Int. Edit., 50 (43), 10208 (2011)
6. Y. Hu, J. Ge, Y. Sun, T. Zhang and Y. Yin, Nano Lett., 7 (6), 1832 (2007)
7. H. G. Yang and H. C. Zeng, J. Phys. Chem. B., 108 (11), 3492 (2004)
그림 5. (a) 무기산 처리에 의한 염기 양이온 제거 및 소성방법으 로 다양한 온도조건에서 소성이후 제조한 이산화티탄 중공 나 노구조 입자의 광촉매 활성과 (b) 각 샘플들의 결정 크기와 속도 상수사이의 관계를 나타내는 그래프. Adapted with permission from ref [15].
8. J. B. Joo, I. Lee, M. Dahl, G. D. Moon, F. Zaera and Y.
Yin, Adv. Funct. Mater. 23 (34), 4246 (2013)
9. J. B. Joo, Q. Zhang, M. Dahl, I. Lee, J. Goebl, F. Zaera and Y. Yin, Energ. Environ. Sci., 5 (4), 6321 (2012) 10. J. B. Joo, Q. Zhang, I. Lee, M. Dahl, F. Zaera and Y.
Yin, Adv. Funct. Mater. 22 (1), 166 (2012) 11. B. Liu and H. C. Zeng, Small 1 (5), 566 (2005) 12. J. Li and H. C. Zeng, Angew. Chem. Int. Edit., 44
(28), 4342 (2005)
13. J. Li and H. C. Zeng, J. Am. Chem. Soc.129 (51), 15839 (2007)
14. X. W. Lou, Y. Wang, C. Yuan, J. Y. Lee and L. A.
Archer, Adv. Mater. 18 (17), 2325 (2006)
15. J. B. Joo, M. Dahl, N. Li, F. Zaera and Y. Yin, Energ.
Environ. Sci., 6 (7), 2082 (2013)