서 론
천식은 기도과민증과 가역적인 기도폐쇄의 특징을 보이는 만성 기도염증질환으로 병태생리적으로 기도벽 내 다수의 비만 세포, 림 프구 및 호산구의 침윤이 흔히 관찰되는데 이는 2형 조력 T 세포
(type 2 helper T cells, Th2)가 분비하는 사이토카인에 의해 조절된 다.
1,2이 중 interleukin (IL)-13은 기도염증, 섬유화, 기도과민성, 점 액 과분비 등을 유발함으로써 천식의 병태생리에 있어 핵심적인 역 할을 하는 것으로 알려져 있으며 실제로 폐 특이적으로 IL-13이 과 발현된 마우스모델에서 기도과민성, 폐 내 면역세포 침윤, 점액생
Allergy Asthma Respir Dis 9(2):76-83, April 2021 https://doi.org/10.4168/aard.2021.9.2.76ORIGINAL ARTICLE
Correspondence to: Hye-Ryun Kang https://orcid.org/0000-0002-2317-4201
Department of Internal Medicine, Seoul National University College of Medicine, 103 Daehak-ro, Jongno-gu, Seoul 03080, Korea
Tel: +82-2-2072-0820, Fax: +82-2-764-2199, Email: helenmed@snu.ac.kr * These authors contributed equally to this study as co-first authors.
This research was supported by a grant no. 04-2014-3030 from Seoul National University Hospital Research Fund.
Received: June 4, 2020 Revised: June 29, 2020 Accepted: June 29, 2020
© 2021 The Korean Academy of Pediatric Allergy and Respiratory Disease The Korean Academy of Asthma, Allergy and Clinical Immunology This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License
Interleukin-13으로 유도된 폐 병태생리에 대한 atorvastatin의 치료 효과
모요셉,
1,* 배보람,
1,* 김정현,
1김율담,
1손경희,
2강민종,
3이춘근,
4조상헌,
1,2강혜련
1,21서울대학교병원 알레르기 임상면역학교실, 2서울대학교 의과대학 중개의학과, 3예일대학교 의과대학 호흡기내과, 4브라운대학교 의과대학 분자미생물 및 면역학과
Therapeutic effect of atorvastatin on interleukin-13-induced lung pathology
Yosep Mo,1,* Boram Bae,1,* Junghyun Kim,1 Ruth Lee Kim,1 Kyunghee Son,2 Min-Jong Kang,3 Chun-Gen Lee,4 Sang-Heon Cho,1,2 Hye-Ryun Kang1,2
1Institute of Allergy and Clinical Immunology, Seoul National University Medical Research Center, Seoul; 2Department of Internal Medicine, Seoul National University College of Medicine, Seoul, Korea; 3Pulmonary, Critical Care and Sleep Medicine, Yale University, School of Medicine, New Haven, CT; 4Department of Molecular Microbiology and Immunology, Division of Biology and Medical Sciences, Brown University, Providence, RI, USA
Purpose: Asthma is a common chronic lung disease, in which interleukin (IL)-13 is implicated as a central regulator of IgE synthesis,
mucus hypersecretion, airway hyperresponsiveness (AHR), and fibrosis. This study was designed to determine the anti-inflammatory effect of atorvastatin, a widely used lipid-lowering agent, on the IL-13-induced lung pathology through the modulation of macro- phages.
Methods: Atorvastatin (40 mg/kg) was given to transgenic mice overexpressing IL-13 (IL-13 TG mice) and their wild type littermates
by oral gavage for 2 weeks. AHR, numbers of inflammatory cells in the airway, and cytokine levels in IL-13 TG mice were measured.
Using the alveolar macrophage cell line CRL-2456, the direct effect of atorvastatin on macrophages activated by recombinant IL-13 was assessed.
Results: Significant reduction in total leukocytes and alleviation of AHR were observed with administration of atorvastatin in IL-13
TG mice compared to those without atorvastatin treatment (P< 0.05). Atorvastatin administration resulted in upregulation of IL-10 in the lungs of IL-13 TG mice (P< 0.05). In addition, mRNA expression of connective tissue growth factor, fibronectin, and type III col- lagen as well as chord length enhanced by IL-13 overexpression were reduced by atorvastatin administration (P< 0.05). M2 macro- phage markers, such as Ym-1 and CD206, were decreased, while M1 macrophage marker, inducible nitric oxide synthase, was increased upon atorvastatin treatment (P< 0.05). Administration of atorvastatin resulted in improved removal of apoptotic cells (P< 0.05).
Conclusion: The results of this study reveal a potential of atorvastatin as an effective antiasthmatic agent by reducing IL-13-induced
lung inflammation via the modulation of macrophage polarization. (Allergy Asthma Respir Dis 2021;9:76-83)
Keywords: Asthma, interleukin-13, Atorvastatin, Antiasthmatic agents, Macrophage
성세포의 증식 등의 천식의 특징적인 염증반응을 확인하였으며 기 도의 섬유모세포 증식과 교원질 증가 등의 만성적인 기도개형 소견 을 보였다.
3,4대식세포는 폐와 기도 내에 가장 많이 존재하는 세포로 외부 항 원에 대한 문지기 역할을 담당하며 기도의 선천 면역 반응을 조절 한다. 대식세포의 표현형은 크게 M1, M2로 구분되며 Th1, Th2 사 이토카인을 포함한 다양한 자극원에 따라 분화양상이 달라지는데 Th2 사이토카인은 M2 대식세포로의 분극을 유도한다.
5,6M2 대식 세포는 항상성 및 염증을 조절하며 손상된 조직을 복구하는데 최 근 호산구 유입과 efferocytosis 등에 관여하여 알레르기천식 발생 에 기여함이 보고되었다.
7,8또한 CCL17, CCL22 등의 케모카인을 분비함으로 Th2 세포를 모집하며 M2 표지자로 알려진 arginase-1 (Arg-1), Ym-1 등은 각각 기도과민성, 기도 폐쇄, 호산구 유입을 유 도하는 등 알레르기성천식의 병태생리적 증상에 영향을 미친다.
9이에 따라 대식세포와 천식과의 연관성을 이용하여 임상시험에 적 용 및 해석하는 시도가 이어지고 있지만, 아직까지 대식세포를 이 용한 항천식 치료 효과의 기전에 관해 더 많은 연구가 필요하다.
10Statin은 3-hydroxy-3-methylglutaryl-coenzyme A 환원효소 억 제제이며 고지혈증과 같은 심혈관계 질환에 쓰이는 약물로 간의 콜레스테롤 합성을 억제한다.
11하지만 최근 콜레스테롤 합성 저해 효과뿐만 아니라 다양한 질병에서 statin이 치료 효과를 보이며 이 는 statin의 항염증 및 면역제어 효과에 기인한 것으로 예상된다. In vitro 연구에서 simvastatin, pitavastatin이 수지상세포의 항원제시 능을 감소시킴으로 항원제시세포의 기능과 성숙을 방해하여 염증 을 완화할 수 있다는 가능성을 제시하였다.
12하지만 statin의 다양 한 항염증 효과의 정확한 기전과 각 질병에 대한 작용은 아직 정확 히 밝혀지지 않았다.
만성기도질환인 천식의 특징을 반영하여 이 연구에서는 단기간 ovalbumin (OVA)으로 유도한 급성천식 모델이 아닌 만성천식 모 델에서 statin의 항천식 효과를 확인하고자 IL-13 과발현 모델을 이 용하였고 atorvastatin 경구 투여 시 유도되는 항천식 효과를 확인 하였다. 이를 통해 기존에 연구가 많이 되지 않은 폐포 대식세포 활 성화에 대한 atorvastatin의 효과를 분석하여 대식세포 조절을 통 한 atorvastatin의 항천식 효과를 확인하였다.
대상 및 방법
1. 마우스모델 설정 및 atorvastatin 처리
폐-특이적 IL-13 과발현 C57BL/6 마우스와 이들의 한배 마우스 들이 특정 병원체가 없는 조건에서 유지하였다. 두 그룹 모두 6주령 수컷 마우스를 사용하였고, 서울대학교 실험실 동물 자원 연구소 의 IACUC 승인(SNU-140123-5) 하에 수행되었다.
Atorvastatin은 40 mg/kg 조건으로 격일에 한 번씩 2주 동안 6번
위관영양법(gavage)을 통해 투여하였다. 효과적인 용량과 투여 횟 수는 문헌에서 알려진 statin의 약동학에 근거하여 설정하였다.
132. Methacholine 기도과민성 측정
Atorvastatin 마지막 투여 후 다음날 기도과민성을 측정하였다.
기도과민성 측정은 OCP3000 (Allmedicus, Anyang, Korea) 기계 를 사용하였고 메타콜린의 농도를 6.25, 12.5, 25, 50 mg/mL로 차례 대로 증량하면서 측정하였다. 단계별로 3분간 흡입시킨 후, 각각의 농도에서 3분간 30초 간격으로 기도과민성의 지표인 enhanced pause (Penh)를 측정하였다.
3. 천식 염증반응 및 폐 조직 분석
기관지폐포세척액 및 폐 조직은 기도과민성 평가 후 24시간 뒤에 마우스를 희생시키고 수득하였다. 마우스 마취는 케타민을 복강 투여하여 진행하였고 마취 후 기도에 카테터를 삽관, 2-mL phos- phate-buffered saline (PBS)를 투여하여 기관지폐포세척액을 수득 하였다. Cytospin 기계를 이용하여 기관지폐포세척액의 세포를 slide에 부착하였고 부착 후 Diff-Quik 염색(Sysmex Co., Kobe, Ja- pan)으로 염증세포의 종류별 수를 확인하였다.
폐 내 병리학적인 변화와 특성을 평가하고 비교하기 위해 hema- toxylin & eosin (H&E) 염색과 Masson’s trichrome 염색을 시행하 였다. PBS로 마우스의 좌측 폐를 확장한 후 파라핀에 고정하고 매 립하여 조직 절편을 제작하였다. 제작한 조직 슬라이드로 각 염색 을 진행하여 분석하였다.
그룹별 폐 실질의 파괴 정도를 정량화하기 위해 염색된 폐 조직 슬라이드를 관찰 후 기존 문헌에 소개된 내용을 바탕으로 폐포벽 사이 거리(chord lenth)를 측정하여 군 간 비교하였다.
144. 대식세포, 항염증, 폐 섬유화 표지자 분석
폐 조직 시료에서 RNA를 추출한 후 cDNA로 역전사시켰고 획 득한 cDNA로 Quantitative reverse transcription-polymerase chain reaction을 실시하였다. SYBR Green Master Mix (Applied Biosystems, Waltham, MA, USA)을 이용하여 IL-10, 대식세포 활 성화 표지자인 Ym-1, CD206, inducible nitric oxide synthase (iNOS)와 폐 섬유화 표지자인 connective tissue growth factor (CTGF), fibronectin, type III collagen의 mRNA 발현 정도를 확인 하였다. β-actin으로 각 표본 내의 유전자 발현을 정규화하여 분석 하였고 실험에 사용된 Ym-1, CD206, iNOS, IL-10, CTGF, fibro- nectin, type III collagen의 프라이머 서열은 다음과 같다.
IL-10: forward 5′-CACTGCTATGCTGCCTGCTC-3′ reverse 5′-TGGCCTTGTAGACACCTTGG-3′
Ym-1: forward 5′-GGGCATACCTTTATCCTGAG-3′, reverse
5′-CCACTGAAGTCATCCCA-3′
CD206: forward 5′-CAAGGAAGGTTGGCATTT-3′, reverse 5′-CCTTTCAGTCCTTTGCAA-3′
iNOS: forward 5′-GCTCTACACCTCCAATGTGACC-3′, re- verse 5′- CTGCCGAGATTTGAGCCTCATG-3′
CTGF: forward 5′-ATCCCTGCGACCCACACAAG-3′, reverse 5′- CAACTGCTTTGGAAGGACTCGC-3′
Fibronectin: forward 5′-CCACCCCCATAAGGCATAGG-3′, reverse 5′-GTAGGGGTCAAAGCACGAGTCATC-3′
Type III collagen: forward 5′-TGGTCTGCAAGGAAT- GCCTGGA-3′ reverse 5′-TCTTTCCCTGGGACACCATCAG-3′
5. 대식세포의 식세포능 분석
각 마우스의 기관지폐포세척액에서 추출한 세포를 Diff-Quik 염색하여 사멸된 세포를 평가하였고 phagocytic index, apoptotic cells, defective index는 다음의 공식을 이용하여 도출하였다.
15Phagocytic index (PI)=포식한 세포 수/폐포 대식세포 수×100 Apoptotic cells (%)=사멸된 세포 수/(전체 세포 수−폐포 대식세
포 수)×100
Defective index (DI)=apoptotic cells (%)/PI
위의 공식을 적용하여 각 그룹별로 DI값을 구하여 비교하였다.
6. 대식세포 활성화에 대한 영향 평가를 위한 시험관 실험 American Type Culture Collection에서 폐포 대식세포 세포주 인 CRL-2456을 구매하였다. RPMI 배지와 10% fetal bovine se- rum, 1% 항생제를 첨가 후 complete 배지를 제작하여 세포를 배양 하였고 2–3일 간격으로 배지를 교체하였다. 배양조건은 세포배양 기에서 5% CO
2, 37°C 조건으로 유지하였고 배양한 CRL-2456을 마우스 재조합 IL-13 단백질로(20 ng/mL; BioLegend, San Diego, CA, USA) 자극하여 M2 대식세포로 분화시켰다. M2 대식세포에 서 atorvastatin의 효과를 평가하기 위해 atorvastatin 1 μM 처리하
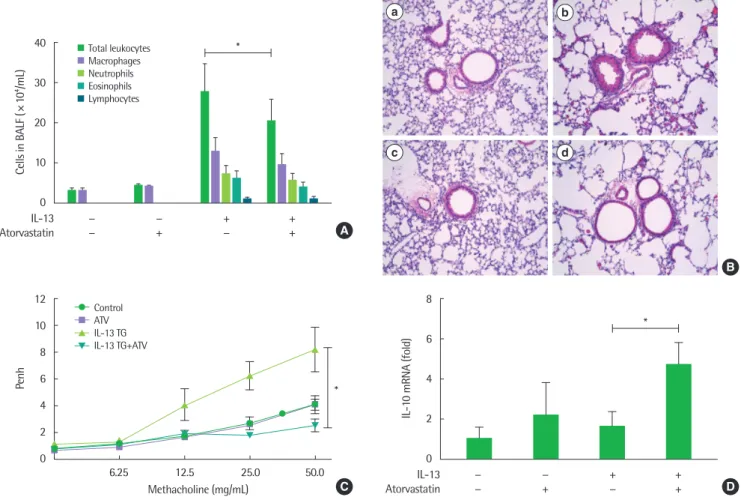
Fig. 1. Effect of atorvastatin on interleukin (IL)-13 induced lung inflammation and airway hyperresponsiveness (*P< 0.05). (A) The number of inflammatory cells includ- ing eosinophils in bronchoalveolar lavage fluid (BALF). (B) Hematoxylin and eosin stain (a-d, × 200) of lung histology in IL-13 transgenic (TG) mouse (a, phosphate-buff- ered saline [PBS]+control; b, PBS+IL-13 TG mouse; c, atorvastatin [ATV]+control; d, atorvastatin+IL-13 TG mouse). (C) Methacholine hyperresponsiveness was mea- sured 24 hours after the last intranasal challenge. (D) Real-time reverse transcription-polymerase chain reaction was performed to determine the changes in mRNA levels of IL-10 from lung tissues. n= 6 for each group, the *P< 0.05. IL-13 TG mouse, lung-specific IL-13 overexpressed transgenic mice. All results are representative of at least 3 independent experiments.
40
30
20
10
0
− − + +
− + − + IL-13
Atorvastatin
*
Cells in BALF (×104/mL)
A Total leukocytes
Macrophages Neutrophils Eosinophils Lymphocytes
8
6
4
2
0
− − + +
− + − + IL-13
Atorvastatin
*
IL-10 mRNA (fold)
D 12
10 8 6 4 2 0
6.25 12.5 25.0 50.0 Methacholine (mg/mL)
*Penh
C Control
ATV IL-13 TG IL-13 TG+ATV
B
a b
c d
여 비교하였다.
7. 통계
평균±표준오차(standard error of the mean)으로 모든 데이터 를 표시하였다. 통계적 유의성은 Student t-test를 시행하여 그룹 간 의 차이를 도출했고 P<0.05일 경우 통계적인 유의성이 있는 것으 로 제시하였다.
결 과
1. Atorvastatin에 의한 기도염증과 기도과민성의 개선
각 군의 폐 염증의 정도를 확인하기 위해 기관지폐포세척액으로 염증세포 분석을 진행한 결과 기관지폐포세척액 내 총 백혈구 수가 의미 있게 감소하였다(P<0.05) (Fig. 1A). 폐 조직을 H&E 염색하 여 조직학적 분석을 시행한 결과 IL-13 과발현 마우스에 atorvas- tatin을 투여하였을 때 증가하였던 폐 내의 염증세포 침윤이 감소 함을 확인하였다(Fig. 1B[d]).
다음으로 메타콜린을 이용하여 기도과민성을 측정한 결과 IL-13 과발현 모델에서 의미 있게 증가하였던 Penh 값이 2주 동안 6회 atorvastatin을 경구 투여하였을 때 대조군 수준으로 정상화을 확인 함으로써 atorvastatin의 기도과민성 개선 효과를 확인하였다(P<
0.05) (Fig. 1C). 이어서 폐 염증반응과 관련된 사이토카인을 확인한 결과 IL-13 과발현 모델에서 증가되지 않았던 IL-10 발현이 atorv- astatin 투여로 유의미하게 증가함을 확인하였다(P<0.05) (Fig. 1D).
2. Atorvastatin에 의한 폐 섬유화 및 파괴의 개선
IL-13 과발현마우스에서는 이전 문헌에서 보고된 바와 같이 폐 섬유화 및 폐실질 파괴가 관찰되었다.
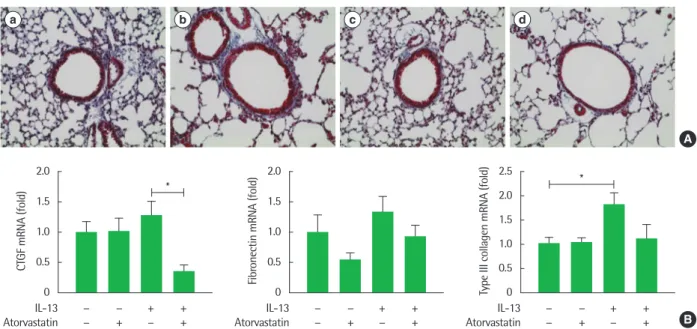
16Atorvastatin의 폐 섬유화 개선 효과를 조직학적으로 분석하기 위하여 Masson trichrome 염 색을 진행한 결과 atorvastatin 투여 시 IL-13 과발현 모델에서 확인 되었던 폐 섬유화의 개선을 확인하였다(Fig. 2A[d]). 폐 실질내 mRNA 수준으로 폐 섬유화 개선효과를 확인하기 위해 폐 섬유화 표지자인 CTGF, fibronectin, type III collagen의 mRNA 발현 정도 를 확인하였다. IL-13 과발현 모델에서 증가한 경향을 보인 각 표지 자의 mRNA 수준이 atorvastatin의 투여로 인하여 감소하는 경향 을 확인하였고, 이 중 CTGF는 통계적으로 유의미하게 감소함을 확인하였다(Fig. 2B).
다음으로 폐 실질 파괴에 대한 atorvastatin의 효과를 확인하였 다. 이를 위해 폐 조직을 H&E 염색한 결과 IL-13 과발현 모델에서 확인된 폐 조직 파괴가 atorvastatin 투여 시 개선됨을 확인하였다 (Fig. 3A). 이어서 폐 파괴 개선 효과를 정량적으로 확인하기 위해 chord length를 기준으로 하여 그룹별 변화를 확인하였다. IL-13 과 발현 모델에서 유의미하게 증가되어 있는 chord length 값이 atorv- astatin 투여 시 유의미하게 감소함을 확인하였다(Fig. 3B). 이를 통 하여 atorvastatin 투여가 폐 섬유화 및 파괴에 개선 효과를 가짐을 확인하였다.
3. Atorvastatin에 의한 M2 대식세포 억제
Atorvastatin의 대식세포 활성화 조절 효과를 확인하기 위하여
Fig. 2. Effect of atorvastatin on interleukin (IL)-13 induced lung fibrosis (*P< 0.05). (A) Masson trichrome stain (a-d, × 200) of lung histology in IL-13 transgenic (TG) mouse (a, phosphate-buffered saline [PBS]+control; b, PBS+IL-13 TG mouse; c, atorvastatin+control; d, atorvastatin+IL-13 TG mouse). (B) Real-time reverse transcrip- tion-polymerase chain reaction to determine changes in mRNA levels of connective tissue growth factor (CTGF), fibronectin, and type III collagen from lung tissue.
n= 6 for each group, *P< 0.05. All results are representative of at least 3 independent experiments.
A
B 2.0
1.5 1.0 0.5 0
− − + + − + − + IL-13
Atorvastatin
*
CTGF mRNA (fold)
2.5 2.0 1.5 1.0 0.5 0
− − + + − + − + IL-13
Atorvastatin
*
Type III collagen mRNA (fold)
2.0 1.5 1.0 0.5 0
− − + + − + − + IL-13
Atorvastatin
Fibronectin mRNA (fold)
a b c d
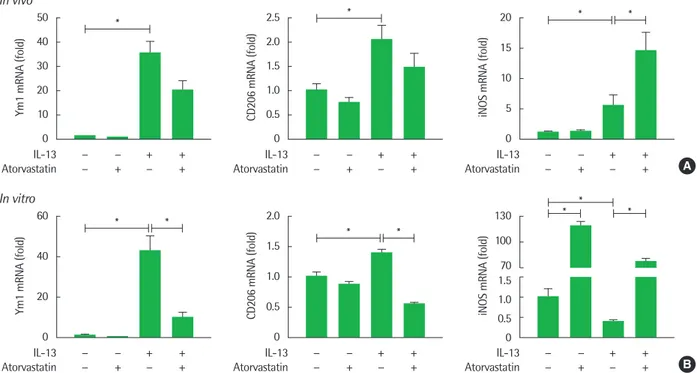
폐포 대식세포 활성화 표지자인 Ym-1, CD206, iNOS의 mRNA 발 현을 확인하였다. IL-13 과발현 모델에서 유의미하게 증가한 M2 대 식세포 표지자 Ym-1, CD206 발현이 atorvastatin 투여 후 감소하 는 경향을 확인하였고, M1 표지자인 iNOS 발현 역시 유의미하게 IL-13 과발현 모델에서 증가했지만, atorvastatin 투여 후 유의미하
게 더 증가함을 확인하였다(P<0.05) (Fig. 4A).
다음으로 atorvastatin의 직접적인 대식세포 조절 효과를 확인하 기 위해 폐포대식세포 세포주인 CRL-2456 세포를 사용하여 in vitro에서 평가하였다. 먼저 M2 대식세포 활성화를 유도하기 위해 CRL-2456 cell에 재조합 IL-13으로 Th2 자극을 주고 atorvastatin
A100 80 60 40 20 0
− − + +
− + − + IL-13
Atorvastatin
Chord length (μm)
B
*
*
Fig. 3. Effect of atorvastatin on interleukin (IL)-13 induced lung destruction (*P< 0.05). (A) Hematoxylin and eosin stain (a-d, × 100) of lung histology in IL-13 transgenic (TG) mouse (a, phosphate-buffered saline [PBS]+control; b, PBS+IL-13 TG mouse; c, atorvastatin+control; d, atorvastatin+IL-13 TG mouse). (B) The levels of Chord length to determine the changes in lung destruction from lung tissues. *P< 0.05. Chord length; mean linear intercept length. All results are representative of at least 3 independent experiments.
Fig. 4. Effect of atorvastatin on macrophage activation markers in vivo and in vitro (*P< 0.05). (A, B) The mRNA levels of CD206, Ym-1, inducible nitric oxide synthase (iNOS) were detected in lung tissue and recombinant interleukin (IL)-13 stimulated mouse alveolar macrophages cell line. The levels of mRNA are represented as the ratio to β-actin. *P<0.05. All results are representative of at least 3 independent experiments.
50 40 30 20 10 0
− − + + − + − + IL-13
Atorvastatin In vivo
Ym1 mRNA (fold)
*
A 20 *
15 10 5 0
− − + + − + − + IL-13
Atorvastatin
*
iNOS mRNA (fold)
2.5 * 2.0 1.5 1.0 0.5 0
− − + + − + − + IL-13
Atorvastatin
CD206 mRNA (fold)
60
40
20
0
− − + + − + − + IL-13
Atorvastatin In vitro
Ym1 mRNA (fold)
*
* 2.0
1.5 1.0 0.5 0
− − + + − + − + IL-13
Atorvastatin
CD206 mRNA (fold)
*
*
B
* 130 *
100 70 1.5 1.0 0.5 0
− − + + − + − + IL-13
Atorvastatin
iNOS mRNA (fold)
*
a b
c d
을 농도별로 처리한 결과 재조합 IL-13 자극으로 폐포 대식세포에 서 Ym-1, CD206의 발현이 증가하였지만, atorvastatin을 처리한 경 우 발현이 유의미하게 감소하였고 iNOS 발현은 atorvastatin 단독 처리 시 크게 증가하였으며 IL-13 자극이 존재할 때에도 atorvas- tatin 처리 시 유의미하게 증가하였다(P<0.05) (Fig. 4A, B). 이를 통 해 atorvastatin이 IL-13 자극으로 유도된 대식세포의 활성화를 조 절하며 M2 대식세포 활성화 억제, M1 대식세포 활성화 증가를 유 도함을 확인하였다.
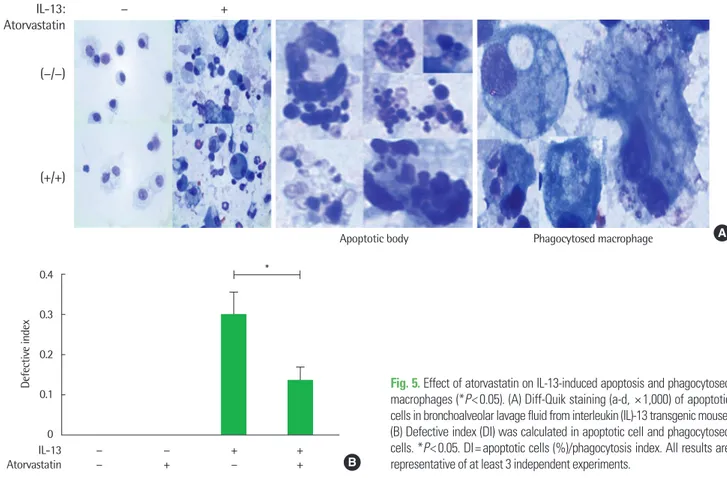
4. Atorvastatin에 의한 대식세포의 efferocytosis 개선 Atorvastatin의 efferocytosis 조절 효과를 확인하기 위해 먼저 기 관지폐포세척액 내 세포를 Diff-Quik 염색하여 apoptotic cell을 관 찰하고 군별로 비교하였다. IL-13 과발현 모델의 기관지폐포세척액 분석 결과 대조군과 비교해 다수의 세포자멸체를 발견하였고 ator- vastatin을 투여 시 세포자멸체 수의 감소를 확인하였다(Fig. 5A).
이어서 대식세포의 effecrocytosis를 평가하는 지표인 DI값을 이용 하여 그룹별 대식세포의 efferocytosis 능력을 평가한 결과 IL-13 과 발현 모델은 높은 DI를 보였지만 atorvastatin 투여는 이를 유의미 하게 감소시켰다(P<0.05) (Fig. 5B). 이를 통해 atorvastatin이 대식 세포의 efferocytosis 능력을 항진시켜 세포자멸체의 제거를 촉진시
킴을 확인하였다.
고 찰
이번 연구에서 IL-13 과발현 마우스 모델을 통해 atorvastatin이 기도염증 및 기도과민성을 개선하며 폐 내 조직학적 개선 효과와 대식세포 활성화를 직접적으로 억제함을 밝혔다. 또한 IL-13 과발 현 마우스 모델에게 atorvastatin을 경구 투여 시 폐 내 M2 표지자 의 mRNA 수준 감소와 폐포 대식세포 주를 이용한 in vitro 분석에 서 M2 표현형 감소를 확인함으로써 atorvastatin의 대식세포 조절 능력을 확인하였다. 이와 함께 atorvastatin은 대식세포의 efferocy- tosis 능력을 증진함으로 과도한 염증반응 상황에서 대식세포의 자 멸사 처리 능력 향상을 통한 항천식 효과 가능성을 확인하였다.
대식세포는 상주 조직과 발생 기원에 따라 여러 분류로 나뉘며 그 중 폐포 대식세포는 기도의 선천면역계를 담당하고 기도 내 존 재하는 면역세포 중 대다수를 차지하기에 천식 병인기전에서 상당 한 역할을 하리라 기대를 모았고 실제로 천식과 연관성이 확인된 바 있다.
17폐포 대식세포를 포함하여 대식세포의 기능적, 내재적 분류가 제시됨에 따라 천식의 병태생리를 분석하는 데에 대식세포 의 세부 집단이 중요할 것으로 제시되고 있다.
18실제로 천식 환자의
Apoptotic bodyIL-13:
Atorvastatin (−/−)
(+/+)
− +
Phagocytosed macrophage A
Fig. 5. Effect of atorvastatin on IL-13-induced apoptosis and phagocytosed macrophages (*P< 0.05). (A) Diff-Quik staining (a-d, × 1,000) of apoptotic cells in bronchoalveolar lavage fluid from interleukin (IL)-13 transgenic mouse.
(B) Defective index (DI) was calculated in apoptotic cell and phagocytosed cells. *P< 0.05. DI= apoptotic cells (%)/phagocytosis index. All results are representative of at least 3 independent experiments.
0.4
0.3
0.2
0.1
0
− − + +
− + − + IL-13
Atorvastatin
Defective index
B
*
경우 환자의 중증도에 따라 M2a 대식세포의 표지자로 알려진 CD206
+/MHCII
+대식세포가 증가함을 확인하였고 본 연구진의 선행 연구에서는 이러한 M2 대식세포의 변화가 천식 치료에 적용 될 수 있음을 보고하였다.
19-22이번 연구에서도 IL-13 과발현 마우 스 모델에서 항진되었던 M2 대식세포 표지자 발현이 atorvastatin 투여 및 처리에 의해 감소됨을 확인함으로써 atorvastatin의 M2 대 식세포 조절이 잠재적인 항천식 치료 기전이 될 수 있음을 확인하 였다.
Th2 사이토카인은 알레르기 천식에서 관찰되는 대표적인 특징 이며 이러한 Th2 사이토카인을 억제함으로 천식 치료에 적용하는 연구가 보고되었다.
23실제로 흡입 글루코코르티코이드(inhaled corticosteroid) 치료 시 일부 환자에게서 IL-13 사이토카인의 높은 발현 수준이 유지됨에 따라 항 IL-13 항체를 천식 환자에게 투여하 는 시도가 있었고 폐 기능 개선 및 천식악화율이 감소하는 등의 효 과를 확인하였다.
24하지만 근골격계와 요로계 등에서 부작용이 확 인되었으며 IL-4 항체와의 병용 투여 가능성 등 아직 천식치료제로 서의 적용에는 한계가 존재한다.
25기존에 보고된 statin의 항천식 작용에 관한 연구는 주로 병태생 리학적 측면에서 차이를 확인하였다. Statin은 OVA로 유도한 천식 마우스 모델에서 화학주성인자 생성과 폐 조직 intercellular adhe- sion molecule 1 발현을 저해하여 호산구 이동을 감소시켰고
26IL-13을 포함한 Th2 사이토카인의 감소, interferon-γ 등 Th1 사이 토카인 증가가 확인되었다.
27최근 statin을 천식 환자에게 투여하 여 항천식 치료 효과를 확인하려는 임상 연구가 보고되고 있는데, 중증 천식을 갖는 흡연자를 포함한 특정 환자군에서 statin 투여 시 폐 기능 개선을 나타내었다.
28,29또한, 흡입 스테로이드를 사용 중인 천식 환자가 statin 복용 시 Th2 사이토카인 감소와 함께 폐포 대식 세포 내 비전형 nuclear factor-kappa B 경로가 활성화됨에 따라 결 과적으로 indoleamine 2,3-dioxygenase 전사 및 효소 활성 증가가 확인되었다.
30이에 따라 IL-13으로 유도되는 천식의 병인 기전에 statin이 잠재적인 치료제로서 적용될 가능성이 존재한다.
31,32본 연구진은 statin이 동맥경화에서 대식세포에 작용한다는 것 에 착안하여 statin이 기도 폐포 대식세포에 영향을 미치는지를 확 인하고자 하였으며, IL-13 과발현 마우스 모델에 atorvastatin을 경 구 투여 시 폐 내 염증, 기도과민성 반응, 폐 섬유화 및 파괴가 개선 됨을 관찰하였다.
33기관지폐포세척액 내 대식세포, 호산구 등 염증 세포의 현저한 감소는 없었으나, 총 염증세포수의 감소와 폐포 대 식세포의 활성화에 유의한 차이를 가져옴을 확인하였고, 특히 Th2 사이토카인을 억제함으로 천식 조절 효과를 갖는 IL-10 발현의 증 가를 확인하여 atorvastatin의 효과 기전으로 제시하였다. 이와 함 께 폐포 대식세포의 분화에 대한 유의미한 차이를 확인하였는데, atorvatatin 투여 시 M2 대식세포 표지자인 Ym-1, CD206의 감소, M1 대식세포 표지자인 iNOS의 증가를 통해 atorvastatin이 M2 대
식세포로의 활성화를 억제하고 M1 대식세포로 활성화를 촉진함 을 확인하였다.
34이번 연구를 통하여 Th2 사이토카인, 특히 IL-13의 과발현으로 유도된 천식의 표현형에서 atorvastatin의 항천식 효과를 확인하였 고 Th2 사이토카인으로 자극된 M2 대식세포의 활성화 억제를 밝 혔다. 하지만 호산구 염증 억제가 뚜렷하지 않아 statin의 항천식 기 전에 대한 추가연구, 특히 M2 대식세포의 세부아형 분석을 통해 atorvastatin의 대식세포 조절 효과와 이로 유도되는 항천식 효과 기전에 대한 연구가 필요함을 시사하였다. 그 밖에 대식세포와 긴 밀한 관련성을 보이는 innate lymphoid cell의 변화 역시 관찰이 필 요하여 이에 대한 추가 연구가 필요하다.
종합하여 본 연구는 atorvastatin의 항천식 효과 기전을 규명하 기 위해서 IL-13 과발현 마우스 모델을 이용하였고 IL-13 사이토카 인으로 유도된 천식의 염증 및 기도개형에 대한 atorvastatin의 역 할을 확인하였다. 또한 대식세포주를 이용함으로써 atorvastatin이 M2 대식세포 활성화 경로에 미치는 영향을 확인하였다. 본 연구진 은 atorvastatin 투여 시 IL-13으로 유도되는 천식 표현형의 억제와 M2 대식세포 활성화가 억제됨을 확인함으로써 알레르기성천식 치료제의 가능성을 제시하였다.
알림(ACKNOWLEDGMENTS)
이 연구를 위해 마우스를 제공해주신 Jack A. Elias 교수님께 감 사의 말씀을 드립니다.
REFERENCES
1. Wills-Karp M. Immunologic basis of antigen-induced airway hyperrespon- siveness. Annu Rev Immunol 1999;17:255-81.
2. Cohn L, Elias JA, Chupp GL. Asthma: mechanisms of disease persistence and progression. Annu Rev Immunol 2004;22:789-815.
3. Wills-Karp M. Interleukin-13 in asthma pathogenesis. Curr Allergy Asth- ma Rep 2004;4:123-31.
4. Zhu Z, Homer RJ, Wang Z, Chen Q, Geba GP, Wang J, et al. Pulmonary expression of interleukin-13 causes inflammation, mucus hypersecretion, subepithelial fibrosis, physiologic abnormalities, and eotaxin production.
J Clin Invest 1999;103:779-88.
5. Byrne AJ, Mathie SA, Gregory LG, Lloyd CM. Pulmonary macrophages:
key players in the innate defence of the airways. Thorax 2015;70:1189-96.
6. Murray PJ. Macrophage polarization. Annu Rev Physiol 2017;79:541-66.
7. Arango Duque G, Descoteaux A. Macrophage cytokines: involvement in immunity and infectious diseases. Front Immunol 2014;5:491.
8. van der Veen TA, de Groot LES, Melgert BN. The different faces of the mac- rophage in asthma. Curr Opin Pulm Med 2020;26:62-8.
9. Abdelaziz MH, Abdelwahab SF, Wan J, Cai W, Huixuan W, Jianjun C, et al. Alternatively activated macrophages; a double-edged sword in allergic asthma. J Transl Med 2020;18:58.
10. Fricker M, Gibson PG. Macrophage dysfunction in the pathogenesis and treatment of asthma. Eur Respir J 2017;50:1700196.
11. Haque T, Khan BV. Atorvastatin: a review of its pharmacological proper- ties and use in familial hypercholesterolemia. Clin Lipidol 2010;5:615-25.
12. Inagaki-Katashiba N, Ito T, Inaba M, Azuma Y, Tanaka A, Phan V, et al.
Statins can suppress DC-mediated Th2 responses through the repression of OX40-ligand and CCL17 expression. Eur J Immunol 2019;49:2051-62.
13. Mausner-Fainberg K, Luboshits G, Mor A, Maysel-Auslender S, Rubinstein A, Keren G, et al. The effect of HMG-CoA reductase inhibitors on natu- rally occurring CD4+CD25+ T cells. Atherosclerosis 2008;197:829-39.
14. Kang HR, Lee CG, Homer RJ, Elias JA. Semaphorin 7A plays a critical role in TGF-beta1-induced pulmonary fibrosis. J Exp Med 2007;204:
1083-93.
15. Morimoto K, Janssen WJ, Terada M. Defective efferocytosis by alveolar macrophages in IPF patients. Respir Med 2012;106:1800-3.
16. Sutherland ER, Martin RJ. Airway inflammation in chronic obstructive pulmonary disease: comparisons with asthma. J Allergy Clin Immunol 2003;112:819-27; quiz 828.
17. Wynn TA, Chawla A, Pollard JW. Macrophage biology in development, homeostasis and disease. Nature 2013;496:445-55.
18. Saradna A, Do DC, Kumar S, Fu QL, Gao P. Macrophage polarization and allergic asthma. Transl Res 2018;191:1-14.
19. Girodet PO, Nguyen D, Mancini JD, Hundal M, Zhou X, Israel E, et al.
Alternative macrophage activation is increased in asthma. Am J Respir Cell Mol Biol 2016;55:467-75.
20. Lee HS, Kwon HS, Park DE, Woo YD, Kim HY, Kim HR, et al. Thalido- mide inhibits alternative activation of macrophages in vivo and in vitro: a potential mechanism of anti-asthmatic effect of thalidomide. PLoS One 2015;10:e0123094.
21. Shim JS, Lee HS, Park DE, Lee JW, Bae B, Chang Y, et al. Aggravation of asthmatic inflammation by chlorine exposure via innate lymphoid cells and CD11c(intermediate) macrophages. Allergy 2020;75:381-91.
22. Kim J, Chang Y, Bae B, Sohn KH, Cho SH, Chung DH, et al. Innate im- mune crosstalk in asthmatic airways: innate lymphoid cells coordinate polarization of lung macrophages. J Allergy Clin Immunol 2019;143:
1769-82.e11.
23. Kasaian MT, Marquette K, Fish S, DeClercq C, Agostinelli R, Cook TA, et al. An IL-4/IL-13 dual antagonist reduces lung inflammation, airway hyperresponsiveness, and IgE production in mice. Am J Respir Cell Mol
Biol 2013;49:37-46.
24. Luo J, Liu D, Liu CT. The efficacy and safety of antiinterleukin 13, a mono- clonal antibody, in adult patients with asthma: a systematic review and meta-analysis. Medicine (Baltimore) 2016;95:e2556.
25. Li H, Wang K, Huang H, Cheng W, Liu X. A meta-analysis of anti-inter- leukin-13 monoclonal antibodies for uncontrolled asthma. PLoS One 2019;14:e0211790.
26. Liou CJ, Cheng PY, Huang WC, Chan CC, Chen MC, Kuo ML, et al. Oral lovastatin attenuates airway inflammation and mucus secretion in oval- bumin-induced murine model of asthma. Allergy Asthma Immunol Res 2014;6:548-57.
27. Gu W, Cui R, Ding T, Li X, Peng J, Xu W, et al. Simvastatin alleviates air- way inflammation and remodelling through up-regulation of autophagy in mouse models of asthma. Respirology 2017;22:533-41.
28. Braganza G, Chaudhuri R, McSharry C, Weir CJ, Donnelly I, Jolly L, et al. Effects of short-term treatment with atorvastatin in smokers with asthma--a randomized controlled trial. BMC Pulm Med 2011;11:16.
29. Yuan C, Zhou L, Cheng J, Zhang J, Teng Y, Huang M, et al. Statins as po- tential therapeutic drug for asthma? Respir Res 2012;13:108.
30. Maneechotesuwan K, Ekjiratrakul W, Kasetsinsombat K, Wongkajornsilp A, Barnes PJ. Statins enhance the anti-inflammatory effects of inhaled corticosteroids in asthmatic patients through increased induction of in- doleamine 2, 3-dioxygenase. J Allergy Clin Immunol 2010;126:754-62.e1.
31. Liu JN, Suh DH, Yang EM, Lee SI, Park HS, Shin YS. Attenuation of air- way inflammation by simvastatin and the implications for asthma treat- ment: is the jury still out? Exp Mol Med 2014;46:e113.
32. McKay A, Leung BP, McInnes IB, Thomson NC, Liew FY. A novel anti- inflammatory role of simvastatin in a murine model of allergic asthma. J Immunol 2004;172:2903-8.
33. Tulek B, Kiyan E, Kiyici A, Toy H, Bariskaner H, Suerdem M. Effects of simvastatin on bleomycin-induced pulmonary fibrosis in female rats. Biol Res 2012;45:345-50.
34. Fu H, Alabdullah M, Grossmann J, Spieler F, Abdosh R, Lutz V, et al. The differential statin effect on cytokine production of monocytes or macro- phages is mediated by differential geranylgeranylation-dependent Rac1 activation. Cell Death Dis 2019;10:880.