대한소화기학회지 2009;53:68-75 □ REVIEW □
연락처: 김현수, 220-701, 강원도 원주시 일산동 162번지 연세대학교 원주의과대학 내과학교실
Tel: (033) 741-1229, Fax: (033) 745-1228 E-mail: hyskim@yonsei.ac.kr
Correspondence to: Hyun-Soo Kim, M.D.
Department of Internal Medicine, Yonsei University Wonju College of Medicine, 162, Ilsan-dong, Wonju 220-701, Korea Tel: +82-33-741-1229, Fax: +82-33-745-1228
E-mail: hyskim@yonsei.ac.kr
대장암 치료를 위한 생물학표지자
연세대학교 원주의과대학 내과학교실
석기태ㆍ김현수
Biomarkers for Colorectal Cancer Treatment
Ki-Tae Suk, M.D. and Hyun-Soo Kim, M.D.Department of Internal Medicine, Yonsei University Wonju College of Medicine, Wonju, Korea
Individualized tailored therapy is a currently pursuing direction for improving the outcome of patients with color- ectal cancer. Targeted therapy is the potential strategy to reach this goal by evaluating status of the presumed targets and their related effector molecules and by maximizing the efficacy of chemotherapeutic agents with less toxicity in individual patient. Numerous hurdles should be overcome, however, because therapeutic outcome can be affected by multiple components; tumor characteristics such as somatic mutations at the DNA, RNA, and pro- tein levels; patient characteristics like germline genetic polymorphisms in enzymes linked to drug metabolism; and environmental factors that include diet and physical activity. Currently, large numbers of potential biomarkers have been proposed but have not yet accomplished supporting evidences for their routine usage in clinics. Therefore, clinical trials driven by molecular targets and relevant biomarkers for the understanding of the conflicting data are needed to make markers available in clinical practice. (Korean J Gastroenterol 2009;53:68-75)
Key Words: Colorectal cancer; Biomarkers; Targeted therapy; Chemotherapeutic agents
서 론
표적 암 치료는 암의 성장과 발생에 관여하는 특정한 분 자물질에만 작용하여 이들의 활동을 억제하고 차단하여 암 의 성장과 전이를 막는 치료방법이다. 표적 치료 용어는 원 하는 치료 효과를 나타낼 수 있는 구체적인 표적 분자에만 영향을 미치는 특수 목적의 소분자 물질, 또는 단클론 항체 를 합성하고 생산하는 약물개발 과정에서 유래하였다. 기존 의 세포독성(cytotoxic) 항암제는 세포 내에 일반적으로 존재 하는 DNA나 미세소관(microtubule)을 표적으로 하므로 암세 포와 더불어 정상 세포에도 영향을 주어 부작용을 유발한 다. 이에 반해 표적 치료는 치료 관련 표적 분자 및 관련 경
로를 찾아 이들에 대한 특이도를 높임으로써 특정 암세포만 을 공격하게 되므로 항암약물의 부작용을 최소화할 수 있 다. 따라서 표적 치료는 환자 개인별로 예상되는 표적 분자 물질과 하위 주요 경로의 상태를 평가함으로써 맞춤 치료의 개념을 구현할 수 있는 이상적인 치료법이 될 수 있다.1 하 지만 대장암에서 표적 치료를 위한 종양별 표지자를 탐색하 고 동정하여 실용화하는 것은 현재 시작단계에 불과하다.
또한 표적 치료물질로 개발된 대부분의 약물은 의도하였던 것보다는 표적에 대한 특이도가 낮은 반면, 임상효과를 기 반으로 현재 널리 쓰이는 세포독성 항암제도 특정 표적 분 자물질을 가진다는 사실이 알려지면서 진정한 표적 치료제 개발에 대한 의문이 제기되었다.
석기태 외 1인. 대장암 치료를 위한 생물학표지자 69
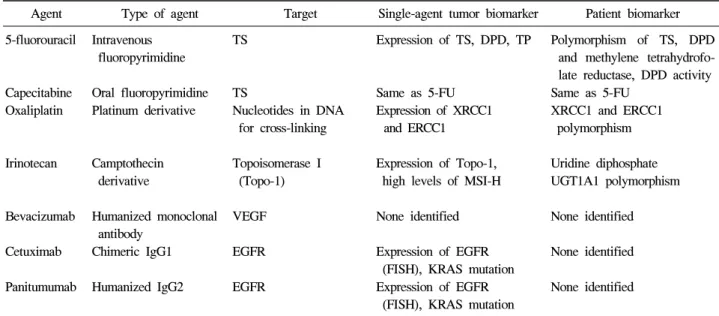
Table 1. Therapeutic Agents for Colorectal Cancer and the Associated Single-Agent Tumor and Patient Biomarkers Agent Type of agent Target Single-agent tumor biomarker Patient biomarker 5-fluorouracil Intravenous
fluoropyrimidine
TS Expression of TS, DPD, TP Polymorphism of TS, DPD and methylene tetrahydrofo- late reductase, DPD activity Capecitabine
Oxaliplatin
Oral fluoropyrimidine Platinum derivative
TS
Nucleotides in DNA for cross-linking
Same as 5-FU Expression of XRCC1
and ERCC1
Same as 5-FU XRCC1 and ERCC1 polymorphism
Irinotecan Camptothecin derivative
Topoisomerase I (Topo-1)
Expression of Topo-1, high levels of MSI-H
Uridine diphosphate UGT1A1 polymorphism
Bevacizumab Humanized monoclonal antibody
VEGF None identified None identified
Cetuximab Chimeric IgG1 EGFR Expression of EGFR (FISH), KRAS mutation
None identified
Panitumumab Humanized IgG2 EGFR Expression of EGFR (FISH), KRAS mutation
None identified
TS, thymidine synthase; DPD, dihydropyrimidine dehydrogenase; TP, thymidine phosphorylase; XRCC1, X-ray cross complementing factor 1; ERCC1, excision repair cross-complementation group 1; UGT, glucoronosyltransferase; VEGF, vascular endothelial growth factor; EGFR, epidermal growth factor receptor; MSI-H, microsatellite instability-high; FISH, fluorescent in situ hybridization.
표적 치료를 위한 표지자는 크게 두 가지 측면, 즉 예후 측면과 치료 반응의 예측 측면에서 임상에 이용될 수 있다.
첫째, 예후 표지자는 대장암의 자연 경과 및 침습/전이의 개 별 특성에 근거하여 추가 치료를 시행할지 결정하는 데 도 움을 준다. 특히 예후 표지자는 재발 위험이 낮은 완치적 절 제 환자에서 보조 항암약물치료의 대상을 누구로 해야 하는 지에 대한 의문을 해결해 줄 수 있다. 실제로 고도의 미세위 성체 불안정성(microsatellite instability-high, MSI-H)은 대장암 에서 좋은 예후를 나타내는 분자 표지자의 가장 유용한 예 이다.2,3
불현성으로 잔존하는 국소 또는 원격 병소를 가진 환자를 찾아내어 병변을 소멸시키는 것은 불필요한 수술 후 보조항 암요법의 독성을 피해 환자의 삶을 향상시키는 데 크게 기 여하였다.4-7 실제로 전이를 잘하는 대장암 표현형을 예측하 거나 잠재적으로 전이가능한 부위와 혈액, 체액, 그리고 골 수 등의 미세전이가 흔한 부위에서 조직병리학적으로 불명 확한 암세포의 성분을 분자적으로 밝히려는 시도들을 통하 여 암의 분자 병기결정이 시도되었다. 많은 환자를 대상으 로 한 임상시험 결과에 근거한 경험적 항암약물요법보다, 치료 반응 예측 표지자를 평가하여 가장 효과적일 것으로 기대되는 약물을 선택함으로써 맞춤 치료를 할 수 있다는 측면에서 예측 표지자는 큰 관심을 끌게 되었다. 또한 예측 표지자 평가는 효과적인 치료제의 선택과 더불어 약물 독성 관련 문제를 예측함으로써 환자의 맞춤 치료를 가능하게 할 수 있다는 점에서 환자 치료에 큰 변화를 불러올 수 있다.
이들 예측 표지자는 완치 수술 후 보조요법과 전이 대장암 환자의 항암요법 양자 모두에서 임상 적용되어 어떻게 환자 를 효과적으로 치료할 것인가에 대한 답을 주게 된다.8-12 대장암에 있어 예후 및 예측 표지자의 개발은 역사가 오래 됨에도 불구하고 유용성이 입증되어 실제 쓰이는 것은 소수 에 불과하다.13 이번 원고에서는 예후 표지자보다는 실질적 으로 항암제별로 치료 반응을 예측할 수 있는 예측 표지자에 중점을 두어 기술하고자 한다. 또한 대장암의 표현형이나 분 자수준의 특성에 따른 대장암 아군별로 치료 반응률을 최대 화하기 위해서 다양한 병리, 분자 정보를 기초로 최선의 항 암제 선택을 통한 표적 치료법을 알아보고자 한다.
대장암 치료에 이용되는 항암약물
대장암 치료제로 승인된 항암약물의 표적 물질과 각각의 항암제별로 종양과 환자에서 제시된 표지자를 Table 1에 정 리하였다.
Fluoropyrimidine의 표지자
정주용 5-FU는 대장암의 항암치료제로 수 십 년간 사용 되어 현재까지 많은 연구가 진행되었다. Fluoropyrimidine의 표지자로는 thymidylate synthase (TS), dihydropyridine dehy- drogenase (DPD), thymidine phosphorylase (TP), MSI-H, CpG island의 DNA methylation 등이 있다. TS는 5-FU의 치료 표 적이며 DPD와 TP가 TS의 대사 과정에 관여한다. 따라서
70 The Korean Journal of Gastroenterology: Vol. 53, No. 2, 2009
DPD와 TP 효소에 대한 많은 연구가 DNA, RNA, 단백질 영 역에서 진행되어, 면역화학염색을 통한 단백질 및 mRNA의 과발현이 나쁜 예후와 관련됨이 보고되었다.1,8-10,14-17
최근에 는 TNFRSF1B, SLC35F5 그리고 orotate phosphoribosyl trans- ferase과 같은 효소의 mRNA 발현을 포함한 5-FU의 치료효 과에 중요한 효소들이 추가로 동정되었다.18-20
DNA 수준에서 TS유전자의 5’-untranslated region에 존재 하는 28염기쌍 길이의 반복서열이 종양 내 TS의 발현이나 효소 활성화와 관련되고, 2회 반복서열에 비해 3회 반복서 열을 가진 환자에서 mRNA와 단백 발현이 증가하였다.1,21 TS 유전자 복사수 역시 주목을 받게 되었다.22 TS 발현은 정 량적인 RT-PCR 증폭이나 다양한 항체를 이용한 면역화학 염색에 의하여 평가되었는데 전반적으로 TS 발현의 증가는 5-FU에 기초한 병용항암 치료 후 낮은 치료 반응률 및 생존 율과 연관되는 경향을 보였다.8,23 이러한 연구들에도 불구하 고 5-FU의 치료 반응군과 좋은 예후에 대한 예측 표지자는 동정되지 않아 현재 TS 발현은 5-FU 치료의 임상 표지자로 추천되지는 않는다.13 MSI 상태에 따른 5-FU 단독 보조항암 요법의 치료반응에 대하여 일부는 MSI-high 대장암이 전반 적인 생존과 관련이 없지만,2,24 다른 연구에서는 생존율이 낮거나,2,25 오히려 높인다는 다양한 연구결과들이 있어 논란 이 많다.2,26 최근의 전이 대장암 환자를 대상으로 3상 임상 연구에서 5-FU 기초 병합치료효과는 CIMP (CpG island methylator phenotype) 대장암의 표지자가 양성인 DNA methylation 정도가 높은 환자에서 생존율이 낮았다.27 DPD는 5-FU를 분해하며 이 유전자 산물의 활성도가 부족 하면 독성을 야기한다.28,29 하지만 이러한 DPD 활성도 부족 은 매우 드물어 상용으로는 시행되지 않는다. Capecitabine은 경구용 fluoropyrimidine으로 최근에 개발되어 약물유전학이 나 약물유전체학 특성에 대한 연구가 부족하다.30 하지만 정 맥용 5-FU와 유사한 표지자를 가진 것으로 보고되었다.31
Oxaliplatin의 표지자
DNA로부터 oxaliplatin의 부가 생성물을 제거하는 excision repair cross-complementing 1 (ERCC1) 유전자의 발현이 높을 수록 oxaliplatin 치료 후 예후가 나쁘다.23,32,33 FAS 대 FAS ligand/CD95의 비율은 oxaliplatin과 5-FU의 병합치료에서 전 이 대장암 환자의 약물 민감도를 나타내는 표지자로서 비율 이 높을수록 반응률이 높으며 비율이 낮으면 약물 저항성의 지표가 된다.34 이러한 효과는 oxaliplatin에 특이한 것이라기 보다는 platinum계 약물에 대한 전반적인 효과로 생각한다.
이 외에 XPD-751, ERCC1-188, GSTP1-105 그리고 TS-3’- untranslated region의 유전자 다형성에 있어 우호적인 배아세 포 유전형을 가지는 경우 생존율 향상과 연관성이 있다.35-38
흥미롭게도 ERCC1-188과 관련해서는 C/C 유전형이 높은 생존율과 연관된다는 보고와,36 T/T 유전형이 치료 반응률이 높다는 상반된 결과가 있다.37 XRCC1 다형성은 낮은 치료 반응률과 연관된다.38-40
Irinotecan의 표지자
Irinotecan은 topoisomerase 1 억제제로 carboxylesterases에 의하여 활성형인 SN-38로 전환된다. 최근 연구에 따르면 MSI-H의 대장암은 irinotecan 치료 후에 좋은 예후와 관련되 었다.41 Gilbert’s 증후군 환자의 돌연변이 유전자로 알려진 uridine diphosphate glucoronosyltransferase (UGT1A1)의 배아 세포 유전자 다형성은 irinotecan 분해에 관련되어 약물 독성 과 연관되어 미국 FDA에서는 irinotecan 투여 전에 통상적으 로 유전자 분석을 권장한다.42
Bevacizumab의 표지자
VEGF (vascular endothelial growth factor)의 단클론항체인 bevacizumab은 전이 대장암의 일차치료로서 IFL (irinotecan, 5-FU, leucovorin)과 병합하여 사용한 경우 IFL 병합요법에 비해 생존율을 향상시켰다.43 이를 근거로 bevacizumab은 항 VEGF 표적 항암치료제로 처음으로 미국 FDA의 허가를 받 게 되었다. 그러나 현재까지의 많은 연구에도 불구하고 VEGF 표적 치료에 의한 항암기전, 저항성 발생기전, 치료 반응의 예측인자는 명확하지 않아 추가 연구가 필요하 다.44-47
항EGFR 항체의 표지자
종양 내에서 EGFR 발현이 이 유전자 산물을 표적으로 하 는 약물을 이용한 표적 치료에 효과적인 표지자일 것이라는 가정에도 불구하고, EGFR의 발견 이후 전이 암의 표적 항 암치료에서 cetuximab의 단독치료나 cetuximab과 irinotecan 의 병용치료48나 panitumumab 단독치료49,50에서 면역화학염 색을 통한 EGFR의 발현과 치료 반응에 대한 관련성은 없었 다. 반면에 FISH를 이용한 분석에서 EGFR과 HER2의 과발 현은 치료 반응의 예측인자가 될 수 있으나51-53 기법의 표준 화 문제로 아직 논란이 있다.54,55 Cetuximab 단독치료에서 EGFR, cyclooxygenase-2, interleukin-8 mRNA의 발현이 낮은 경우, 생존율이 증가하였으며 VEGF mRNA의 과발현은 진 행 불응 대장암에서 약물 저항성과 연관되었다.56 Cyclin D 의 배아세포 유전자 다형성과 VEGF 유전자 발현 정도는 cetuximab의 효과와 관련되는 것으로 보고되었다.23 또한 최 근 연구결과 KRAS 유전자 돌연변이를 가진 환자는 cetu-
Suk KT, et al. Biomarkers for Colorectal Cancer Treatment 71
Table 2. Clinical Application of Epigenetic Biomarkers in Colorectal Cancer
Hypermethylated
Potential clinical application gene
p16INK4a Unfavorable prognosis in colon cancer MGMT Predictor of chemotherapy response in
colorectal carcinoma
APC Detection in colorectal carcinoma
hMLH1 Risk assessment and response to treatment in colorectal cancer
CDH1 Related with unfavourable prognosis CDH13 Related with unfavourable prognosis THBS-1 Related with unfavourable prognosis MGMT, O6-methylguanine-DNA methyltransferase; APC, ade- nomatosis polyposis coli; hMLH, MutL homolog 1; CDH1, E-cadherin 1; THBS1, thrombospondn 1.
ximab과 panitumumab 치료 후에 생존율 향상이 없었다.57,58 이러한 결과는 KRAS가 EGFR의 신호전달 경로의 하위 단 계여서, 상위 EGFR 신호전달에 민감한 종양세포가 KRAS 의 활성화 돌연변이로 인해 변형되어 나타나는 생물학적인 현상임을 시사한다.
병용화학요법의 표지자
병용항암요법은 항암치료의 표준이지만 독성 약물과 표 적 치료제의 다양한 작용기전에 따르는 적합한 표지자를 선 택하는 데 많은 어려움을 내포하고 있다. 5-FU와 irinotecan 또는 5-FU와 oxaliplatin으로 치료받은 전이 대장암 환자에서 TS, XRCC1, UGT1A1에 대한 배아세포 유전자 다형성에 관 한 평가가 시행되었으며 후자 요법에서 TS 5’ 단일염기 다 형성과 우호적인 XRCC1 유전형인 경우에 예후가 좋았다.59 그리고 capecitabine과 irinotecan 병용치료 환자의 면역화학 염색에서 종양 내 TP의 발현을 보인 경우 생존율이 높았던 반면, TS와 DPD는 예측기능이 없었다.60 5-FU와 oxaliplatin 병용치료를 받은 전이 대장암 환자에서 ERCC1과 TS mRNA의 과발현은 생존율이 낮았다.61 5-FU와 방사선 동시 병합치료를 받은 직장암 환자에서 치료 후 종양 내 TS과 발 현은 나쁜 예후의 예측인자이었다.62
후성학 표지자의 임상 적용
유전자 프로모터 부위 CpG islands (CGI)의 과메칠화는 인 간 암에서 가장 널리 그리고 조기에 나타나는 분자 표지자 가 된다. 임상에서 이들 과메칠화된 부위는 표지자로서 여 러 장점을 가진다. 첫째, DNA 메칠화 상태양상의 변화는 종양 세포의 고유한 특징으로 종양 진단과 분류에 유용하 다. 둘째로 Methylation specific PCR (MS-PCR), RT-PCR에 근거한 MethyLight, pyrosequencing 등의 메칠화 정도를 평가 하는 방법들은 민감하고 다량의 샘플을 빠른 시간 내로 처 리할 수 있다. 아울러 DNA는 안정적이어 다양한 종류의 샘 플에서 연구가 가능하다.63
DNA를 이용한 메칠화 표지자는 대장암 진단과 종양의 진행, 그리고 치료에 대한 반응을 예측할 수 있는 예측 표지 자로서 많은 연구가 이루어져 왔다(Table 2). 대장암 진단에 있어 재료 DNA는 혈액, 대변, 종양조직 자체 등 다양하며 이들을 이용한 조기 진단이 가능하다. 특히 암의 가족력이 있는 고위험군의 경우 산발 암과 유사한 DNA 메칠화 변화 양상을 보였다. APC의 경우 돌연변이와 더불어 메칠화가 대장 종양에서 관찰되어 진단에 유용할 수 있음이 보고되었 다. 예후와 관련해서는 p16INK4A이 메칠화된 경우 대장암의 예후가 나쁘다.64 아울러 전이 대장암에서 CIMP (CpG
islands methylator phenotype) 대장암 표지자인 MINTs (methy- lated in tumor)와 p16, p14의 메칠화 양성인 경우는 예후가 나쁘다. MGMT (O6-methylguanine-DNA methyltransferase)의 메칠화는 alkylating 항암약물에 손상된 DNA의 회복을 지연 시켜 항암약물에 대한 치료반응을 높이는 것으로 알려졌다.
이 외에도 hMLH1 유전자 프로모터 부위의 메칠화를 보이 는 산발 대장암에서 탈메칠화 약물은 cisplatin과 같은 항암 약물에 대한 민감도를 향상시켜 치료 반응을 높인다.65
표적 치료에 적용되는 표지자의 현실
현재 대장암에서 면역화학염색을 통한 EGFR 발현에 대 한 평가가 표적에 대한 단클론 항체를 이용한 치료 여부를 결정하는 데 일반적으로 이용되지만 치료 예측의 유용성에 대한 근거는 없다. FISH 기법을 이용한 EGFR의 과발현 여 부는 치료 반응에 대한 예측기능이 있으며 다른 표지자들은 약물의 독성 예측에 이용되기도 한다. 예로써 미국 FDA에 서는 irinotecan을 포함한 병용약물 치료에 있어 환자의 배아 세포 UGT1A1 유전자 다형성 여부에 대한 평가를 요구하는 데 이는 UGT1A1*28 다형성이 있는 환자에서 약물 독성의 위험이 높아 용량을 조절하기 위함이다. 5-FU를 분해하는 DPD의 기능이 낮거나 없는 경우 5-FU의 독성과 연관되는 데 이러한 경우는 매우 드물어 이 검사가 치료 전에 시행되 는 경우는 거의 없다. 따라서 많은 잠재 표지자들이 현재 동 정되었지만 실제로 임상 유용성이 확립된 수준에는 도달하 지 못하였다. 향후 임상연구를 통하여 표지자 이용의 근거 가 제시되어야 하며 병용화학요법 시대에 걸맞는 표지자들 의 조합이 필요하리라 생각한다.
이러한 목표를 성취하려면 종양 자체와 더불어 환자 모두
72 대한소화기학회지: 제53권 제2호, 2009
에서 표지자를 개발하려는 시도가 필요하다. 종양 내 DNA, RNA, 그리고 단백질 수준에서 후성 변화에 대한 연구와 더 불어 최근에는 종양의 약물유전학 특성에 대한 연구가 활발 히 시행되고 있다. 종양 생물학에 있어 중요한 유전자에서 다양한 배아세포 단일염기 다형성(single nucleotide polyp- morphism, SNP)의 중요성이 인식되면서 약물유전체학 분야 가 주목을 받고 있다. 아울러 외부 환경이나 식이 및 운동의 생활습관과 항암제 효과 간의 상호 작용에 관련하여 서구식 식이와 저운동량은 항암치료 후 생존에 악영향을 끼침이 밝 혀지기도 하였다. 즉 종양뿐 아니라 환자와 환경을 포함하 는 세 요소가 서로 다른 영향을 줄 수 있으므로 이들 간의 상호작용 기전을 고려한 각각의 표지자 개발이 요구된다.
임상적으로 유용한 표지자 개발을 위한 과제
암 치료분야에서 이러한 표지자들이 실제 환자 치료에 이 용되기 위해서는 많은 장애물이 해결되어야 한다. 치료 반 응률이 낮은 항암제는 예후가 좋은 환자수가 적어 통계 분 석이 어려울 수 있으므로 치료 반응 예측 표지자의 적절한 탐색이 불가능하다. 또한 현재 병용약물치료는 투약 일정이 다양하고 제조법이 다른 약물의 병합이 흔하다. 따라서 실 제 임상에서 표지자를 이용하기 위해서는 효과가 좋은 신약 개발과 임상 자료를 지혜롭게 공유하고 분석하는 것이 필요 하며 전향 임상연구를 통한 검증이 필수다. 아울러 일부 표 지자는 DNA, RNA, 단백 수준에서 다양한 기법들이 이용되 므로55 표지자의 합리적인 선택과 재연성 높은 실험기법의 확립이 관건이다. 따라서 임상영역에서 수행성이 뒷받침되 는 최선의 기법을 결정하기 위해서는 면밀한 임상, 실험실, 그리고 통계 접근이 필요하다.
표적 치료제와 세포독성 치료제 모두 효과를 나타내는 기 전은 각각 다르기 때문에 치료제별 생물학표지자 개발을 위 해서는 암세포의 약물 민감도나 저항성을 결정짓는 생물학 기전에 대한 이해가 필요하다. 종양은 종양 세포 자체와 더 불어 혈관신생에 의한 혈관조직, 기질 세포, 그리고 염증 세 포 등의 주변 미세환경을 구성하는 다양한 비종양 숙주 세 포들로 구성되므로 종양은 다양한 이질성을 가지는 세포의 집합이다. 항신생혈관 약물과 같은 일부 치료제의 표적은 종양 세포보다는 숙주 세포가 되므로 종괴 안에 표적과 일 치되는 숙주 세포에서 위치 평가가 가능한 치료 반응 관련 표지자가 동정되어야 한다. 또한 종양은 분자 경로의 상호 작용을 통한 신호전달계 간의 교류가 전형적인 특징이므로 동질성을 공유하는 다수의 신호전달경로에서 동시에 효과 를 나타낼 수 있는 표적 치료물질의 개발이 요구된다.
대부분 병용항암약물치료가 원칙이므로 약물에 따른 최 적의 표지자 배열이 지속 연구과제가 된다. 치료에 대한 내
성을 결정하는 종양 및 환자의 생물학적인 특성과 치료 후 저항성 획득에 대한 심도있는 연구가 향후 표지자의 유용성 을 배가시킬 것이다. 또한 전이 대장암 환자군과 완치 수술 후 환자군 간에 적용될 표지자에 차이가 있는 것처럼 임상 에서 치료 목적별로 표지자 개발과 적용은 차별화되어야 한 다. 따라서 수많은 표적분자들이 DNA, RNA, 단백질 등의 다양한 분석시료를 통하여 서열분석, 후성학적인 방법, transcriptome microarrays, in situ hybridization, 면역화학염색, 전사 후 변형 등의 다양한 기법으로 평가될 수 있으므로 표 지자 검사를 위한 기법의 표준화와 동시에 표지자의 검증이 반드시 필요하다.
결 론
신약개발 비용의 증가에도 불구하고 맟춤형 치료를 지향 하는 표적 치료분야에서 신약과 병행한 치료 반응 예측 표 지자 개발은 이미 현실이 되었다. 다양한 -omics 시대에 유 전체학과 메칠체학 분야와 transcriptomics에서 RNA와 부산 물, 단백체학, 대사체학 분야에 이르기까지 새로운 표지자 들이 연구 중이다. 하지만 세포독성 및 표적 치료 약물을 이 용한 다양한 병용화학약물의 치료효과가 축적되었음에도 동정된 예측 표지자의 임상 유용성을 검증해줄 만한 완전한 임상연구는 극소수에 불과하다. 실제 약물의 용량과 투여방 법, 직장과 대장암의 치료부위, 대장암 표현형과 분자 특성 이 다양한 상태에서 실험 모델을 통해 연구된 분자 표지자 가 환자에게 임상 적용되기 위해서는 다단계 과정이 요구된 다. 즉 단계별 검증을 통하여 치료법을 수정보완하고 추가 치료 이득을 확인함으로써 현재의 항암요법에 반응이 없을 수 있는 환자군을 동정할 수 있을 것이다. 또한 표적 치료약 물이 작용하는 분자 경로나 표적 물질을 명확히 예측할 수 있다면 이들 표지자에 근거한 맟춤형 치료의 최적 대상 환 자군을 선택하는 데 결정적인 역할을 할 수 있을 것이다. 특 히 진행 대장암 환자의 생존율이 낮은 현재 상황에서 새로 운 기술을 통한 유용성 있는 표지자 개발과 검증을 위한 노 력은 부단히 지속되리라 생각한다.
참고문헌
1. Danenberg PV. Pharmacogenomics of thymidylate synthase in cancer treatment. Front Biosci 2004;9:2484-2494.
2. Popat S, Hubner R, Houlston RS. Systematic review of mi- crosatellite instability and colorectal cancer prognosis. J Clin Oncol 2005;23:609-618.
3. Funaioli C, Pinto C, Mutri V, et al. Does biomolecular char- acterization of stage II/III colorectal cancer have any prog-
석기태 외 1인. 대장암 치료를 위한 생물학표지자 73
nostic value? Clin Colorectal Cancer 2006;6:38-45.
4. Chau I, Cunningham D. Adjuvant therapy in colon cancer - what, when and how? Ann Oncol 2006;17:1347-1359.
5. Benson III AB. Adjuvant chemotherapy of stage III colon cancer. Semin Oncol 2005;32:S74-S77.
6. Pallis AG, Mouzas IA. Adjuvant chemotherapy for colon cancer. Anticancer Res 2006;26:4809-4815.
7. Benson III AB. New approaches to the adjuvant therapy of colon cancer. Oncologist 2006;11:973-980.
8. Ahmed FE. Molecular markers that predict response to colon cancer therapy. Expert Rev Mol Diagn 2005;5:353-375.
9. Allen WL, Johnston PG. Have we made progress in pharma- cogenomics? The implementation of molecular markers in co- lon cancer. Pharmacogenomics 2005;6:603.
10. Lenz HJ. Pharmacogenomics and colorectal cancer. In: Lopez- Guerrero JA, ed. New trends in cancer for the 21st century.
Springer: New York, 2006:211-231.
11. Holen KD. Target practice: figuring out which, when, and why to use systemic therapies for metastatic colon cancer.
Cancer Invest 2006;24:98-105.
12. Allen WL, Coyle VM, Johnston PG. Predicting the outcome of chemotherapy for colorectal cancer. Curr Opin Pharmacol 2006;6:332-336.
13. Locker GY, Hamilton S, Harris J, et al. ASCO 2006 update of recommendations for the use of tumor markers in gastro- intestinal cancer. J Clin Oncol 2006;24:5313-5327.
14. Ciaparrone M, Quirino M, Schinzari G, et al. Predictive role of thymidylate synthase, dihydropyrimidine dehydrogenase and thymidine phosphorylase expression in colorectal cancer patients receiving adjuvant 5-fluorouracil. Oncology 2006;70:
366-377.
15. Jensen SA, Vainer B, Sorensen JB. The prognostic sig- nificance of thymidylate synthase and dihydropyrimidine de- hydrogenase in colorectal cancer of 303 patients adjuvantly treated with 5-fluorouracil. Int J Cancer 2007;120:694-701.
16. Salonga D, Danenberg KD, Johnson M, et al. Colorectal tu- mors responding to 5-fluorouracil have low gene expression levels of dihydropyrimidine dehydrogenase, thymidylate syn- thase, and thymidine phosphorylase. Clin Cancer Res 2000;
6:1322-1327.
17. Grem JL. Intratumoral molecular or genetic markers as pre- dictors of clinical outcome with chemotherapy in colorectal cancer. Semin Oncol 2005;32:120-127.
18. Matsuyama R, Togo S, Shimizu D, et al. Predicting 5-fluo- rouracil chemosensitivity of liver metastases from colorectal cancer using primary tumor specimens: three-gene expression model predicts clinical response. Int J Cancer 2006;119:
406-413.
19. Matsusaka S, Yamasaki H, Fukushima M, et al. Upregulation of enzymes metabolizing 5-fluorouracil in colorectal cancer.
Chemotherapy 2007;53:36-41.
20. Iacopetta B. Methyl-group metabolism and the response of colorectal cancer to 5-fluorouracil. Crit Rev Oncog 2006;12:
115-126.
21. Marsh S. Thymidylate synthase pharmacogenetics. Invest New Drugs 2005;23:533-537.
22. Brody JR, Huel T, Gallmeier E, et al. Genomic copy number changes affecting the thymidylate synthase (TYMS) gene in cancer: a model for patient classification to aid fluoropyr- imidine therapy. Cancer Res 2006;66:9369-9373.
23. Lenz HJ. Pharmacogenomics and colorectal cancer. Adv Exp Med Biol 2006;587:211-231.
24. Kim GP, Colangelo LH, Wieand HS, et al. Prognostic and predictive roles of high-degree microsatellite instability in co- lon cancer: a National Cancer Institute-National Surgical Adjuvant Breast and Bowel Project collaborative study. J Clin Oncol 2007;25:767-772.
25. Ribic CM, Sargent DJ, Moore MJ, et al. Tumor micro- satellite-instability status as a predictor of benefit from fluo- rouracil-based adjuvant chemotherapy for colon cancer. N Engl J Med 2003;349:247-257.
26. Elsaleh H, Powell B, McCaul K, et al. P53 alteration and mi- crosatellite instability have predictive value for survival bene- fit from chemotherapy in stage III colorectal carcinoma. Clin Cancer Res 2001;7:1343-1349.
27. Shen L, Catalano PJ, Benson III AB, et al. Association be- tween DNA methylation and shortened survival in patients with advanced colorectal cancer treated with 5-fluorour- acil-based chemotherapy. Clin Cancer Res 2007;13:6093- 6098.
28. van Kuilenburg AB. Screening for dihydropyrimidine de- hydrogenase deficiency: to do or not to do, that’s the question. Cancer Invest 2006;24:215-217.
29. Ploylearmsaeng SA, Fuhr U, Jetter A. How may anticancer chemotherapy with fluorouracil be individualized? Clin Pharmacokinet 2006;45:567-592.
30. Schmoll HJ, Arnold D. Update on capecitabine in colorectal cancer. Oncologist 2006;11:1003-1009.
31. Salgado J, Zabalegui N, Gil C, et al. Polymorphisms in the thymidylate synthase and dihydropyrimidine dehydrogenase genes predict response and toxicity to capecitabine-raltitrexed in colorectal cancer. Oncol Rep 2007;17:324-328.
32. Lentz F, Tran A, Rey E, et al. Pharmacogenomics of fluo- rouracil, irinotecan, and oxaliplatin in hepatic metastases of
74 The Korean Journal of Gastroenterology: Vol. 53, No. 2, 2009
colorectal cancer. Am J Pharmacogenomics 2005;5:21-33.
33. Gossage L, Madhusudan S. Current status of excision repair cross complementing-group 1 (ERCC1) in cancer. Cancer Treat Rev 2007;33:565-577.
34. Nadal C, Maurel J, Gallego R, et al. FAS/FAS ligand ratio: a marker of oxaliplatin-based intrinsic and acquired resistance in advanced colorectal cancer. Clin Cancer Res 2005;11:
4770-4774.
35. Stoehlmacher J, Park DJ, ZhangW, et al. A multivariate anal- ysis of genomic polymorphisms: prediction of clinical out- come to 5-FU/oxaliplatin combination chemotherapy in re- fractory colorectal cancer. Br J Cancer 2004;91:344-354.
36. Park DJ, Zhang W, Stochlmacher J, et al. ERCC1 gene poly- morphism as a predictor for clinical outcome in advanced colorectal cancer patients treated with platinum-based chemotherapy. Clin Adv Hematol Oncol 2003;1:162-166.
37. Viguier J, Boige V, Miguel C, et al. ERCC1 codon 118 poly- morphism is a predictive factor for the tumor response to ox- aliplatin/5-fluorouracil combination chemotherapy in patients with advanced colorectal cancer. Clin Cancer Res 2005;
11:6212-6217.
38. Suh KW, Kim JH, Kim DY, et al. Which gene is a dominant predictor of response during FOLFOX chemotherapy for the treatment of metastatic colorectal cancer, the MTHFR or XRCC1 gene? Ann Surg Oncol 2006;13:1379-1385.
39. Ruzzo A, Graziano F, Loupakis F, et al. Pharmacogenetic profiling in patients with advanced colorectal cancer treated with first-line FOLFOX-4 chemotherapy. J Clin Oncol 2007;25:1247-1254.
40. Martinez-Balibrea E, Manzano JL, Martinez-Cardus A, et al.
Combined analysis of genetic polymorphisms in thymidylate synthase, uridine diphosphate glucoronosyltransferase and X-ray cross complementing factor 1 genes as a prognostic factor in advanced colorectal cancer patients treated with 5-fluorouracil plus oxaliplatin or irinotecan. Oncol Rep 2007;17:637-645.
41. Bertagnolli MM, Compton CC, Niedzwiecki D, et al.
Microsatellite instability predicts improved response to ad- juvant therapy with irinotecan, 5-fluorouracil and leucovorin in stage III colon cancer. J Clin Oncol 2006;24: abstract 10003.
42. Nguyen H, Tran A, Lipkin S, et al. Pharmacogenomics of colorectal cancer prevention and treatment. Cancer Invest 2006; 24:630-639.
43. Marshall J. The role of bevacizumab as first-line therapy for colon cancer. Semin Oncol 2005;32:S43-S47.
44. Diaz-Rubio E. Vascular endothelial growth factor inhibitors in
colon cancer. Adv Exp Med Biol 2006;587:251-275.
45. Jubb AM, Hurwitz HI, Bai W, et al. Impact of vascular en- dothelial growth factor-A expression, thrombospondin-2 ex- pression, and microvessel density on the treatment effect of bevacizumab in metastatic colorectal cancer. J Clin Oncol 2006;24:217-227.
46. Ince WL, Jubb AM, Holden SN, et al. Association of k-ras, b-raf, and p53 status with the treatment effect of bevaci- zumab. J Natl Cancer Inst 2005;97:981-989.
47. Jubb AM, Oates AJ, Holden S, et al. Predicting benefit from anti-angiogenic agents in malignancy. Nature 2006;6:626-635.
48. Hebbar M, Wacrenier A, Desauw C, et al. Lack of usefulness of epidermal growth factor receptor expression determination for cetuximab therapy in patients with colorectal cancer.
Anticancer Drugs 2006;17:855-857.
49. Chua YJ, Cunningham D. Panitumumab. Drugs Today 2006;
42:711-719.
50. Wainberg Z, Hecht JR. Panitumumab in colon cancer: a re- view and summary of ongoing trials. Expert Opin Biol Ther 2006;6:1229-1235.
51. Cappuzzo F, Finocchiaro G, Rossi E, et al. EGFR FISH as- say predicts for response to cetuximab in chemotherapy re- fractory colorectal cancer patients. Ann Oncol 2008;19:717- 723.
52. Moroni M, Veronese S, Benvenuti S, et al. Gene copy num- ber for epidermal growth factor receptor (EGFR) and clinical response to antiEGFR treatment in colorectal cancer: a cohort study. Lancet Oncol 2005;6:257-286.
53. Sartore-Bianchi A, Moroni M, Veronese S, et al. Epidermal growth factor receptor gene copy number and clinical out- come of metastatic colorectal cancer treated with pani- tumumab. J Clin Oncol 2007;25:3238-3245.
54. Italiano A, Follana P, Caroli F-X, et al. Cetuximab shows ac- tivity in colorectal cancer patients with tumors for which FISH analysis does not detect an increase in EGFR gene copy number. Ann Surg Oncol 2008;15:649-654.
55. Spindler KL, Lindebjerg J, Nielsen JN, et al. Epidermal growth factor receptor analyses in colorectal cancer: a com- parison of methods. Int J Oncol 2006;29:1159-1165.
56. Vallbohmer D, Zhang W, Gordon M, et al. Molecular deter- minants of cetuximab efficacy. J Clin Oncol 2005;23:3536- 3544.
57. Finocchiaro G, Cappuzzo F, Janne PA, et al. EGFR, HER2 and Kras as predictive factors for cetuximab sensitivity in colorectal cancer. J Clin Oncol 2007;25:168S.
58. De Roock W, Piessevaux H, De Schutter J, et al. KRAS wild-type state predicts survival and is associated to early ra-
Suk KT, et al. Biomarkers for Colorectal Cancer Treatment 75
diological response in metastatic colorectal cancer treated with cetuximab. Ann Oncol 2008;19:508-515.
59. Martinez-Balibrea E, Manzano JL, Martinez-Cardus A, et al.
Combined analysis of genetic polymorphisms in thymidylate synthase, uridine diphosphate glucoronosyltransferase and X-ray cross complementing factor 1 genes as a prognostic factor in advanced colorectal cancer patients treated with 5-fluorouracil plus oxaliplatin or irinotecan. Oncol Rep 2007;17:637-645.
60. Meropol NJ, Gold PJ, Diasio RB, et al. Thymidine phosphor- ylase expression is associated with response to capecitabine plus irinotecan in patients with metastatic colorectal cancer. J Clin Oncol 2006;24:4069-4077.
61. Shirota Y, Stoehlmacher J, Brabender J, et al. ERCC1 and thymidylate synthase mRNA levels predict survival for color- ectal cancer patients receiving combination oxaliplatin and
fluorouracil chemotherapy. J Clin Oncol 2001;19:4298-4304.
62. Liersch T, Langer C, Ghadimi BM, et al. Lymph node status and TS gene expression are prognostic markers in stage II/III rectal cancer after neoadjuvant fluorouracil-based chemoradio- therapy. J Clin Oncol 2006;24:4062-4068.
63. Esteller M, Fraga MF, Guo M, et al. DNA methylation pat- terns in hereditary human cancers mimic sporadic tumori- genesis. Hum Mol Genet 2001;10:3001-7.
64. Esteller M, Gonzalez S, Risques RA, et al. K-ras and p16 aberrations confer poor prognosis in human colorectal cancer.
J Clin Oncol 2001;19:299-304.
65. Plumb JA, Strathdee G, Sludden J, Kaye SB, Brown R.
Reversal of drug resistance in human tumor xenografts by 2-deoxy-5-azacytidine-induced demethylation of the hMLH1 gene promoter. Cancer Res 2000;60:6039-6044.