간세포암과 간내담관암 조직에서 GLUT-1 당 수송 단백의 발현 양상
동아대학교 의과대학 외과학 교실, 병리학 교실*
김 영 훈 , 주 재 우 , 이 상 형 , 김 형 호 , 최 홍 조 , 조 세 헌 , 정 갑 중 , 김 상 순 , 노 미 숙 * , 홍 숙 희 * The Expression of GLUT-1 Glucose Transporter in the Immunohistological Distinction of
Hepatocellular Carcinoma from Intrahepatic Cholangiocarcinoma
Department of Surgery, Department of Pathology* Dong-A University, College of Medicine Young Hoon Kim, M.D., Jae Woo Ju, M.D., Sang Hyung Lee, M.D., Hyung Ho Kim, M.D
Hong Jo Choi, M.D., Se Heon Cho, M.D., Ghap Joong Jung, M.D., Sang Soon Kim, M.D.
Mi Sook Noh, M.D.,* Sook Hee Hong, M.D.*
Abstract B
Baacckkggrroouunndd//AAiimmss :: Malignant cells exhibit increased glycolytic metabolism, and in many cases increased glucose transporter gene expression. We studied the expression of the glucose transporters in hepatocellular carcinoma(HCC) and intrahepatic cholangiocarcinoma(CC). also, examined the use- fulness of Glut-1 glucose transporter in the discrimination of HCC from CC.
M
Meetthhooddss aanndd RReessuullttss :: 23 HCC, 15 CC and 8 normal liver tissues were investigated immunohistochemi- cally with Glut-1 glucose transporter. Immunostaning was regarded as positive when more than 5% of cells were stained. Among 38 liver tumor cases, Glut-1 was stained in 15(40%). in 2(9%) of 23 HCC and in 13(87%) of 15 CC were positive.(P=0.001) In HCC, underlying cirrhosis, 18(78%) were negative.(P=0.04) Other prognostic factors: histologic type, lymph node metastasis, distant metastasis did not show any significant correlation.
C
Coonncclluussiioonn :: Differential diagnosis between HCC and CC could be made by Glut-1 glucose transporter expression
Key Words : Hepatocellular carcinoma, Cholangio carcinoma, Glut-1
각주 : 이 논문은 1997년도 동아대학교 학술연구 조성비(공모과제)에 의하여 연구되었음.
Vol. 4. No. 1. 2000
서론
간세포암과 담관암은 원발성 간암 중 높은 발병빈 도와 불량한 예후를 보이는 종양이다.
간세포암은 영상 진단법의 발달에 따른 조기발견 에 따른 빈도가 증가하고 있으며, 수술적 수기의 발 달로 수술적 치료의 적응이 확대 되고 있다. 세계적 으로 지역적인 차이는 있으나 1-2% 정도이며, 한국 은 B형 간염의 증가에 따라 호발 지역에 속해 있다.
미국의 경우 백만명당 1-7명의 발병빈도를 보이고 16-23%의 불량한 5년 생존률을 보인다. 남성의 발병 빈도가 4배 정도 높게 나타나며, 기존의 간질환의 유 무 및 조기발견에 따른 수술적 절제에 따라 예후가 결정된다.1
담관암은 간의 악성암중 5-10%를 차지하며 0.3- 1.8%의 발생빈도와 여성보다 남성에서 1.5배 정도 발병빈도가 높다. 60세 이상의 고령에서 발견되며 수술적 치료가 이루어진 경우 15-20%의 5년 생존률 을 보인다.2
간세포암과 담관암 모두 외과적 병변의 절제술의 여부에 따라 예후가 다르게 나타나고, 수술적 치료를 받은 환자에서 술후 예후 지표로서 기존의 간경화, 조기진단 및 암의 확산 정도에 따른 술식의 차이, 림 프전이 및 원격전이의 유무 등이 있다.1,2
최근 암 연구에서 종양의 예후와 진단의 지표로서 당에 대한 특징적인 당친화도를 나타내는 Glucose transporter에 관한 연구가 보고되어 있는데, 특히 아 형인 GLUT-1에 대하여 여러 암세포에서 예후 인자 로서 분석하려는 시도가 이루어지고 있다. 간세포암 세포에서 GLUT-1 messenger RNA 치가 높게 관찰됨 에 따라,3 이에 저자들은 간세포암과 담관암에서의 GLUT-1의 발현 유무와 정도를 비교하여 예후 인자 지표로서의 가치를 알아보고자 본 연구를 행하였다.
대상 및 방법 1. 연구대상
본 실험에 사용된 연구대상은 92년 3월부터 99년 8 월까지의 간세포암, 간내담관암으로 진단 받고 간 절 제술을 받은 증례에서 본 연구에 충분한 종양조직이 포함되어 있으면서 파라핀 블록의 보관 상태가 양호 한 간세포암 23례, 간내담관암 15례, 총 38례를 선택 하였다.
대조군으로 간 결석으로 간 절제술을 실시한 증례 중, 주위가 정상 간 조직 소견을 보이는 8증례를 선 택하였다.
2. 연구방법
환자의 임상기록지와 병리보고서로부터 환자의 성 별, 나이 등을 조사하였다.
(1) 병리조직학적 검색
병리조직 검사를 위해 의뢰된 간 세포조직의 현미 경적 소견으로 림프절 전이와 원격 전이, 간경화의 유무, Edmondson-Steiner Grade를 조사하였고, 담 관암에서는 병리조직학적 소견을 바탕으로 하였다.
(2) 면역 조직화학적 염색 방법
모든 연구 대상 환자의 간 조직을 재검색하여 종양 을 대변할 수 있는 파라핀 포매 블록 하나를 선택 하 여 Avidin Biotin Complex(ABC)방법을 사용하여 면 역조직화학적 염색을 실시하였고, GLUT-1 poly- clonal antibody (Dako Co. USA)를 350배 희석하여 사용하였다. 크실렌과 에탄올을 이용 파라핀을 제거 한 후 재수화 과정을 거쳐 Phosphate buffered saline(PBS)으로 세척 후 3% 과산화수소를 조직 절 편위에 떨어뜨려 30분간 실온에 방치하여 내인성 peroxidase를 활동을 저지시킨 후, citrate buffer (PH 6.0)용액에 15분간 microwave 방법으로 전처리하여 1:350으로 희석된 비오틴과 다클론 1차 항체와 4℃
에서 하룻밤 정도 반응시킨 후 PBS로 세척한 뒤, 다 시 1:100으로 희석된 비오틴과 결합된 2차 항체 (Biotinylated Anti-Mouse Anti-Rabbit and Anti-Goat Immunoglobulins)를 실온에서 30분간 반응시키고 PBS로 씻은 후 발색제인 AEC를 첨가하였다. Mayer hematoxylin에서 3분간의 대조염색 후 crystal mount로 봉입하여 현미경으로 검경하였다.
(3) 면역조직화학적 염색의 판독
염색된 간세포암 및 담관암 조직을 현미경하에서 관찰하여, 세포막이 적갈색으로 염색되면 양성반응 으로 판독 하였다. 각 종양조직에서 염색되는 종양 세포 전부가 염색이 안되거나 종양세포의 5% 미만 에서 염색된 종양은 단백질 발현 음성 종양으로 하였 고, 5% 이상의 종양세포가 염색되고 이중 전체 종양 세포의 50% 이상 일 때 강양성, 50% 이하 일 때 약양 성으로 양성 반응을 구분하였다.
3. 통계처리 방법
양성 반응의 빈도를 IBM-PC SAS system을 이용하 여 Spearman 상관계수를 구하여 상관관계를 알 아보고, chi-square를 이용하여 p값이 0.05 이하일 때 통계적으로 유의성이 있는 것으로 판정하였다.
결과 1. 임상자료의 분석
23례의 간세포암 환자의 연령분포는 15세에서 78 세까지였으며, 남자가 17명(74%), 여자가 6명(26%) 이였다. 15례의 담관암 환자의 연령분포는 37세에 서 68세까지였으며 남자가 8명(53%), 여자가 7명 (47%)이였다. 간세포암, 담관암 환자의 나이는 모 두 50-59세 군이 가장 많았다.
2. 병리조직학적 소견
간세포암의 Edmoson-Steiner Grade는 23례에서 Grade I, II, III 각각 5례(22%), 6례(26%), 12례 (52%) 였다. 기존의 간경화가 관찰된 경우는 간세 포암 환자의 경우 23례중 18례(78%)였고, 담관암 환자의 경우 15례중 5례(33%)였다. 림프전이가 관 찰된 경우는 간세포암 환자의 경우 23례 중 3례 (13%), 담관암환자의 경우 15례 중 7례(47%)였다.
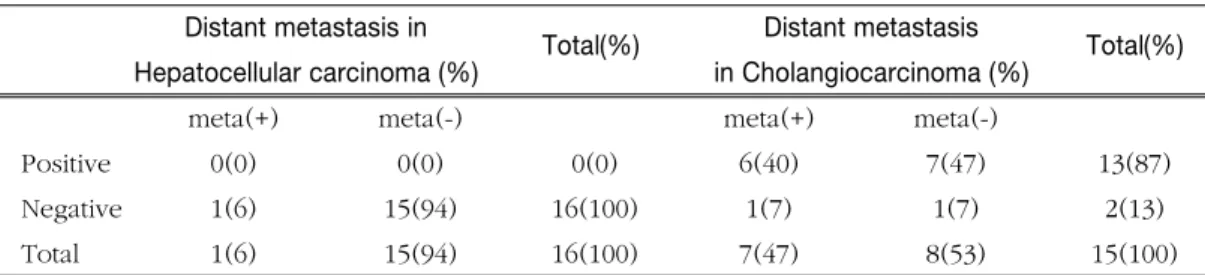
원격전이가 관찰된 경우는 간세포암 환자의 경우 2 례(9%)였고, 담관암 환자의 경우 7례(47%)이었다.
담관암의 조직학적 분류상 선암이 14례, 유두상 선 암이 1례로 선암 중 고분화형이 3례, 중등도 분화형 이 5례, 저분화형이 6례였다.
3. 면역조직학적 염색 양상
모두 38례중 간세포암(23례)과 간내담관암(15례) 에서 GLUT-1은 15개의 증례(40%)에서 양성반응이 었고, 간세포암 2례(9%), 간내담관암 13례(87%)에 서 양성반응을 보였다. 대조군의 간조직 8례에서는 모두 음성반응이었다.
4. 임상병리학적 소견과 비교
간세포암은 23례중 2례(9%)에서, 간내담관암은 15례 중 13례(87%)에서 양성반응을 보였으며, 통계 학 적 유 의 성 이 있 었 다 .(P=0.001) 간 세 포 암 의 Edmonson-Steiner Grade에 따른 분류에서 2례의 Grade III에서 양성 반응이었다.(Table 1) 담관암의 경우 선암 14례가 양성반응이었고 1례의 유두선 선 암에서 음성반응이었다.(Table 2) 고분화형과 중등 도 분화형 선암에 비해 저분화형 선암 6례는 강양성 반응이 나타났으며 고분화형과 중등도 분화형 선암 은 약양성이였다. 23례의 간세포암에서 간경화가 있는 18례(78%)에서 음성 반응이었으며, 이는 통계 학적 유의성이 있었다.(P=0.04) 림프전이가 관찰 된 간세포암의 경우 3례 중 1례, 담관암의 경우 7례 모두가 양성반응 이었으며(Table 4) 원격전이가 관 Table 1. Incidence of GLUT-1 expression in hepatocellular carcinoma according to Edmonson-
Steiner grade
Edmoson-Steiner grade
I (%) II (%) III (%) Total
Positive 0 (0) 0 (0) 2 (9) 2 (9)
Negative 5 (22) 6 (26) 10 (43) 21 (91)
Total 5 (22) 6 (26) 12 (52) 23 (100)
Table 2. Incidence of GLUT-1 expression according to histologic type in cholangiocarcinoma
Well Moderate Poor Papillary Total(%)
differentiation(%) differentiation(%) differentiation(%) adenocarcinoma(%)
Positive 2 (13) 5 (33) 6 (40) 0 (0) 13 (87)
Negative 1 (7) 0 (0) 0 (0) 1 (7) 2 (13)
Total 3 (20) 5 (33) 6 (40) 1 (7) 15(100)
찰된 경우는 간세포암에서는 2례 모두 음성반응이 었고, 담관암의 경우 7례 모두 양성반응이었으나 (Table 5) 통계학적 유의성은 없었다.
고찰
악성 종양의 생존 및 성장을 위해 새로운 혈관의 형성이 필요하다는 사실은 종양 맥관생성기전 (tumor angiogenesis mechanism)으로 알려져 있 다.4,5초기의 악성 종양이 더 성장해 나가기 위해 종 양 조직 내로 새로운 혈관이 형성되어 종양세포 자 체의 혈액 공급 체계를 갖추어야 한다.6,7이것이 이 루어지지 않으면 수동적 확산을 통해 영양 공급과 노폐물의 배설이 가능한 크기 이상으로 성장 할 수 없게 된다. 일단 새로운 혈액 공급 체계를 갖춘 종 양은 생존이 가능하게 되고 성장하게 된다. 새로운 혈액 공급 체계를 갖춘 종양은 충분한 영양을 얻게 되고 성장하게 된다.8
악성 종양에서의 낮은 산도, 낮은 혈당 수치, 높은 lactate/pyruvate 비가 나타나는데, 이는 모두 해당 촉진성의 ATP 생성을 나타내는 것으로 알려져 있
다.9종양 세포에서 조직 저산소증이 조장되어 해당 촉진성의 혐기성 대사가 일어나며 종양세포 내의 당의 흡수 및 당의 분해가 촉진된다.10-12
당을 세포 내로 운반시키는 역할을 하는 것이 세 포막에 존재하는 막단백으로 당 수송 단백(glucose transporter)으로 알려져 있다.13,14
당 수송 단백은 당을 세포막을 통과시키는 역할을 하는 막단백으로15,16나트륨 의존형 당 수송과 facili- tated-diffusion 당 수송 2가지 종류가 알려져 있으 며, 이 중 facilitated-diffusion 당 수송 단백에는 6가 지 아형이 존재하는데, GLUT 1/적혈구 형, GLUT 2/간 형, GLUT 3/뇌 형, GLUT 4/근육 지방 형, GLUT 5/소장 형, GLUT 7/간 미소체 형이 확인되었 다.17-19
GLUT-1 isoform은 높은 당친화도로 특징지어지 고 또한 적혈구 막, 뇌 내피세포, 말초 신경의 신경 외막에서도 발현되는데 이 모두가 세포의 대사와 당의 적절한 공급과 연관이 있음을 알 수 있다.20-22
특히 GLUT-1의 발현은 직장암, 유방암, 방광암, 폐암에서 과다하게 나타나며, 세포 분화도, 종양의
Table 3. Incidence of GLUT-1 expression in hepatocellular carcinoma and cholangiocarcinoma according to underlying liver cirrhosis
Underling Liver cirrhosis
Total(%) Underling Liver cirrhosis
Total(%) in Hepatocellula carcinoma (%) in Cholangiocarcinoma (%)
Cirrhosis(+) Cirrhosis(-) Cirrhosis(+) Cirrhosis(-)
Positive 0(0) 2(9) 2(9) 5(33) 8(54) 13(87)
Negative 18(78)* 3(13) 21(91) 0(0) 2(13) 2(13)
Total 18(78) 5(22) 23(100) 5(33) 10(67) 15(100)
* : P=0.04
Fig. 1 Normal hepatocytes are negative for GLUT-
1 stain. (ABC, x 100) Fig. 2 Negative staining of GLUT-1 in hepatocellular carcinoma. (ABC, x 100)
크기, 전이와 상관 관계가 있고, 이는 불량한 예후 와 연관이 있으며, 난소암의 종양 발생과 연관이 있 다고 보고 되고 있다.23,24
최근 연구에서 GLUT-1의 발현 정도를 종양 세포 진단의 수단으로 유용하게 사용될 수 있다고 보고 하고 있다. 이러한 연구는 여러 가지 종양세포에서 GLUT-1의 발현 정도를 대조군과 비교하였으며 체 내 삼출액 분석에서 전이성 암은 GLUT-1의 양성 발 현 정도는 93%로 나타났으며, 세포 병리학적 진단 에 이용할 수 있음을 제시 하였다.9 유방암에서 Glut-1의 발현은 42%로 암의 침윤성과 관련성을 제 시 하였다.25갑상선암에서 46%의 발현을 보이며 정 상 조직이나 양성 결절에서는 검출되지 않아 갑상 선암의 진단에 이용될 수 있다고 한다.26 피부기저 세포암과 피부 편평 세포암에서 각각 93%, 87%로 세포의 증식성 병소와 Glut-1의 발현이 관련이 있다 고 한다.27 대장암에서 83%로 보고 되어있으며 Glut-1의 발현과 예후의 상관성을 보고하고 있다.23 이에 따라 임상적으로 민감도가 높고 간편한 종양 세포의 표식자로 사용할 수 있다고 하며 다른 표식
자들과는 달리 주어진 악성 세포의 생존 가능성에 대한 생화적인 면을 가늠할 수 있다고 한다.23
분자생물학적 측면에서 종양에서의 GLUT-1의 과 다발현은 완전히 분석되지 않았으나, Glut-1의 과다 발현은 종양생성에 따른 당 대사를 유발시키며, hexokinase 동위 효소의 발현과 2,6-fructose bis- phosphate의 생성이 따른다고 한다. 실험적으로 ras와 src 종양 유전자가 GLUT-1 의 발현을 유도한 다고 보고되었다. 조직의 저산소증이 Glut-1의 발현 을 유도 할 수는 있으나 비종양세포에서는 관찰 되 지 않았다고 한다.28-30
실험적으로 인간과 쥐의 간세포암 세포에서 ery- throcyte glucose transporter의 양성 발현이 관찰되 었다. 그러나 본 연구에서는 GLUT-1의 발현이 분명 치 않음을 알 수 있었다. 이는 간암세포에서 흔히 볼 수 있는 저혈당에 기인한다고 생각된다. 간암에 서 저혈당증에 대해 아직 정확한 병리 기전은 밝혀 지지 않고 있다.31
비록 간세포암은 급속 성장하는 종양이나 저혈당 의 원인이 될 수 있는 해당 작용과 당이용의 증가에
Table 4. Incidence of GLUT-1 expression in hepatocellular carcinoma and cholangiocarcinoma according to lymph node metastasis
Lymph node metastasis
Total(%) Lymph node metastasis
Total(%) in Hepatocellular carcinoma (%) in Cholangiocarcinoma (%)
node(+) node(-) node(+) node(-)
Positive 1(4) 1(4) 2(9) 5(55) 6(40) 13(87)
Negative 2(9) 19 (83) 21(91) 0(0) 2(13) 2(13)
Total 3(13) 20(87) 23(100) 7(47) 8(53) 15(100)
Fig. 3 Positive staining of GLUT-1 in hepatocellular
carcinoma. (ABC, x 100) Fig. 4 Positive staining of GLUT-1 in cholangiocarcinoma. (ABC, x 100)
대한 증거는 아직 없다.28 이는 간세포암에서 당의 대사가 증가되어 있으나, 정상 간세포에서 당의 생 산이 증가되어 종양세포에 이용되는 증가된 당의 이용을 보상할 수 있고, 이에 따라 종양세포가 성장 한다고 추측된다. 또한 정상 간세포와 간세포암 세 포에서 glycogen이 증가되어 있는데, 이는 종양세 포에서 해당 작용과 당의 생성을 억제하는 어떤 물 질이 생성됨을 암시한다.29-32
본 실험의 결과에서 2증례에서 비록 양성 반응으 로 나타났으나 담관암에 비해서 반응의 정도가 낮 은 것은 이러한 원인으로 생각된다.
담관암의 경우 술전 정보가 중요하다. 이는 정확 한 진단으로 어떠한 치료법이 적용 될 수 있나를 결정하여야 하기 때문이다. 담관암의 수술적 치료 법에는 많은 암세포의 절제가 중요한 관건으로 암 의 확산 정도에 따라 간엽 절제술, 담도와 간의 문 합술 등의 여러 수술적 방법을 사용될 수 있다.1,2
또한, 수술시 육안적 소견으로 감별이 어려우며 15%이상에서 간외 담도 조직을 침범한다.33그리고 수술시 고분화형의 담관암의 경우 동결생검 검사상 으로도 정확히 진단 할 수가 없다.34
본 실험에서 GLUT-1에 대한 간세포암과 간내담관 암에서 발현의 양상이 차이가 있었으며, 간세포암 과 간내담관암의 감별이 가능할 수 있으리라 사료 된다.
이에 대한 추후 장기간의 추적조사와 더 많은 증 례 연구를 통해 간세포암과 담관암에서 Glut-1의 종양발생 유전자로서의 의의와 Glut-1을 매개로 한 당 이용 증가가 종양 세포의 성장을 유도하는 불량 한 예후로서 의의를 밝힐수 있으리라 사료된다. 그 리고 원발성 간암의 감별진단에 GLUT-1의 이용과
간경화와 Glut-1의 발현, 담관암의 분화도에 따른 발현 정도의 차이에 대한 의의를 밝힐 수 있을 것 으로 사료된다.
요약
본 연구는 1992년 3월부터 1999년 8월까지 동아 대학 병원에서 간세포암과 간내담관암으로 진단받 고 간 절제술을 시행한 38례의 종양 조직에서 GLUT-1 발현을 면역조직 화학적 염색을 실시하여 간세포암과 간내담관암에서 발현양상을 관찰하고 예후와의 연관성을 살펴본 바 다음과 같은 결과를 얻었다.
1. 모두 38례중 15례(40%)에서 양성반응이었고, 23례의 간세포암과 15례의 간내담관암 조직에 서 GLUT-1의 발현은 각각 간세포암은 23례중 2례(9%), 간내담관암은 15례중 13례(87%)에서 양성반응을 보였다.
2. 간 세 포 암 에 서 GLUT-1 발 현 은 Edmoson- Steiner grade, 림프전이, 원격전이와 상관 관계 는 나타나지 않았으며 간경화가 있었던 18례 (78%)에서 음성 반응을 나타냈으며 이는 통계 학적 의미가 있었다.(P=0.04)
3. 담관암에서 GLUT-1 발현은 조직 분화도, 간경 화의 유무, 림프전이, 원격전이와 상관 관계는 나타나지 않았다.
4. 간세포암과 담관암에서 GLUT-1에 대한 면역조 직학적 염색에서 간세포암보다 간내담관암 조 직에서 양성 발현 빈도가 높았으며(P=0.001), 간 세포암과 간내담관암의 감별진단에 Glut-1의 확인이 도움을 주리라 사료된다.
이상의 본연구에서 간세포암과 담관암에서의
Table 5. Incidence of GLUT-1 expression in hepatocellular carcinoma and cholangiocarcinoma according to distant metastasis
Distant metastasis in
Total(%) Distant metastasis
Total(%) Hepatocellular carcinoma (%) in Cholangiocarcinoma (%)
meta(+) meta(-) meta(+) meta(-)
Positive 0(0) 0(0) 0(0) 6(40) 7(47) 13(87)
Negative 1(6) 15(94) 16(100) 1(7) 1(7) 2(13)
Total 1(6) 15(94) 16(100) 7(47) 8(53) 15(100)
GLUT-1의 발현은 다른 악성 종양에서 밝혀진 종양 의 발생과 진행에 관련하는 유전자 중 하나로 Glut- 1을 생각할 수 있으며, 종양의 성장에 따른 불량한 예후와의 연관성과 원발성 간암의 감별 진단, 간경 화와의 관련성, 담관암의 분화도에 따른 발현 정도 의 차이, 그리고 술전 검사 및 수술적 치료법의 결 정에 향후 더 장기적인 추적 조사를 통해 도움을 주 리라
참고문헌
1. Zakim E, Boyer L, “Hepatic tumor”Hepatology 2nd ed 1543, 1990
2. Zakim E, Boyer L, “Disease of the biliary tree”Hepatology 2nd ed 1210, 1990
3. Su TS, Tasi TF, Chi CW, Han SH, Chou CK,
“Elevation of facilitated glucose transporter messenger RNA in human hepatocellular car- cinoma”Hepatology 11:118, 1990
4. Folkman J, “The role of angiogenesis in tumor growth”Semin Cancer Biol 3:65, 1992 5. Folkman J, Watson K, Ingber D, Hanahan D,
“Induction of angiogenesis during the transi- tion from hyperplasia to neoplasia”Nature 1339, 1989
6. Forkman, J, “Tumor angiogenesis: Therapeutic implication”N Engl J Med 285:1182, 1971 7. Knighton D, Ausprunk D, Trapper D,
Folkman J, “Avascular and vascular phases of tumor growth in the chicken embryo”Br J Cancer 35:347, 1977
8. Gilbrone M, Leapmans S, Cotrans R, Folkman J. “Tumor dormancy in vitro by prevention of neovascularization”J Exp Med 136:61, 1972 9. Good JT, Taryle DA, Sahn SA, “Pathogenesis
of low glucose / low pH malignant effu- sions.”Am Rev Respir Dis 131:737, 1985
10. Warburg O, “On the origin of cancer cells.”
Science 123;309, 1956
11. Birnbaum MJ, Haspel HC & Rosen OM,
“Transformation of rat fibroblasts by FSV repidly increase glucose transporter gene transcription”Science 235:1495, 1987 12. Flier JS, Mucckler, Lodish HF, “Elevated lev-
els of glucose transporter and transporter- messenger RNA are induced by ras or src oncogenes”Science 235;127, 1988
13. Gould, GW and Lienhard, GE, “Facilitative glucose transporters: An expanding family.”
Trends Biochem Sci., 15:18, 1990
14. Takata K, Kasahara M, Oka T, Hirano H,
“Mammalian sugar transporters: their local- ization and link to cellular function.”Acta Histochem Cytochem, 26:165, 1993
15. Pessin JE, Bell GI, “Mammalian facilitative glucose transporter family, structure and molecular regulation.”Ann Rev Physiol 54:911, 1992
17. Yamamoto T, “Over-expression of facilita- tive glucose-transporter gene in human can- cer.” Biochem Biophys Res Commun, 170:223, 1990
18. Rhoads DB, Takano M, Gattonicelli S, Chen
CC, Isselbacher KJ, “Evidence for expression of the facilitated glucose transporter in rat hepatocyte.”Proc Natl Acad Sci U.S.A 85:9042, 1988
19. Yamamoto T, Seino Y, Fukumoto H, Koh G, Yano H, Inagaki N, Yamada Y, Inoue K, Brown RS, Wahl RL, “Overexpression of GLUT-1 glucose transporter in human breast cancer”Cancer 72: 2979, 1993
20. Pardridge W, Boado R, Farrell C, “Brain- type glucose transporter (GLUT1) is selec- tively localized to the blood-brain-barrier.”J Biol Chem 265:180, 1990
21. Froehner SC, Davies A, Baldwin SA, Lienhard GE, “The blood-nerve barrier is rich in glucose transporter.”J Neurocytol 17:173, 1988
22. Younes M, Brown RW, Stephenson M, Gondo M, Cagle PT, “Wide expression of the human erythrocyte glucose transporter GLUT-1 in human cancer”Cancer 15:1046, 1997
23. Manabe T, Imura H, “Overexpression of facillitative glucose transporter gene in human cancer”Biochem. Biophys. Res.
Commun. 170, 1990
24. Goldfischer M, Weiser K, Pritsker A, Haber R, Burstein D, “GLUT1 glucose transporter expression in ovarian neoplasm: A marker of tumor progression”Lab Invest 74:90, 1996
25. Younes M, Brown, RW, Mody, Fernadez L, Laucirica R, “GLUT-1 expression in human breast carcinoma”Antcancer Res 15:2895,
1995
26. Haber RS, Weiser KR, Pritsker A, Reder I, Rurstein DE, “GLUT-1 glucose transporter expression in benign and malignant thyroid modula. Thyroid 7:363, 1997
27. Baer S, Casaubon L, Younes M, “Expression of the human erythrocyte glucose trans- porter GLUT-1 in cutanuous neoplasia”J Am Acad Dermatol 37:575, 1997
28. White MK. Weber MJ, “Transformation by the src oncogene alters glucose transport into rat and chicken cells by different mech- anism.”Mol Cell Biol 8;138, 1988
29. Younes M, Lechago LV, Lechago J, “Overex- pression of the human erythrocyte glucose transporter occurs as a late event in human colorectal carcinogenesis and is associated with an increased incidence of lymph node metastasis”Clin Cancer Res 2:1151, 1996 30. Bashan N, Burdett E, Hundal HS, Klip A.,
“Regulation of glucose transporter and GLUT-1 glucose transporter expression by O2 in muscle cells in culture.”Ann J Physiol 262, 682, 1992
31. Kew MC, Dusheiko GM: “Paraneoplastic manifestations of hepatocellular carcinoma”
305, 1985
32. Bismuth H, Malt RA. “Carcinoma of the bil- iary tract.”N Engl J Med 301:704, 1979 33. Horecker BL, Hiatt HH. “Pathways of carbo-
hydrated metabolism in normal and neoplas- tic cells”N Engl J Med 258:177, 1958 34. Warren KW, Choe DS, Plaza J, Phelian M
“ Results of radical resection for peri-