급성 부동 스트레스 후 척수 회색질에서 Peroxiredoxin Ⅰ및 Ⅲ의 발현 변화
대전선병원 외과학교실, 강원대학교 동물생명과학부 동물 생명공학과*, 충남대학교 의과대학 해부학실**
백남현∙곽승수∙이동석*∙이영호**
─ Abstract ─
Characterization of Peroxiredoxins in the Gray matter in the spinal cord after Acute Immobilization Stress
Nam-Hyun Paek, M.D., Seung-Soo Kwak, M.D., Dong-Seok Lee, M.D.*, Young-Ho Lee, M.D.**
Department of Surgery, SUN General Hospital, Korea
College of animal resource science sciences, Kangwon National University, Chunchon,Korea*
Department of anatomy, College of Medicine, Chungnam National University, Daejeon, Korea**
Purpose: Many stresses produce reactive oxygen species and bring about mechanism of antioxidant reaction.
Cytokine and a neurotransmitter through the cell membrane, as well as signal transduction through the cell mem- brane, are used for various pathological condition of the brain, such as neurodegenerative disease. There are sev- eral antioxidant enzymes in cells (superoxcide dismutase, glutathion peroxidasae, peroxiredoxin catalase, etc.)
Methods: This study used single- or double-label immunohistochemical techniques to analyze mouse spinal neuron cells expressing Prx I and Prx III after acute mobilization stress.
Results: Prx I was observed in dendritic cell of the gray matter of the spinal cord, and Prx III was observed in the cytoplasm of the GM of the spinal cord.
Conclusion: The results of this study will help to explain differences of expression in the distributions of the peroxiredoxin enzymes of the spinal cord. (J Korean Soc Traumatol 2006;19:105-112)
Key Wards: Peroxiredoxins, Acute immobilization stress
� Address for Correspondence : Dong-Seok Lee, M.D.
Division of Animal Biotechnology, Animal Resources Science, Kangwon National University, Chuncheon-si, Gangwon-do, 200-701 Korea Tel : 82-33-250-8612, Fax : 82-33-251-7719, E-mail : dslee@kangwon.ac.kr
접수일: 2006년 9월 13일, 심사일: 2006년 10월 11일, 수정일: 2006년 10월 18일, 승인일: 2006년 10월 31일
Ⅰ. 서 론
부동 스트레스와 같이 다양한 스트레스들은 산화 스트레 스를 유발하며, 이들은 세포의 호흡과정이나 여러 종류의 호르몬, 성장인자, cytokine 및 신경전달 물질 등의 세포 막 수용체를 통해서, 신호를 전달하는 과정에서 활성산소 기(superoxide, hydrogen peroxidase, hydroxyl rad-
ical, nitric oxide 등)를 발생시킨다고 알려져 있다. 이 때 발생한 활성 산소기 들은, 이미 신경전달 물질로 알려 져 있는 NO등과 함께 새로운 신호전달물질로 대두 되고 있는데, 특히 식작용을 하는 호중구나 대식세포와 같은 면역세포 뿐만 아니라, 인체 폐조직의 섬유모세포, 폐동맥 혈관 내피세포와 평활근세포 및 상피세포 등에서도 NADPH oxidase들이 존재하고, 이들이 산소감지 기능과
함께 활성 활성산소기를 발생시켜서 이들 물질을 통해 세 포내에 신호 전달에 관여 한다는 것이 알려진 이후로 활성 산소기 또는 유리 산소기와 관련된 연구가 최근 활발히 진 행되고 있다.
이러한 산화 스트레스로 인해 발생된 활상 산소기 및 RNS(reactive nitrogen species)는 우리 몸에서 효소 적, 비효소적 방어체계에 의해 중성화되는 과정을 거치게 되는데 현재까지 superoxide dismutase (SOD), glu- tathion peroxidase, peroxiredoxin (PRX), catalase 등이 그 역할을 수행한다고 알려져 있다.
이중에서 peroxiredoxin은 거의 모든 생명체에서 공통 적으로 보존되어 있는 peroxidase로서, 현재까지 알려진 작용으로는, H2O2 또는 alkylohydroperoxidase를 환원 시켜서 물과 알코올로 만드는 효소이다. peroxiredoxin의 종류는 세포질 내에 존재하는 typeⅠ과Ⅱ. 미트콘드리아 내부의 typeⅢ, 핵 내부의 typeⅠ과 Ⅱ등이 존재하며, endoplasmic reticulum내에서 생성되고 분비되는 type
Ⅳ, 용해소체 내에 존재한다고 알려져 있는 typeⅤ, 폐에 많다고 알려진 typeⅥ 등이 있다.
본 실험에서는 peroxiredoxin중에서도 신경아교세포에 나타나는 peroxiredoxin typeⅠ과 신경세포에서 대표적으 로 나타나는 peroxiredoxin typeⅢ가 급성부동 스트레스 후 어떠한 발현 변화를 보이는지를 알아보고자 하였다.
Ⅱ. 대상 및 방법 1. 실험재료
실험동물인 Sprague Dawley계 흰쥐(수컷, 4주령과 16주령)은 다물 사이언스(대전 광역시 유성구 갑동)에서 구입하여 사용하였다.
Paraformaldehyde는 Merck사에서 ABC (avidin- biotin peroxisase complex) kit는 Vector사 (Burlingame, 캘리포니아, 미국)에서 구입하여 사용하였 다.
2. 급성 부동 스트레스 모델
실험동물인 Sprague Dawley계 흰쥐(수컷, 4주령과 16주령)를 각각 5마리씩 대조군(4주령-5마리, 16주령 5마 리)과 스트레스를 가한 군(4주령-5마리, 16주령 5마리)으 로 나누어 실험하였다. 할로탄을 사용하여 가볍게 흡입마 취 시킨 후 평평한 아클릴 판에 흰쥐의 양네발에 녹색 청 테이프를 이용하여 등이 아래를 향하도록 하여 움직이지 못하게 붙였다. 그리고 난 후 6시간동안 급성 부동 스트레 스를 주었다.
부동 스트레스 방법은 Kvetnansky and Mikulaj
(1970a, b)에 의한 실험방법을 그대로 사용하였다.(17) 3. 조직준비
급성 부동 스트레스를 6시간 동안 가한 후 sodium pentobarbital (40 mg/ kg)로 마취하였고 헤파린을 함 유한 37�C 생리식염수를 실온에서 혈액이 모두 빠져나갈 만큼 심장을 통해 관류한 후 4% paraformaldehyde를 포함한 0.1 M PB(pH 7.4, 4�C, 600~700 ml/1 kg)를 관류하였다. 조직절취는 횡단면(cross section)으로 10번 째 흉추(thoracic spinal cord)를 절취하였고 적출한 조 직은 4% paraformaldehyde용액에 24시간 동안 후고정 하였다.
후고정이 끝난 조직은 흐르는 물에 3시간 동안 수세과정 을 거친 다음 탈수과정과 파라핀 침투과정을 통해 파라핀 으로 포매한 후 4 μm로 절편하여 sialine이 코팅된 슬라 이드 위에 붙였다.
4. Hematoxylin-eosin (H-E) 염색
형태학적 변화를 관찰하기 위해 HE 염색을 실시하였다.
절편된 조직은 탈파라핀 과정을 거쳐 Harris` hematox- ilin용액 안에서 1분, 0.1% ammonium용액 안에서 3 초, eosin 10초 정도 염색시킨후 탈수 과정을 거친 후 조 직절편위에 Canada balsam을 떨어뜨려 coverslip으로 봉입하고 광학현미경으로 관찰하였다.
5. 면역조직화학염색
파라핀이 제거된 조직절편은 antigen retrieval을 하기 위해 0.1 M citric acid 용액에 넣고 압력 밥솥(Whisler, Germany)안에서 121�C에서 4분 동안 끓이고 난 후 실 온에서 10분간 방치한 후 곧바로 0.1% Tween 20이 함유 된 1X PBS 완충액으로 5분씩 세번 세척하였다. 조직절편 은 내재성 peroxidase 활성을 제거시키기 위해 3% H2O2
를 포함한 60% methanol용액을 만들어 상온에서 15분 동안 반응시킨 다음 1X PBS 완충액으로 5분씩 세번 세척 하고 10% normal goat serum (NGS)으로 30분 동안 상온에서 반응시켜서 비특이적 반응을 억제하였다. 면역조 직화학 염색은Vectastein ABC (avidin-biotin perox- isase complex) kit (Vector Laboratories)를 사용하였 다.
1차 항체 (PrxⅠ-1:1000, PrxⅢ-1:1000,)는 1%
bovine serum albumin (BSA)과 1% NGS가 함유된 1X PBS에 희석시켜 상온에서 30분 동안 반응시켰고 1X PBS 완충액으로 5분씩 세번 세척하였다. 2차 항체도 1%
BSA와 1%NGS가 함유된 1X PBS에 biotinyated anti-rabbit IgG 를 1:200으로 희석하여 상온에서 30분
동안 반응시켰다. avidin-conjugated peroxidase는 1X PBS에 10 μl/ml로 희석시켜 반응 30분전에 미리 만들어 놓고 상온에서 30분간 반응시켰다.
반응이 끝난 조직절편은 1X PBS로 5분씩 세 번 세척한 후 DAB(0.02% 3,3′-diaminobenzedine tetrahydror- ide and 0.005% H2O2 in 1X PBS)로 약 1분간 발색시 키고 탈수과정을 거쳐 영구 보존을 위해 조직절편 위에 Canada balsam을 떨어뜨려 coverslip으로 봉입하고 광 학현미경으로 관찰하였다.
6. 결과분석
PrxⅠ및 PrxⅢ 면역활성 세포수(평균±S.E.M)를 단위 면적(mm2)당 계수하였다. 대조군과 스트레스 후의 단위면 적당 PrxⅠ및 PrxⅢ 면역활성 세포수는 paird t-test로 차이를 비교하였으며, P<0.05일때 통계적으로 유의한 차 이가 있다고 판정하였다.
Ⅲ. 결 과
1. 급성 부동 스트레스 후 PrxⅠ면역활성 변화
1) 4주령 어린쥐에서 Prx1면역활성 변화
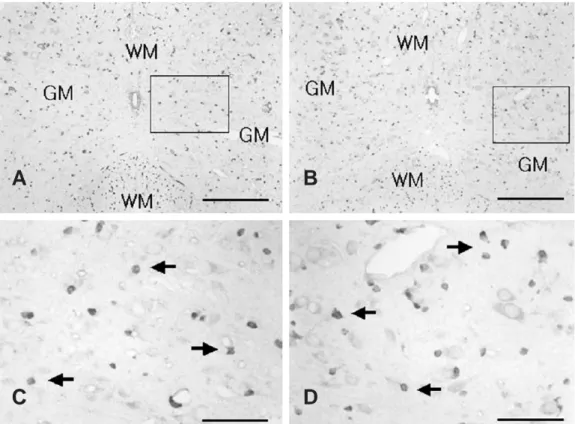
4주령 정상대조군의 척수 회색질에서 PrxⅠ면역활성은 희 소돌기아교세포(oligodendrocyte)로 추정되는 세포는 많이 나타났으며(Fig. 1A, C) 6시간동안 스트레스를 받은 4주령 어린쥐의 척수 회색질에서는 정상대조군보다 PrxⅠ양성 세 포가 약간 증가한 것으로 관찰되었다(Fig. 1B), 1 P<0.05.
2) 16주령 성숙쥐에서 PrxⅠ면역활성 변화
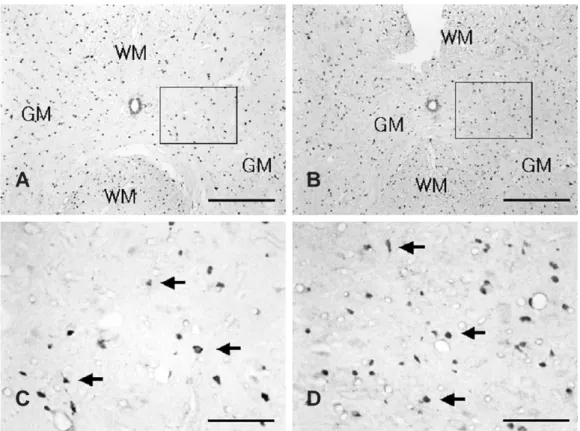
16주령 정상대조군의 척수 회색질 에서의 PrxⅠ면역활 성도 역시 희소돌기아교세포로 추정되는 세포들에서 상당 히 많이 나타났으며(Fig. 2A, C) 6시간동안 스트레스를 받은 16주령 성숙쥐의 척수 회색질 에서는 PrxⅠ양성 세 포가 상당히 많이 증가하였음이 관찰되었다(Fig. 2B, D), 3 P<0.01.
또 16주령 성숙쥐에서의 PrxⅠ 양성세포 수는 4주령 어 린쥐의 증가된 PrxⅠ양성세포의 수보다 약 2배정도 증가 되었다(Fig. 3).
2. 급성 부동 스트레스 후 PRX Ⅲ 면역활성 변화
1) 4주령 어린쥐 에서 PrxⅢ 단백질 발현 변화
Fig. 1. Prx I immunoreativity in the spinal cord after acute immobilization stress in young rats. (A) Prx I-positive cells were observed in the gray matter (GM) of the spinal cord in young controls. (B) The number of Prx I-positive cells were slightly increased in the GM of the spinal cord in stressed young rats compared with that in young control. (C) Magnified photograph of rectangular area in Fig. 1A. (D) Magnified photograph of rectangular area in Fig. 1B. Scale bar: A and B, 200 μm; C and D, 50 μm (arrows, Prx I-positive cells. WM, white matter)
A B
C D
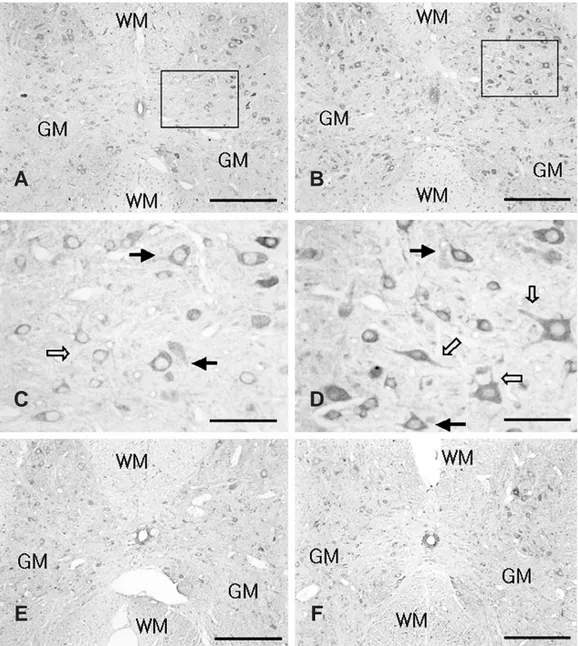
4주령 어린쥐 정상대조군의 척수 회색질에서 PrxⅢ 면 역활성이 신경세포에서 많이 나타났으며(Fig. 4A, C) 6 시간동안 스트레스를 받은 4주령 어린 쥐의 척수 회색질에 서 PrxⅢ 양성세포는 정상대조군에 비해 상당히 많이 증
가하였음이 관찰되었다(Fig. 4B, D), 5 P<0.01.
스트레스 밭은 어린쥐에서는 세포의 가지돌기로 여겨지 는 신경섬유들이 선명하게 염색된 세포들이 많이 관찰되었 다(Fig. 4D). 그리고 PrxⅢ는 대부분 세포질에 구두적들
Fig. 2. Prx I immunoreactivity in the spinal cord after acute immobilization stress in adult rats. (A) Prx I-positive cells were observed in the gray matter (GM) of spinal cord in adult controls (B) The number of Prx I-positive cells were increased in the GM of the spinal cord in stressed adult rats compared with that in adult controls. (C) Magnified photograph of rectangular area in Fig. 2A. (D) Magnified photograph of rectangular area in Fig. 2B. Scale bar: A and B, 200 μm; C and D, 50 μm (arrows, Prx I-positive cells. WM, white matter)
A B
C D
Fig. 3. Prx I immunoreactivities in the spinal cords following acute immobilization stress in young (n=5) and adult (n=5) rats.
Fig. 5. Prx III immunoreactivities in the spinal cords following
acute immobilization stress in young (n=5) and adult
(n=5) rats.
이 찍힌 형태(punctuated)로 염색된 것으로 관찰되었다 (Fig. 4C, D).
2) 16주령 성숙쥐에서 PRX Ⅲ 면역활성 변화
16주령 정상대조군의 척수 회색질에서 PrxⅢ 양성세포 수는 4주령 정상대조군에 비해 적게 발현되는 것으로 관찰 되었다(Fig. 4A, E).
6시간 동안 스트레스 받은 16주령 성숙쥐의 PrxⅢ의 면역 활성은 16주령 정상대조군에 비해 차이가 없었다(Fig. 4F).
3. 어린쥐와 성숙쥐에서의 PrxⅠ과 Ⅲ 면역활성 변화 차이 요약
PrxⅠ 양성세포수는 4주령 어린쥐와 16주령 성숙쥐에서 거의 같은 수준으로 발현하는 것으로 나타났고 6시간동안 스트레스 받았을 때는 어린쥐보다 성숙쥐에서 PrxⅠ 양성 세포수가 더 많이 증가하는 것으로 나타났다(Fig. 3).
PrxⅢ 양성세포수는 16주령 성숙쥐보다 4주령 어린쥐에 서 약 1.5배정도 많이 발현되는 것으로 나타났고 6시간 동
Fig. 4. Prx III immunoreactivities in the spinal cord after acute immobilization stress in young and adult rats. (A) Prx III-positive cells were observed in the gray matter (GM) of the spinal cord in young controls. (B) The number of Prx III-positive cells was increased in the GM of the spinal cord in stressed young rats compared with that in young controls. (C) Magnified photograph of rectangular area in Fig. 4A. Prx III immunoreactivity was found in neuron-like cells (arrows). (D) Magnified photograph of rec- tangular area in Fig. 4B. Prx III immuno reactivity was found in dendrite-like structure of the cells (empty arrow). (E) The number of Prx III-positive cells was lower in the GM in adult controls than young controls. (F) The number of Prx III-positive cells was not different in the GM between adult control and stressed rats. Scale bar: A B, 200 μ
m; C and D, 50 μm (WM, white matter)A B
C D
E F
안 스트레스를 받았을 때는 성숙쥐에서는 거의 변화가 없 었으나 어린쥐에서는 정상대조군에 비해 약 1.5배 정도 증 가되는 것으로 나타났다(Fig. 5).
또한 6시간동안 스트레스를 받았을 경우 성장한 쥐보다 어린 쥐에서 PrxⅢ 양성세포수가 약 2배 정도로 많이 발 현되는 것으로 나타났다.
Ⅳ. 고 찰
산화스트레스로 인하여 발생된 ROS 및 RNS는 우리몸 속에서 효소적, 비효소적인 방어체계에 의해 중성화되는 과정을 거치게 되는데 이런 과정속에서 superoxide dis- mutase (SOD), glutathion peroxidase, peroxire- doxin (PRX) 등이 항산화제로써 그 역할을 수행하게 된 다고 알려져 있다.
최근의 스트레스 관련 논문에 의하면 수컷 흰쥐에 6시간 동안 부동 스트레스를 주었을 때 적혈구에서 GST (glu- tathion-s-transferase),
SOD, catalase의 감소와 lipid peroxidation의 증가를 통해 산화 스트레스를 야기한다는 것이 밝혀졌고 항산화제 로써 비타민 A, E, C를 스트레스 전과 후에 경구 투입한 결과 산화 스트레스 후에는 항산화제는 감소하는 것으로 대부분 보고 되어 있다. 그렇지만 적혈구에서는 스트레스 를 준 다음 또는 주는 동안에 정상과 비교하여 SOD와 catalase가 급격하게 증가되었다는 보고도 있다.
반복 부동 스트레스는 수컷과 암컷의 척수에서 황산화제 활성을 감소시키고 lipid peroxidation은 큰 차이가 없다 고 보고된 바 있고, 수컷 흰쥐의 척수에서 ADP hydrol- ysis (ADPase 활성)를 감소시키고 5′-nucleotidase 활 성은 증가시켰다. 그러나 최근 주목 받고 있는 peroxire- doxins에 대해서는 스트레스 모델과 연관지어 중추신경계 에서 발현에 관하여 알려진 바가 거의 없는 상태이다.
위 실험에서 급성 부동 스트레스를 주었을 때 어린쥐와 성숙쥐에서 Prx Ⅰ과 Ⅲ를 면역조직화학염색법을 통해 그 발현 변화를 관찰한 결과, Prx Ⅰ 단백질은 척수 회색질 의 회소돌기아교세포로 추정되는 세포에서 발현되었고 PrxⅢ 단백질은 척수 회색질의 신경세포 세포질내에서 발 현되는 것으로 관찰되었다.(8)
Prx Ⅰ 양성세포는 어린쥐와 성숙쥐의 정상대조군에서 각 각 비슷한 수준으로 발현하였으며 스트레스를 받은 경우 어 린쥐보다 성숙쥐에서 더 많이 발현되는 것으로 관찰되었다.
PrxⅢ 양성세포는 정상대조군의 성숙쥐보다 어린쥐에서 약 1.5배정도 많이 발현되었고 스트레스를 받은 경우 성숙 쥐에서 큰 차이가 없는 반면 어린쥐에서는 약 1.5배 정도 증가하는 것으로 관찰되었다. 특히 스트레스를 받은 어린 쥐에서는 PrxⅢ 양성세포의 가지돌기로 여겨지는 신경섬
유에서 PrxⅢ 단백질이 정상에 비새 많이 발현되는 것이 관찰되었다. 최근에 산화적 스트레스로 야기되는 ROS와 RNS에 대한 각종 항산화제의 기능에 대한 연구가 활발히 진행되고 있다.(3) 하지만 항산화제로써 신호전달에도 관 여하는 peroxiredoxin에 대한 연구는 알려진 바가 많지 않다. 따라서 peroxiredoxin의 변화를 면역조직화학염색 방법으로 규명한 것은 세포의 산화적 스트레스에 대한 방 어 기전과 신호 전달체계를 설명하는데 기초적 자료가 될 것으로 본다.
1. Peroxiredoxin Ⅰ
PrxⅠ은 mouse macrophage에서 산화적 스트레스로 야기되는 23KDa의 단백질로 MSP23(macrophage 23 KDa stress protein)이라 처음 불려졌다.(26) 지금까지 밝혀진 바로는 신경계에서 산화적 스트레스에 의해 hydrogen peroxide를 감소시키는 항산화제로써의 기능이 있으며, cdc-2로 매개되어 인산화을 통해 세포분열주기의 과정에도 참여한다.(18) 또한 신호 전달체계의 조절자로써 thioredoxin perpxidase 활성도 갖고 있다.(19) 여러 다 른 논문에 의하면 PrxⅠ은 회소돌기아교세포의 핵에서 주 로 발현되는 것으로 보아서 본 실험에서 스트레스 후에 증 가된 PrxⅠ은 항산화제로써의 역할보다는 신호 전달체계 의 조절자로써 중요한 역할을 담당하고 있는 것으로 여겨 진다. 스트레스 받은 후 어린쥐보다 성숙쥐에서 더 많이 증가한 결과는 PrxⅠ이 높은 연령에서 보다 더 중요하게 작용하는 것으로 생각된다.
2. Peroxiredoxin Ⅲ
PrxⅢ는 1989년 Yamamoto et al 에 의해 분리되어 MER5로 처음 명명되었고(27) antioxidant protein- 1(AOP-1) 와 SP-22로 초기에 알려졌다.(28) peroxire- doxin family중에서 유일하게 사립체에만 존재하며 thiol 존재하에 hydrogen peroxide뿐만 아니라 peroxynitrite (ONOO-)를 제거할 수 있는 미토콘드리아 항산화제 단백 질로 알려진 바 있다.(15,30) PrxⅢ는 1997년에 신체구 조와 기관 발달과 분화에 관련된 전사요소의 superfamily 인 Homeobox gene으로서도 알려져 있다.(31) 또한 정 상보다 간암 같은 암조직에서 더 많이 발현하며,(32) 알츠 하이머 병이나 다운증후군 환자에서 적게 발현되는 것으로 보고된 바 있으며(27) H2O2존재하에 있는 미토콘드리아에 서 세포 자연사로가는 신호에 관여하는 매개물질과 함께 중요한 조절자로써 역할을 수행할 것으로 보고 된 바도 있 다.(33) 많은 논문을 통해 종합해보면 항산화제로써의 기 능이 주된 역할로 여겨지면 본 실험에서 보여준 결과도 스 트레스 받은 후 증가된 PrxⅢ는 항산화제로써의 중요한
역할을 할 것으로 생각된다.
성숙쥐보다 어린쥐에서의 높은 발현과 스트레스 받은 후 의 증가는 PrxⅠ과 같이 연령에 따라 발현의 정도가 다르 며 특히 완전히 성장하지 않은 어린쥐에서 PrxⅢ가 보다 중요한 역할을 하는 것으로 생각된다.
본 실험에서 6시간 스트레스 후의 PrxⅠ과 PrxⅢ는 상 당히 증가된 것으로 밝혀졌다. PrxⅠ의 경우 항산화제로 써의 기능보다 신호전달체계의 매개체로써 여겨지기 때문 에 스트레스 후의 증가기전은 잘 알 수 없다. 최근 논문에 의하면 부동 스트레스후의 항산화제는 대부분 증가되기보 다 감소되는 것으로 보고 되었기 때문이다. 비록 이전의 다른 연구에서는 반복 부동 스트레스에대한 결과인 반면 본 연구에서는 급성 부동 스트레스라는 차이는 분명히 있 지만 in vivo와 in vitro에서 ROS와 RNS의 증가에 대 한 항산화제의 감소는 여러 논문을 통해 이미 밝혀진 바 있어 앞으로의 연구에서 PrxⅢ가 반복 부동 스트레스에서 어떤 변화가 있는지 추가적인 실험이 필요할 것이다.
부동 스트레스 후 oxytocin과 vasopressin의 척수안에 서 발현이 경추, 흉추, 요추마디에서 각각 다르게 발현되 었다는 연구 결과가 있다.(34) 그렇다면 본 실험에서 Prx
Ⅰ과 Ⅲ의 증가한 결과는 같은 척수 내에서 부위에 따라 발현의 차이가 있을 수 있다는 가능성을 제시하고 있으며 앞으로 연구에서 척수 전체의 횡 절단면과 종 절단면에 대 한 Prx의 발현 변화 연구가 필요할 것이다.
Ⅴ. 결 론
PeroxiredoxinⅠ과 Ⅲ는 다양한 스트레스에 의한 방어 적 기전으로 매개되는 항산화 물질로써 잘 알려져 있으나 SOD (Superoxide dismutase), catalase, GPX (glu- tathione peroxidase)와 같은 다른 항산화물질들에 비해 잘 알려지지 않았으며 특히 부동 스트레스 모델과 같은 In vivo 실험에서는 거의 알려진 바가 없다. 본 연구에서는 산화적 스트레스를 야기할수 있는 부동 스트레스가 주어졌 을때 중추신경계의 신경아교세포와 신경세포에 대표적으로 발현하는 PrxⅠ과 Ⅲ가 척수 회색질에서 어떤 변화가 나 타나는지 알아보고자 하였다.
면역조직화학염색법을 실시한 결과 PrxⅠ은 척수의 희 소돌기아교세포로 추정되는 세포에 염색되어 스트레스 후 에 어린쥐와 성숙쥐에서 모두 증가하였으며 성숙쥐에서 더 많은 증가를 나타내었다. PrxⅢ는 척수의 신경세포의 세 포질에 관찰되었고 성숙쥐보다 어린쥐에서 많이 발현되었 으며 스트레스 후에는 어린쥐에서만 증가하였다.
본 연구 결과는 PrxⅠ과 Ⅲ가 산화적 스트레스를 야기 하는 부동 스트레스 모델의 초기단계에서 척수 회색질의 희소돌기아교세포와 신경세포에 중요한 인자로써 발현함을
제시해 준다.
REFERENCES