뇌척수액의 세포수 측정을 위한 자동요침사분석기 UF-100의 유용성 평가
이자영1․김재현1․신정환1,2․김혜란1․이정녀1,2
인제대학교 의과대학 부산백병원 진단검사의학교실1, 인제대학교 백인제기념 임상의학연구소2
Evaluation of Automated Flow Cytometric Analyzer Sysmex UF-100 for Cell Counting of Cerebrospinal Fluid
Ja Young Lee1, Jae Hyun Kim1, Jeong Hwan Shin1,2, Hye Ran Kim1, and Jeong Nyeo Lee1,2 Department of Laboratory Medicine1, Paik Institute for Clinical Research2,
Busan Paik Hospital, College of Medicine, Inje University, Busan, Korea
Background: The counting of erythrocyte and leukocyte in cerebrospinal fluid (CSF) is still performed microscopically, using a chamber in most laboratories. However, it is imprecise, has wide inter-observer variability, and is labor-intensive and time-consuming. This study was aimed to examine the possibility of using Sysmex UF-100 flow cytometry (Toa Medical Electronics, Japan) as a means of counting cells in CSF samples.
Methods: From May to September 2006, we obtained 115 routinely collected CSF samples from 90 patients. We compared the performance of the automated method of the UF-100 with the manual counting method using Neubauer chamber.
Results: Accuracy statistics for erythrocyte and leukocyte showed a high correlation between the UF-100 and the manual counting method, with correlation coefficients of r2=0.95 and 0.89, respectively. Linearity results demonstrated that the UF-100 method provides accurate results throughout the reportable ranges of erythrocyte and leukocytes. A high degree of inter-assay precision for the UF-100 method was seen. Five cases with high lymphocytes percentage showed falsely low value of leukocyte counts.
Conclusions: The flow cytometric analysis of CSF with the UF-100 offered a rapid and reliable erythrocyte and leukocyte count. UF-100 is expected to be useful for screening method in CSF cell counting. But the manual counting method is still needed for the samples with high leukocyte count or contaminated with peripheral bloods.
Key Words:Cerebrospinal fluid, UF-100, Urine flow cytometer, Chamber counting
교신저자:이정녀
우) 614-735 부산광역시 부산진구 개금동 633-165 인제대학교 의과대학 부산백병원 진단검사의학과 전화:051)890-6862, FAX:051)893-1562
E-mail:jeong418@medimail.co.kr
서 론
뇌수막염이나 뇌혈관질환, 종양 전이 등의 진단 및 경과 를 관찰하기 위해 시행되는 뇌척수액의 세포수 측정은 대부 분의 검사실에서 다른 체액들과 마찬가지로 Neubauer 혈 구계산판 등을 이용한 수기법으로 이루어지고 있다. 수기법
은 숙련된 기술과 시간을 요하는 작업으로 검사자 또는 검 체를 다루는 방법 등에 따라 결과에 많은 차이를 보이고 있 다[1-4]. 따라서 그 동안 기존의 혈액학 장비를 이용한 뇌 척수액의 세포 수 측정에 대한 연구들이 이루어져 왔으며 이들 장비의 결과는 수기법과 비교하였을 때 높은 상관성과 정확성을 보였다[5-9]. 그러나 혈액학 장비는 혈액내의 적 혈구, 백혈구, 혈소판 수 측정을 목적으로 개발되었기 때문 에 적은 수의 뇌척수액 세포를 측정하는 데는 적합하지 못 한 단점을 가지고 있다.
최근 뇨 검사를 위한 자동화기기인 자동요침사분석기 Sysmex UF-100 (Toa Medical Electronics, Kobe, Japan,
UF-100)가 도입되어 기존의 수기법에 비해 업무의 효율성 을 높이고 검사소요시간과 인력의 감소 효과를 보이고 있다 [10]. UF-100은 아르곤레이저를 이용한 유세포 분석기로서 일반 혈액학 장비에서 측정 가능한 적혈구, 백혈구뿐만 아 니라 상피세포, 원주, 세균도 정량적으로 측정할 수 있는 장 점을 가지고 있다[10-12].
이에 저자들은 소변과 비교적 물리적인 성상이 비슷하면 서도 검체 수집이 까다로운 뇌척수액에서 UF-100을 이용 하여 적혈구 및 백혈구 수를 측정한 후 기존의 수기법과 그 결과를 비교하여 보았으며 이를 통해 뇌척수액의 세포수 측 정에 있어 UF-100 장비의 이용가능성에 대해 알아보고자 본 연구를 시행하였다.
재료 및 방법 1. 대상
2006년 5월부터 9월까지 인제대학교 부산 백병원 진단 검사의학과에 뇌척수액 검사가 의뢰된 검체 중에서 비교적 검체량이 많았던 90명을 대상으로 하였다. 검체는 병실이나 외래에서 채집 즉시 검사실로 운반되었으며 분석 전까지 실 온에서 보관하였다. 검사는 4시간 이내에 이루어졌으며 수 기법을 시행한 다음 UF-100으로 분석을 실시하였다.
2. 방법 1) 수기법
Neubauer 혈구계산판을 이용하여 표준화된 지침서에 따라 뇌척수액의 적혈구와 백혈구 수를 측정하였다[13].
Neubauer 혈구계산판에서 분석하는 검체의 양은 1 µL로 저배율에서 적혈구와 백혈구의 전체 세포 수를 측정하고, 고배율에서 Türk 용액(1% gentian violet 1 mL + 빙초 산 3 mL + 증류수 100 mL)을 이용하여 백혈구를 감별 계산하였다. 백혈구 수가 20/µL 이상인 경우 뇌척수액을 Cytospin 2 (Shandon, ThermoElectron Corporation, Waltham, MA, USA)를 이용하여 1,000 g에서 6분간 원침하여 슬라이드를 제작하고 Wright-Giemsa 염색을 시 행하여 200개의 세포를 감별 계산하였다.
2) Sysmex UF-100
UF-100을 이용한 뇌척수액 분석은 소변 검체를 분석할 때와 같은 방법으로 실시하였다. 뇌척수액 검체 중 800 µL 를 흡입하여 그 중 400 µL를 취하여 희석액 1,160 µL와 염색시약 40 µL를 혼합하였다. 검사원리는 세포가 유속 (flow cell)을 통과하는 순간 전도도를 측정하고 유속을 통 과하면서 전방 산란광과 형광 정도, 전기저항을 측정한다.
결과는 정량검사인 세포수/µL로 표시되며 이를 환산하여 세포수/HPF (high power field), 세포수/LPF (low power field)로도 표시된다[11,12].
3. 평가 방법 1) 정밀도
백혈구의 정밀도 검사를 위해서 검체는 헤파린이 포함된 전혈을 이용하였다. Ficoll-Hypaque (1.077 g/L)를 이용 하여 세포를 원심분리하여 단핵세포를 모은 다음 UF-100 희석액인 0.15 mol/L NaCl 용액으로 희석한 뒤 농도가 각기 다른 세 검체를 만들어 UF-100에서 검체당 10번씩 반복 측정하여 평균, 표준편차 및 변이계수를 분석하였다.
적혈구는 당일 CBC 검체 중 백혈구 수가 100×109/L미만 인 검체를 UF-100 희석액으로 희석하여 적혈구 농도가 다 른 세 검체를 만들었다. 역시 UF-100에서 검체당 10번씩 반복 검사하여 평균, 표준편차 및 변이계수를 분석하였다.
2) 직선성
뇌척수액 검체 중 UF-100에서 측정한 적혈구 수가 1,000/µL 이상인 검체를 이용하여 1배, 2배, 4배, 8배, 16배, 32배, 64배 연속으로 희석하여 적혈구 수를 측정한 후 직선성을 확인하였다. 백혈구는 정밀도 검사에 이용했던 단핵세포 중 백혈구 수 500/µL 이상인 검체를 사용하여 적 혈구와 같은 방법으로 1배에서 64배까지 연속 희석하여 백 혈구 수를 측정하고 직선성을 확인하였다.
3) 상관성
뇌척수액 115 검체를 대상으로 UF-100과 수기법으로 적혈구와 백혈구 수를 측정하여 두 방법간에 적혈구와 백혈 구 수를 비교하였다.
결 과
1. 대상 환자의 임상적 특징
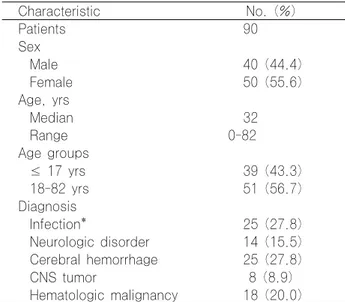
전체 115개의 뇌척수액 검체를 대상으로 하였으며 환자 수는 90명이었다. 대상 환자의 연령은 0∼82세 (median 32세)이며 남녀 비율은 0.8:1로 각각 40명과 50명이었다.
중추신경계 감염, 신경질환, 뇌출혈, 뇌종양 등이 주요 진 단명이었고 혈액종양도 20%를 차지하였다(Table 1).
2. 정밀도, 직선성 검정
정밀도는 각각 적혈구와 백혈구 수의 범위를 나눠 검체 당 10번씩 반복 측정하여 얻은 결과를 분석하였다. 적혈구 와 백혈구의 세포수가 정상범위인 경우 변이계수는 각각 12.22%와 30.55%로 나타났고 세포수가 11∼100/µL 범 위에 있을 때는 4.62%와 11.21%이었으며 101 ∼ 1,000 /µL 범위에 있을 때 2.2%와 4.83%의 변이계수를 보였다.
직선성 평가에서 적혈구는 28.5/µL에서 907.4/µL 범위에 서 직선성을 보였으며 회귀방정식은 y = 1.0064x + 5.0741 였고, r2은 0.9998 이었다. 백혈구는 5.1/µL에서 661.3/µL 범위에서 직선성을 보였고, 이때 회귀방정식은 y
= 0.9867x - 24.632 였고, r2은 0.9823 이었다(Fig. 1
Table 1. Demographic characteristics of the patients in CSF analysis
Characteristic No. (%)
Patients 90
Sex
Male 40 (44.4)
Female 50 (55.6)
Age, yrs
Median 32
Range 0-82
Age groups
≤ 17 yrs 39 (43.3)
18-82 yrs 51 (56.7)
Diagnosis
Infection* 25 (27.8)
Neurologic disorder 14 (15.5) Cerebral hemorrhage 25 (27.8)
CNS tumor 8 (8.9)
Hematologic malignancy 18 (20.0)
*This category means infections of the brain, spinal cord and meninges.
y = 1.0064x + 5.0741 R2 = 0.9998
0 200 400 600 800 1000
0 200 400 600 800 1000
Expected va lues (RBC/µL)
Measured values (RBC/µL)
Fig. 1. Linearity of RBC analysed by UF-100.
y = 0.9867x - 24.632 R2 = 0.9823
0 100 200 300 400 500 600 700
0 100 200 300 400 500 600 700
Expected va lues (WBC/µL)
Measured values (WBC/µL)
Fig. 2. Linearity of WBC analysed by UF-100.
& 2).
3. 검체 결과 분석
수기법에서 적혈구는 0 ∼ 2,450/µL, 백혈구는 0 ∼252 /µL의 분포를 보였다. UF-100에서 적혈구는 0.4∼
2,088.1/µL, 백혈구는 0 ∼ 264.1/µL로 측정되었다. UF- 100에서 측정된 적혈구, 백혈구 수 분포를 보면 적혈구는 중앙값이 15.6/µL (사분편차, 3.1∼59.1/µL)로 나타났고, 백혈구는 3.7/µL(사분편차, 1.6∼10.6/µL)로 나타났다 (Table 2).
4. 기존 방법과의 상관성 검정
수기법과 UF-100의 세포수 결과를 비교하였을 때 적혈 구 수 측정에서 r2=0.95의 상관성을 보였고, 백혈구 수 측
정의 경우 r2=0.89의 상관성을 보였다(Fig. 3 & 4).
고 찰
뇌척수액 검사는 제한된 검체량과 검체의 불안정성 등으 로 인해 빠른 검사가 요구되는 특징을 가지고 있다. 현재 대부분의 검사실에서 이루어지고 있는 수기법은 숙련된 기 술과 경험을 요하는 작업으로 검사자간의 방법과 결과의 정 확성에 차이를 보이고 있다[1-4]. 이로 인해 검사자간의 다 양성과 검사 시간을 줄일 수 있는 뇌척수액 검사의 자동화 에 대한 필요성이 대두되어 왔다. 이미 Cell Dyn (Abbott Laboratories, Santa Clara, CA, USA)[2, 6], H3 hematology analyzer (Bayer Healthcare, Fernwald, Germany)[8], ADVIA 120 (Bayer Corporation, Tarrytown, NY, USA)[5, 7, 9] 등의 혈액학 장비를 이용한 체액에서의 세 포분석에 대한 연구가 발표되었으며, 요침사 분석을 목적으 로 개발된 Sysmex UF-100 (Toa Medical Electronics) 장비를 이용하여 뇌척수액에서의 세포분석에 대한 연구[2, 14]도 이루어져 뇌척수액 검사에 있어 자동화 장비 활용의 가능성을 보여주었다.
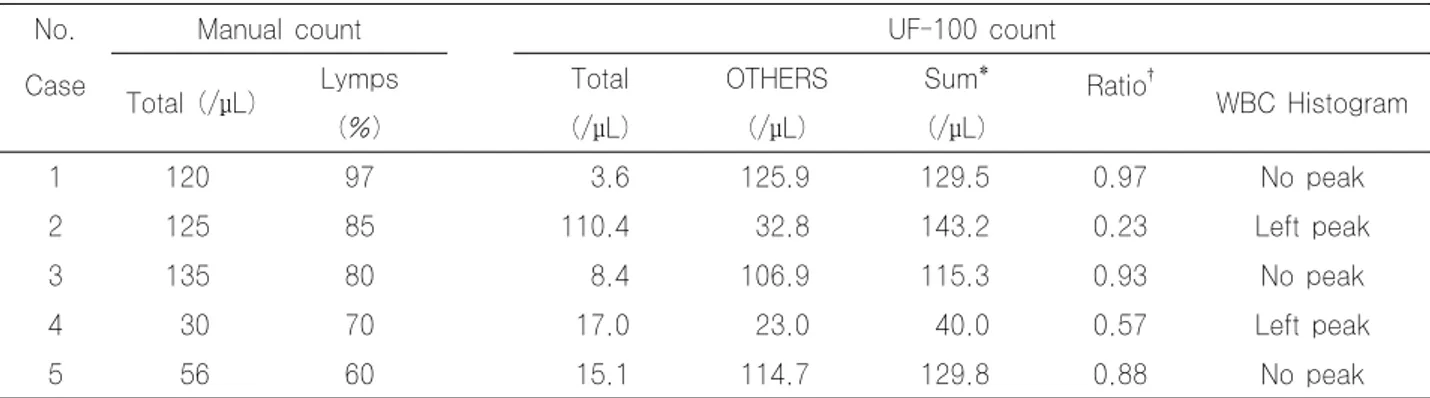
본 연구에서 Neubauer 혈구계산판을 이용한 수기법과 UF-100의 정확도 평가는 적혈구와 백혈구 수 측정에 있어 각각 높은 상관성(r2=0.95, 0.89)을 보였다. 수기법과 UF-100에서 측정한 세포수 분포를 살펴보면 제1~3사분 위수(percentile)에 속하는 적혈구, 백혈구 수는 두 방법간 에 큰 차이를 보이지 않는 것을 알 수 있다. 따라서 제1~3 사분위수에 속하는 대부분의 뇌척수액은 수기법 대신 UF-100을 이용하여 뇌척수액 검사가 가능할 것으로 생각 한다. 그러나 제3사분위수 이상의 세포수가 많은 검체의 경 우 수기법과 UF-100의 결과가 차이를 보였는데, 이는 세 포수가 많을 경우 수기법의 정확성이 떨어지기 때문이다 [14]. 이 중 5 검체는 수기법에 비해 UF-100에서 10/µL 에서 많게는 100/µL이상 백혈구 수가 낮은 결과를 보였는
Table 2. Distribution of manual and automated (UF-100) RBC, WBC counts (cells/uL)
Manual UF-100
Percentile RBC (/µL) WBC (/µL) RBC (/µL) WBC (/µL)
10 0 0 1.4 0.9
25 0 0 3.1 1.6
50 3.0 2.0 15.6 3.7
75 48.5 8.5 59.1 10.6
90 277.2 26.6 316.0 30.3
y = 0.8449x + 13.764 R2 = 0.9546
0 500 1000 1500 2000 2500
0 500 1000 1500 2000 2500 3000
Ma nua l count (RBC/µL)
UF-100(RBC/µL)
Fig. 3. Regression analysis between RBC counting by the UF-100 and manual method.
y = 1.0539x + 2.4476 R2 = 0.8948
0 50 100 150 200 250 300
0 50 100 150 200 250 300
Ma nua l count (WBC/µL)
UF100 (WBC/µL)
Fig. 4. Regression analysis between WBC counting by the UF-100 and manual method.
Table 3. Cases of the discrepancy of WBC count between UF-100 and manual method
No. Manual count UF-100 count
Case Total (/μL) Lymps Total OTHERS Sum* Ratio†
WBC Histogram
(%) (/μL) (/μL) (/μL)
1 120 97 3.6 125.9 129.5 0.97 No peak
2 125 85 110.4 32.8 143.2 0.23 Left peak
3 135 80 8.4 106.9 115.3 0.93 No peak
4 30 70 17.0 23.0 40.0 0.57 Left peak
5 56 60 15.1 114.7 129.8 0.88 No peak
* Total + OTHERS, †OTHERS/(OTHERS+WBC).
Abbreviation: Lymps, percentage of lymphocytes.
데 백혈구 감별계산에서 림프구의 비율이 60~97%로 높은 공통점을 가지고 있었다(Table 3). Ziebig 등[2]에 따르 면 뇌척수액에서 관찰되는 림프구의 경우 중성구와 다른 세 포 크기와 형태 때문에 UF-100에서 백혈구가 아닌 다른 세포(OTHERS)로 구분될 위험을 가지고 있으며 이로 인 해 뇌척수액의 백혈구 중 림프구가 높은 비율을 차지하는 검체의 경우 수기법에 비해 자동화 장비에서 측정한 뇌척수 액의 백혈구 수가 낮아질 수 있다고 한다. 5 검체 중 2 검
체는 UF-100에서 측정한 백혈구 수와 OTHERS로 구분 된 세포의 합이 수기법에서 측정된 백혈구 수와 거의 일치 하여 Ziebig 등[2]이 제시한 가설에 합당한 결과를 보였다.
Yamanishi 등[15]은 수기법에 비해 UF-100에서 세포수가 낮게 측정되는 뇌척수액에서 림프구가 많은 검체를 판별하는 새 로운 지수 OTHERS/(OTHERS+WBC)를 제시하였는데 OTHERS/(OTHERS+WBC)가 0.6 이상이면 림프구에 의한 세포수 불일치임을 나타낸다고 하였다. 본 연구에 적용시켜
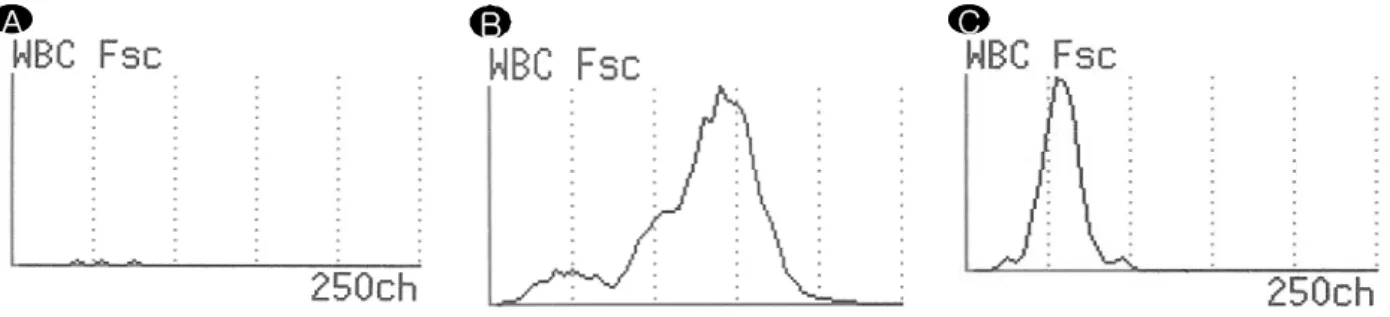
A A
B B
C C
Fig. 5. Histogram of the Fsc intensity of WBC in UF-100. (A) Normal histogram (WBC count: 0/μL) (B) Peak is detected on the right (differential counts: neutrophil 80%) (C) Peak is shift to the left (differential counts:
lymphocyte 85%). Abbreviation : Fsc, forward scatter signal.
보았을 때 3 검체는 0.6 이상으로 나타났으나 나머지 2 검 체는 0.6보다 낮게 나와 이 지수와 림프구 비율과의 상관성 은 낮은 것으로 나타났다. 이외에도 세포 크기에 따른 분포 를 나타내는 UF-100의 백혈구 전방산란도 분석 히스토그 램을 살펴보면 중성구가 다수를 차지하는 검체는 백혈구 분 포곡선이 오른쪽으로 치우쳐 나타난다. 그런데 5 검체 중 2 검체는 분포곡선이 왼쪽으로 치우쳐 나타나는 경향을 보여 중성구보다 크기가 작은 세포, 즉 림프구가 많음을 유추할 수 있었다(Fig. 5). 그러나 백혈구 전방산란도 분석 히스토 그램의 경우 림프구가 많은 검체 외에 SRC (Small Round Cell)이나 YLC (Yeast Like Cell)양성 신호가 뜬 검체도 백혈구 분포 곡선이 왼쪽으로 치우쳐 나타나는 것을 볼 수 있어 림프구 외의 세포들과의 감별 또한 필요하 겠다. 결국 이런 현상이 나타나는 이유는 UF-100이 소변 세포분석을 목적으로 하는 장비로 세포분석이 주로 중성구 에 초점을 맞추고 있기 때문이다. 따라서 UF-100을 이용 한 뇌척수액 검사시 적혈구, 백혈구 수 외의 다른 측정치 및 분석 히스토그램의 결과들도 반드시 확인해야 할 것이 다.
UF-100은 수기법에 비해 검체 요구량이 800 μL로 많아 결과의 정확성이 높다. 그러나 뇌척수액 검체의 특성상 검체 량이 적을 경우 정확한 결과를 얻지 못할 수 있고 재검을 하 기 힘든 한계점을 가지고 있다. 또한 채집과정에서 말초 혈 액이 오염된 검체는 적혈구 수가 너무 많아 정확한 백혈구 수를 측정할 수 없으며, 뇌실배액(ventricular drainage)에 서 채취된 검체에서 세균 등으로 인해 검체의 혼탁도가 높을 경우 전도도의 오류가 나타날 수 있다[14]. 본 연구에서도 19개의 검체가 말초 혈액의 오염으로 인한 전도도의 오류 혹은 총 세포수의 과다로 인한 재검오류를 보였다.
이상의 연구결과에서 UF-100을 이용한 뇌척수액의 세 포수 측정은 높은 검사내 정밀도와 직선성을 보였으며, 수 기법과 비교한 정확성 연구에서도 높은 상관성을 보였다.
따라서 제1~3사분위수에 속하는 대부분의 뇌척수액 검체 는 뇌척수액 검사시 UF-100의 이용이 가능하여 검사의 신 속성과 편리성이 보완되리라 생각된다. 그러나 제3사분위수
이상의 세포수가 측정되는 검체 및 재검 오류, 전도도의 오 류가 뜨는 검체는 수기법을 통한 재확인을 필요로 하며 림 프구가 다수를 차지하는 검체는 백혈구 수가 낮게 측정될 수 있으므로 UF-100을 이용한 뇌척수액 검사 시에는 반드 시 적혈구와 백혈구 수 외에 히스토그램 등의 다른 분석채 널 결과에 대한 확인이 필요하겠다.
요 약
배 경: 뇌척수액에서 세포수 측정은 대부분의 검사실에 서 현미경 시야에서 혈구계산판을 이용한 수기법으로 시행 하지만 검사자에 따라 결과에 많은 차이를 보일 수 있고 숙 련된 기술과 시간을 요하는 방법이므로 뇌척수액 세포수 측 정을 위한 전문화된 자동화 장비의 필요성이 대두되고 있 다. 뇨 검사를 위한 자동요침사분석기 Sysmex UF-100 (Toa Medical Electronics, Japan)을 이용하여 뇌척수 액 검체에서 세포수 측정의 가능성을 알아보고자 본 연구를 시행하였다.
방 법: 2006년 5월부터 9월까지 인제대학교 부산백병 원 진단검사의학과에 뇌척수액 세포 검사가 의뢰된 90명, 115 검체를 대상으로 UF-100을 이용하여 적혈구 및 백혈 구 세포수를 측정하여 Neubauer 혈구계산판을 이용한 수 기법의 결과와 비교하였다.
결 과: UF-100의 정밀도 평가에서 적혈구와 백혈구의 세포수가 정상범위인 경우 변이계수는 각각 12.22%와 30.55%로 나타났다. UF-100의 직선성 평가에서 적혈구 는 28.5/µL에서 907.4/µL 범위에서, 백혈구는 5.1/µL에 서 661.3/µL 범위에서 직선성을 보였다. 뇌척수액 검사의 수기법과 UF-100 정확도 평가에서 적혈구와 백혈구는 각 각 r2=0.95, 0.89의 높은 상관성을 보였다. 높은 림프구 를 함유한 5 검체에서는 UF-100 결과가 수기법보다 낮은 수치를 보였다.
결 론: UF-100을 이용한 뇌척수액 검사는 빠르고 믿을 만한 결과를 제공하므로 세포수 측정의 선별검사용으로 사 용할 수 있으리라 생각된다. 그러나 말초혈액에 오염된 검
체와 백혈구 수가 높은 검체는 수기법을 통한 백혈구 수 결 과의 재확인이 필요하다.
참 고 문 헌
1. Joseph AK and Carl RK. Cerebrospinal,synovial and serous body fluids. In: Richard AM MR, editor. Henry's clinical diagnosis and management by laboratory methods. 21 ed.
Philadelphia: WB Saunders, 2006:426-30.
2. Ziebig R, Lun A, Sinha P. Leukocyte counts in cerebrospinal fluid with the automated hematology analyzer CellDyn 3500 and the urine flow cytometer UF-100. Clin Chem 2000;46:242-7.
3. Rumke CL. The statistically expected variability in differen- tial leukocyte counting. In: Koepke JA, editor. Differential leukocyte counting. Skokie, IL: College of American Patho- logists, 1978.
4. Rumke CL. Imprecision of ratio-derived differential leuko- cyte counts. Blood Cells 1985;11:311-4, 5.
5. Aune MW, Becker JL, Brugnara C, Canfield W, Dorfman DM, Fiehn W, et al. Automated flow cytometric analysis of blood cells in cerebrospinal fluid: analytic performance. Am J Clin Pathol 2004;121:690-700.
6. Hoffmann JJ and Janssen WC. Automated counting of cells in cerebrospinal fluid using the CellDyn-4000 haematology analyser. Clin Chem Lab Med 2002;40:1168-73.
7. Mahieu S, Vertessen F, Van der Planken M. Evaluation of ADVIA 120 CSF assay (Bayer) vs. chamber counting of
cerebrospinal fluid specimens. Clin Lab Haematol 2004;26:
195-9.
8. Soogarun S, Sirimongkolsakul S, Wiwanitkit V, Siritantikorn A, Pimsane K, Srivijarn R. Leukocyte counts in cerebrospinal fluid with the automated hematology analyzer, Technicon H*3. Clin Lab 2002;48:623-9.
9. Strik H, Luthe H, Nagel I, Ehrlich B, Bahr M. Automated cerebrospinal fluid cytology: limitations and reasonable applications. Anal Quant Cytol Histol 2005;27:167-73.
10. 김동찬, 유영미, 조성석, 박준완, 윤여민, 김진규. 자동요 침사분석기 UF-100의 평가, 임상병리와 정도관리 2001;
23:299-306.
11. Ben-Ezra J, Bork L, McPherson RA. Evaluation of the Sysmex UF-100 automated urinalysis analyzer. Clin Chem 1998;44:92-5.
12. IUC Product Developmen Division TmecL. Performance of the Sysmex UF-100 Fully Automated Urine cell Analyzer.
Sysmex J Int 1996;6:36-40.
13. Pathologists CoA. Supplementary appendix, CSF and body fluid, from 1993 Surveys manual, section II; hematology, coagulation, clinical microscopy. Chicago: CAP Press.; 1993.
14. Van Acker JT, Delanghe JR, Langlois MR, Taes YE, De Buyzere ML, Verstraete AG. Automated flow cytometric analysis of cerebrospinal fluid. Clin Chem 2001;47:556-60.
15. Yamanishi H, Imai N, Ohmine T, Nishiyama M, Suehisa E, Kanakura Y, et al. Urine flow cytometer quantification of leukocytes in samples containing a large proportion of lymphocytes. Clin Biochem 2006;39:857-9.