Volume 6, Number 2, October, 2003
Epidermal Growth Factor(EGF)가 개의 손상된 슬관절 전방십자인대의 치유에 미치는 영향
가톨릭대학교 성모병원 정형외과
김용식・정도현・정진화・우영균・임영욱・이화성・권순용
= Abstract =
The Effect of the Epidermal Growth Factor(EGF) on the Healing of the Injured Anterior Cruciate
Ligament of the Knee in Dog: in Vivo Study
Yong-Sik Kim, M.D., Do-Hyun Chung, M.D., Jin-Wha Chung, M.D., Young-Kyun Woo, M.D., Young-Wook Lim, M.D., Hwa-Sung Lee, M.D., Soon-Yong Kwon, M.D.
Department of Orthopedic Surgery, St. Mary’s Hospital, The Catholic University of Korea
Purpose: The purpose of this study is to find out the possibilities of the new treatment via continuous stimu- lation by photo-immobilization of growth factor in the anterior cruciate ligament(ACL) injury.
Materials and Methods: Photo-reactive epidermal growth factor(EGF-Az) synthesized by conjugating EGF with N-(4-azidobenzoyloxy)succinimide was immobilized onto biodegradable tissue-regenerative mesh(Bio- MeshⓇ) using UV irradiation. We sutured the BioMesh containing photo-reactive EGF on the artificial defect area of ACL in the left knee of beagle dogs and sutured the BioMesh that was not treated with EGF-Az on the defect area of ACL in the right knee. Four weeks later, we obtained the tissues from the defect area of both ACLs and compared the results of HE stain, immunohistochemistry and RT-PCR in both tissues.
Results: In results of HE stain and immunohistochemistry, we observed better cellular proliferation and more definite spindle shape of cells in EGF-immobilized area than in non-EGF defect area. Also cellular density was higher in EGF-immobilized area. On the other hand, cells had shaped more round and cellular density was lower in non-EGF defect area.
In results of RT-PCR of GAPDH(Glyceraldehyde-3-phosphate dehydrogenase), COL I(Collagen type I), COL III and EGF, except for TGF-β1(Transforming growth factor-beta 1), we also observed more definite expressions in EGF-immobilized area than in non-EGF defect area.
※ 통신저자: 권 순 용
서울시 영등포구 여의도동 6 2번지 가톨릭대학교 성모병원 정형외과학교실
TEL: 02) 3779-1192 FAX: 02) 783-0252 E-mail: cmcos@catholic.ac.kr
✽ 본 논문은 한국학술진흥재단 2 0 0 1년도 협동연구지원 (과제번호 2 0 0 1 - 0 4 2 - F 0 0 0 7 9 )에 의하여 연구되었음.
서 론
슬관절의 전방십자인대는 자연 치유 능력이 극 히 저조하여, 파열시 일차 봉합술을 시행해도 결 과가 나쁜 것으로 보고되고 있는데5 ), 이는 관절 외에 위치하여 창상 치유가 잘되는 내측측부인대 와는 달리 전방십자인대는 관절 내에 위치하여 창 상 치유 기전에 중요한 섬유소원인 혈종 형성이 관절액에 의해 희석되며, 생화학적 성분 및 생역 학적 차이, 활액막의 영향, 혈액 순환 등 여러 원 인 때문인 것으로 알려져 있다1 , 2 , 2 2 ). 그러므로 전 방 십자인대 파열 시에는 석고고정이나 봉합술 보 다는 슬개건이나 동종 이식건 등을 이용한 재건술 이 일반적인 치료법으로 시행되어 왔다. 그러나 이러한 수술방법은 술 후 재활과정 등에 따라 결 과의 차이를 보이며, 다시 불안정성이 초래되어 재수술을 요하게 되는 경우도 있다1 0 , 2 1 ).
최근에 세포 성장인자에 대한 연구가 활발히 진 행되면서, 세포증식을 통해 수상 초기에 손상된 인대의 치유를 도모하고자 슬관절 인대와 세포 성 장인자의 관련성에 관한 연구들이 시도되었는데
4 , 7 , 1 2 , 2 4 , 2 6 )
, 대부분의 방법은 세포 성장인자를 환부 에 직접 투여함으로써 일부만 작용하고 나머지는 순환계를 통해 흡수되는, 약제 효용성 측면에서의 문제가 있어왔다.
저자들은 광고정된 E G F가 슬관절 전방십자인 대 세포 증식에 미치는 영향에 대한 연구를 통해 세포 단계에서의 효과를 입증1 4 )한 바 있으며, 이 에 근거하여 본 논문에서는 인위적으로 만들어진 개의 전방십자인대 부분결손 부위에, 광고정 과정 을 통해 인위적인 결합형 분비를 유발시켜 지속적 인 자극을 나타내도록 합성된 E G F를 투여함으로 써, EGF가 전방십자인대의 섬유모세포증식에 미 치는 영향을 파악하여, 전방십자인대 파열을 치료 할 수 있는 새로운 방법을 찾고자 하였다.
대상 및 방법
1. 광반응성 N - ( 4 - a z i d o b e n z o y l o x y ) s u c c i n- i m i d e와 광반응성 E G F의 합성
권 등의 연구1 4 )에서와 같은 방법으로 광반응성 물질인 4-azidobenzoic acid(9.57 g, 58.7 m m o l )와 N-hydroxy-succinimide(7.43 g, 64.6 mmol)를 4℃에서 t e t r a h y d r o f u r a n (THF) 150 ml에 완전히 용해시킨 후, dicyclo- hexylcarbodiimide(DCC, 13.3 g, 64.6 m m o l )를 용해시킨 THF 30 ml와 교반하면서 3 시간동안 반응시킨 후, 연속하여 2 5℃에서 1 2시 간동안 반응시켰다. 생성된 흰색 침전물을 여과하 여 제거하고, 얻어진 갈색 액체를 건조시켜 용매 인 T H F를 제거한 후, THF: isopropyl alcohol:
diisopropyl ether를 1 : 1 : 0 . 3의 비율로 혼합한 액체를 첨가하여 녹인 다음 재결정을 시행하였다.
얻어진 연갈색 분말은 진공 건조시키고, 남은 용 액은 T H F를 제외한 isopropyl alcohol과 d i i s o- propyl ether만을 이용하여 다시 재결정을 시행 하여 광반응성 N - ( 4 - a z i d o b e n z o y l o x y ) s u c c i n- i m i d e ( A z - N H S )를 합성하였고(Fig. 1), Pro- ton 핵 자기 공명 분광법(1H - N M R )과 자외선 분 광법(UV/VIS spectrometer)을 이용하여 확인 하였는데, 약 7.4 ppm과 8.1 ppm에서 4 - a z i- dobenzoic acid의 벤젠환에서 유래한 피크가 관 찰되었고 또한 약 3.3 ppm에서 s u c c i n i m i d e의 hetero cycle에서 유래한 피크가 관찰되었다. 자 외선 분광법에 의해 얻어진 s p e c t r u m으로, 280 nm 부근에서 a z i d o p h e n y l기의 벤젠 유래의 피 크를 관찰함으로써 광반응성 N - ( 4 - a z i d o b e n z o y- l o x y ) s u c c i n i m i d e가 합성되었음을 확인하였다.
EGF(Human, M.W. 6 kD) 0.2 mg을 p h - osphate-buffered saline(PBS) 0.4 ml에 용해 시키고, Az-NHS는 N, N-dimethylfor-
대한정형외과연구학회지 제 6 권 제 2 호 2 0 0 3년
Conclusion: We were able to confirm rapid cellular proliferation via artificial stimulation effect induced by photo-immobilized EGF. If EGF is immobilized onto biodegradable materials for clinical application, it will contribute to the treatment of ACL injury.
Key Words: Knee, Anterior cruciate ligament, Photo-immobilized EGF
mamide(DMF) 1.6 ml에 용해시켰다. 이들 두 종류의 용액을 얼음물에서 혼합하여 4℃에서 7 2 시간동안 차광상태로 교반하면서 반응시키고, 진 공 오븐에서 2 5℃ 상태로 건조하여 용매를 완전 히 제거한 다음, 남은 백색 분말에 PBS 3.6 ml 와 증류수 0.4 ml를 첨가하여 광반응성 E G F ( E G F - A z )를 추출하였다(Fig. 2).
2. 광반응성 E G F의 광고정 ( p h o t o - i m m o b i- lization) 과 확인
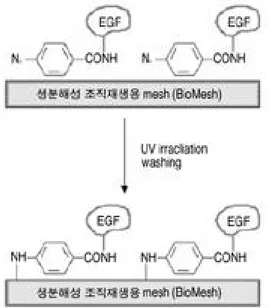
합성한 E G F - A z를 PBS buffer에 용해하여 일정 농도(1.0 μg / m l )의 용액을 제조한 후, 생분 해성 조직재생용 m e s h ( B i o M e s hⓇ)에 도포하고 차광 상태에서 1 2시간동안 건조시킨 후 3 0 0 ~ 3 5 0 n m의 자외선을 3 0초간 조사하여 광고정시켰다 (Fig. 3).
광고정된 E G F가 BioMesh 표면에 고정되어 있는지 여부를 확인하기 위하여 EGF 항체를 이 용한 면역염색법을 시행하였다. EGF를 고정시킨
B i o M e s h에 0.02% NaN3, 3% bovine serum a l b u m i n ( B S A )을 포함하는 PBS 1 ml를 넣고, 4℃에서 2 4시간 반응시켰다. PBS로 수차례 세척 한 후, 2 μg / m l의 anti-EGF antibody를 포함 하는 PBS(0.02% NaN3, 3% BSA) 용액을 다 시 넣고, 4℃에서 1 2시간 반응시켰다. 12시간 후 PBS(0.02% NaN3)를 이용하여 다시 세척하고, 2 μg / m l의 FITC-conjugated anti-human IgG antibody를 포함하는 PBS(0.02% NaN3) Fig. 1. Synthetic scheme of N-(azidobenzoyloxy)succin-
imide (Az-NHS)
Fig. 2. Synthetic scheme of photo-reactive epidermal growth factor(EGF-Az)
Fig. 3. Preparative scheme of photo-immobilized EGF.
용액을 첨가한 후, 4℃에서 1 2시간 반응시켰다.
모든 반응이 종료된 후에 P B S로 세척하고 다시 탈이온수로 수차례 세척한 다음, inverted fluo- rescence microscope으로 F I T C의 발광 상태를 관찰하였다. 그 결과 BioMesh 표면에 E G F가 고정되어 초록색으로 발광하는 것을 확인할 수 있 었다(Fig. 4).
3. 동물 실험
평균 몸무게 12 kg의 개(beagle) 5마리가 실 험에 사용되었으며, 실험기간 동안 일반적 개사료 로 사육되었다. 실험에 사용된 개는 평균 1 4개월 된 성견으로서 실험 전 특별한 기왕력은 없었다.
실험 개에게 50~75 mg/kg의 k e t a m i n e과 20 mg/kg의 sylazine hydrochloride(rompun
; muscle relaxant)를 근육 주사하여 전신 마취 시킨 후, 무균적으로 양측 슬관절의 정중앙 피부 절개와 medial parapatellar approach로 전방 십자인대를 노출시켰다. 전방십자인대의 내측 면 을 substance 중앙부에서 길이는 10 mm, 너비 는 전체두께의 절반이 되도록 수술 칼을 이용하여 절제하였다. 조심스런 지혈 후 좌측 전방십자인대 결손부는 광고정된 EGF (photo-immobilized epidermal growth factor)(SIGMA, E 2520) 가 처리되어있는 B i o M e s h로 감싼 후 D e x o n (absorbable suture material)으로 봉합하였 고, 우측 슬관절은 E G F를 처리하지 않은 B i o- M e s h로 봉합하였다. 5마리 실험 개 모두에서 시 술 4주 후에 좌우측의 전방십자인대를 얻었고 전 방십자인대 결손부에서의 섬유모세포 증식을 확인 하기 위하여 HE 염색법과 면역염색법( i m m u n o- histochemistry) 및 R T - P C R을 시행하였다.
4. 면역염색법 ( i m m u n o h i s t o c h e m i s t r y )
EGF antibody가 처리된 섬유모세포가 갈색으 로 발현되는 것으로써 증식을 확인할 수 있는 면 역염색법을 시행하였는데, Paraffin block으로 만들어 놓았던 전방십자인대 조직을 x y l e n에 5분 씩 3회 처리하고, 순차적으로 100, 90, 80, 70%
a l c o h o l로 처리한 후, dextrose water로 5분간
세척하여 p a r a f f i n을 제거하였다. citrate buffer(10 mM pH6.0)에 조직을 담그고 1 0분 간 끓인 후, 20분간 실온에서 냉각시켰다. dex- trose water로 세척한 후 0.3% H2O2에 1 5분간 두었다. DNA buffer 1X로 5분간 3회 세척하 고, serum blocking solution에 2 0분간 처리한 후, primary antibody(EGF / 1:50 or 1:100 or 1:200사용)를 실온에서 2 0분간 처리하였다.
DNA buffer 1X로 다시 5분간 3회 세척한 후, biotinylated second antibody를 2 0분간 처리 하고 DNA buffer 1X로 5분간 3회 세척하였다.
enzyme conjugate로 2 0분간 처리하고, DNA buffer 1X로 5분간 3회 세척 후, DAB chro- m o g e n을 조직에 떨구어 약 1 ~ 3분 발색시켰다.
흐르는 물에 3분간 세척하고 H e m a t o x i l i n에 1분 간 처리한 후, 다시 흐르는 물에 5분간 세척하였고, 현미경 하에서 갈색으로 발현되는지를 관찰하였다.
5. RT-PCR (Reverse transcription-poly- merase chain reaction)
1) RNA preparation
동결 조직 80~120 mg을 액화 질소를 조금씩 첨가하면서 잘게 부수었다. TRIzol reagent를 이용하는 방법을 사용하였는데, 조직과 함께 t r i- zol 1 ml를 1.5 ml microcentrifuge tube에
대한정형외과연구학회지 제 6 권 제 2 호 2 0 0 3년
Fig. 4. Micrograph of immuno-fluorescence staining of the photo-immobilized EGF with anti-EGF anti- body show green-colored luminescence.
넣고, isopropanol 반응단계에서 생긴 R N A p e l l e t을 RNA purification을 보기위하여 1 : 5 0 으로 희석하여 260~280 nm의 s p e c t r o p h o- t o m e t e r로 쟀다. PCR을 하기위해서 RNA 총 1~2 μg을 이용하여 c D N A를 만들어 사용하였다.
2) 1st strand cDNA 합성
10X reaction buffer 2 ㎕, 25mM MgCl2 4
㎕, dNTP 2 ㎕, random primer p(dN)6 2
㎕, RNase inhibitor (50U/ul) 1 ㎕, AMV reverse transcriptase 0.8 ㎕를 sterile water 및 RNA sample과 혼합하여 m i c r o c e n t r i f u g e t u b e에서 잘 섞어 원심분리한 후, 25 ℃에서 1 0 분간 반응시키고 다시 42 ℃에서 1 0분간 반응시 켰다. 다시 AMV RT를 99 ℃에서 5분간 반응시 키고 4℃에서 5분간 냉각시켰다.
3) PCR
c D N A로 만들어진 sample 1 μg과 각각의 primer (sense와 antisense primer) 1 μg씩을 dextrose water 17 μg과 섞어서 총 20 μg이 되 게 한 후 원심분리를 하고 나서 각 조건에 맞는 PCR cycle을 시행하였다. 해당 P r i m e r를 이용 하여 GAPDH (Glyceraldehyde-3-phosph
ate dehydrogenase), EGF, COL I (Colla- gen type I), COL III, TGF-β1 (Transform-
ing growth factor-beta 1)의 발현을 확인하였 는데(Table), 여러 문헌에서 이미 전방십자인대 손상 후 초기 치유 단계에서 GAPDH, COL I, COL III 및 T G F -β1 등이 증식 조직내에서 관찰 됨이 증명되어 있으며1 1 , 1 3 , 1 5 , 1 9 ), EGF를 p r i m e r로 사용한 것은 저자들이 첨가한 E G F가 증식된 조 직 내에서의 새로운 EGF 발현을 촉진하는지 여 부를 확인하기 위한 것이었고, GAPDH를 사용 한 것은 증식 조직내에서 GAPDH 자체의 발현 을 보기 위한 것이었다. 그 다음, PCR 생성물 5 μg을 덜어서 1.5% Agarose gel에 섞어서 3 0분 간 1 0 0 V에서 전기영동하여 확인하였다.
결 과
5마리의 실험 개로부터 시술 4주 후 얻은 전방 십자인대 결손부 조직에 대하여 광고정된 E G F 투여부와 EGF 비투여부를 육안적 소견 및 H E 염색법, 면역염색법과 R T - P C R을 시행하여 비교 분석하였다.
1. 육안적 소견
시술 4주 후 얻은 전방십자인대에서 초기 결손 부에 해당하는 부위는 EGF 투여부와 EGF 비투 여부 모두에서 봉합하였던 B i o M e s h의 형태는 남 Table. Reverse transcription - polymerase chain reaction(RT-PCR) primer
Primer Size(bp) Sense
Antisense
GAPDH 199 AAC AGC CTC AAG ATC ATC AGC
GGA TGA TGT TCT GGA GAG CC
EGF 415 TAT GTC TGC CGG TGC TCA GAA
AGC GTG GCG CAG TTC CCA CCA
COL I 689 ATG TTC AGC TTT GTG GAC CT
TCC CCA TCA TCT CCA TTC TT
COL III 869 AAC CGT CTC AGT GGA GAA CG
CCA CTC TTG AGT TCA GGA TGG
TGF-β1 266 CCG CAA GGA CCT CGG CTG GAA
GAT CAT GTT GGA CAG CTG CTC
아있지 않았고, 섬유조직으로 대치되어 있었으나, EGF 비투여부는 결손전 두께보다는 얇은 상태였 고, EGF 투여부는 결손전과 유사한 두께 내지는 조금 증가된 소견을 보이고 있었다. 그러나 색깔 이나 일부 주위 조직과의 약간의 유착 소견은 차 이가 없었다.
2. HE 염색법 및 면역염색법
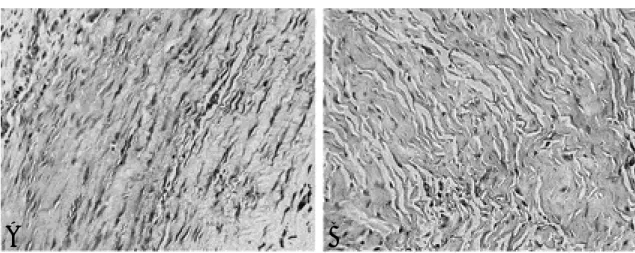
시술 4주 후 얻은 전방십자인대 조직에 대한 HE 염색법 결과, EGF 투여부에서 EGF 비투여 부에 비해 세포들의 증식 소견을 좀 더 관찰할 수 있었으며, 세포 밀도도 더 높은 것을 관찰할 수 있었고(Fig. 5A-B), 함께 시행한 면역염색법에 서도 유사한 결과를 보였는데, EGF 투여부에서 EGF 비투여부에 비해 세포들의 증식 소견을 좀 더 관찰할 수 있었고, 이것은 증식된 세포의 세포 질이 EGF antibody가 부착되어 갈색으로 발현 되는 것으로서 확인할 수 있었다. 세포들의 모양 도 투여부에서 좀 더 뚜렷한 방추상을 보이면서 세포 밀도도 높았다(Fig. 6A-B). 반면, EGF 비 투여부의 세포들은 갈색으로의 발현도 현저히 낮 았으며, 비교적 투여부에 비해 세포 밀도가 낮으 며 세포 모양도 원형에 가까운 형상을 보였다 (Fig. 6C-D).
3. RT-PCR
GAPDH, EGF, COL I, COL III, TGF-β1 중에서 T G F -β1을 제외한 네가지 모두에서 E G F 투여부(우측)에서의 발현이 좀 더 뚜렷한 것을 관 찰할 수 있었다(Fig. 7).
고 찰
현재까지 다양한 세포성장인자가 발견되고 있으 며 이러한 세포성장인자를 이용하여 손상된 인대 및 건 조직의 재생 및 치유의 속도를 높이고, 해 부학적 복원을 도모하며 또한 임상적 치료기간을
대한정형외과연구학회지 제 6 권 제 2 호 2 0 0 3년
A B
Fig. 5. Microphotographs of HE stain of (A) EGF-immobilized area and (B) non-EGF defect area(×200) also show better cellular proliferation in EGF-immobilized area.
Fig. 7. Photograph of RT-PCR (from left to right, GAPDH, COL I, COL III, EGF, TGF-β1) shows, except for TGF-β1, more definite expressions in EGF -immobilized area than in non-EGF defect area. In each pair, left is non-EGF defect area and right is EGF-immobilized area.
단축시킬 수 있는 방법들이 시도되고 있다1 7 , 2 0 ). 슬 관절의 인대에 대해서도 많은 연구가 이루어졌는 데, 전방십자인대에서는 collagen type I mes- senger RNA의 발현과 DNA 합성률이 낮게 나 타나고, 세포들이 분산되는 양상으로 보이며, 스 트레스 섬유(stress fiber)와 관련이 있는 a c t i n 양이 더 많이 검출되기 때문에 자연 치유 능력 저 하가 나타난다고 알려져 있으며, 또한 치유 과정 중 발현되는 세포성장인자에 있어서도 내측측부인 대의 경우는 손상부위와 그 주변으로 광범위하게 basic fibroblast growth factor(b-FGF), transforming growth factor-β( T G F -β) ,
platelet-derived growth factor(PDGF) 등이 발현되나, 전방십자인대의 경우에는 이러한 인자 들이 손상 부위 근처에서만 발현된다는 것이 밝혀 져 있어서1 6 , 1 8 , 2 5 ), 이것으로서 전방십자인대의 자연 치유 능력 저하를 설명하고 있다. 전방십자인대 및 내측측부인대에서 추출한 섬유모세포를 PDGF, TGF-β1, b-FGF, EGF 등의 여러 세 포성장인자를 이용하여 증식을 유도한 결과, 뚜렷 한 세포의 증식과 교원질의 생성을 증가시켰으며
4 , 2 4 ), b-FGF를 이용한 동물실험에서도 수상 초기
에 결손부로 신생 혈관이 증식되어 치유가 촉진되
었다1 2 )는 것이 보고되고 있다.
Fig. 6. Microphotographs of immunohistochemistry of (A - B) EGF-immobilized area and (C - D) non-EGF defect a r e a (×200) (A - B) Microphotographs show better cellular proliferation, more cytoplasmic expression as brown color by tagging of EGF antibody, more definite spindle shape of cells and higher cellular density in EGF-immobilized area than in non-EGF defect area. (C-D) On the other hand, cells had shaped more round and cellular density was lower and also cytoplasmic expression was less in non-EGF defect area.
A B
D
C
일반적으로 세포성장인자들은 내분비( e n d o c - rine), 방계분비(paracrine), 자가분비( a u t o c r i n e ) 기전을 통해 표적세포의 세포막에 있는 수용체와 결합하여 세포내로 내재화( i n t e r n a l i z a t i o n )가 일어난 후, 세포 내 신호 전달 경로에 의해 정보 가 전달되어 유전자 발현을 제어하고, 세포의 증 식이나 분화, 분비 등 다양한 세포 기능을 조절하 며 분해되어 소멸한다6 ). 따라서 인체 내 손상된 조직의 치유를 위한 적용 시 외부로부터 인위적으 로 계속 주입이 되지 않는 한 작용발현에 한계가 있으며, 이러한 문제점들을 해결하기 위한 연구가 진행되었다. 세포성장인자들 중 E G F는 기존의 알려진 작용기전과 달리 표적세포의 세포막에서 수용체와 결합된 상태로 세포의 기능을 조절하는 결합형 분비(juxtacrine stimulation)기전을 보 인다는 사실이 보고되었고8 ), 세포성장인자를 고분 자 표면에 고정시켜 세포증식을 한 결과, 고정된 인자는 세포 내로 내재화되지 않고 정보 전달 단 백질을 통해 자극을 세포내로 전달하며, 내재화에 따른 하류조절( d o w n - r e g u l a t i o n )이 초래되지 않 아 고정된 세포성장인자의 소모 없이 용해상태에 서 작용하는 경우보다 장기간에 걸쳐 작용이 지속 되는 것으로 밝혀졌다3 , 9 , 2 3 ).
저자들의 연구에서도 상기와 같은 원리를 이용 하여, 생분해성 조직재생용 mesh (BioMeshⓇ)에 E G F를 자외선을 이용하여 광고정하고 이를 개의 생체내의 전방십자인대 결손부에 고정시켜 지속적 인 자극을 줄 수 있도록 하였으며, 역시 E G F를 고정시킨 결손부에서의 세포성장이 EGF 비투여 부에 비해 유의하게 증가하는 것을 면역염색법 및 RT - P C R을 통해 관찰할 수 있었다. 이 결과로 생 체내에서의 E G F의 효과를 일부 증명할 수 있었으 며, 생체에 대한 임상적 적용의 가능성을 발견할 수 있었다. 향후 상기 E G F의 생체내에서 전방십 자인대에 대한 치유효과에 대하여 생역학적 연구를 포함한 더 많은 분석이 필요할 것으로 사료된다.
결 론
전방십자인대 손상에 대한 광고정 E G F의 세포 증식 효과를 동물실험을 통한 비교 분석으로 확인 할 수 있었으며, 비록 사용한 방법이 모두 정량적
분석이 아니고, n 수가 너무 작은 연구의 제한점 들이 있었지만, 본 실험결과에서 얻어진 소견에 의거하여 결합형 분비기전을 이용한 세포 성장인 자들에 의한 세포 증식 효과를 인체에 적용할 수 있는 가능성을 제시한 것으로 사료된다. 향후 이 와 연관된 향상된 방법들이 연구된다면, 세포 성 장인자들의 기질이 인체 내에서 완전 흡수 및 분 해에 따라 효과의 감소 없이 세포학적 영향이 지 속되는 기전으로 골 연부 조직 및 기타 인체의 기 관에 대한 치유에 기여할 것으로 기대된다.
R E F E R E N C E S
01) Amiel D, Ishizue KK, Harwood FL, Kita- bayashi L and Akeson WH: Injury of the ante- rior cruciate ligament. The role of collagenase in ligament degeneration. J Orthop Res, 7:486-493, 1989.
02) Arnoczky SP, Rubin RM and Marshall JL : Microvasculature of the cruciate ligaments and its response to injury. J Bone Joint Surg, 61- A:1221-1229, 1979.
03) Chen G, Ito Y and Imanishi Y: Photo-immobi- lization of epidermal growth factor enhances its mitogenic effect by artificial juxtacrine signaling.
Biochimica et Biophysica Acta, 1358:200-208, 1997.
04) DesRosiers EA, Yahia L and Rivard CH: Pro- liferative and matrix synthesis response of canine anterior cruciate ligament fibroblasts submitted to combined growth factors. J Orthop Res, 14:200-208, 1996.
05) Feagin JA and Curl WW: Isolated tears of ante- rior cruciate ligament. 5 year follow-up study.
Am J Sports Med, 4:95-100, 1976.
06) Goldsby RA, Kindt TJ and Osborne BA : Cytokines. In Kuby immunology. New York:
WH Freeman and Company, 303-327, 1999.
07) Hannafin JA, Attia ET, Warren RF and Bhargava MM: Characterization of chemotactic migration and growth kinetics of canine knee lig - ament fibroblasts. J Orthop Res, 17:398-404, 1999.
대한정형외과연구학회지 제 6 권 제 2 호 2 0 0 3년
08) Higashiyama S, Iwamoto R, Goishi K et al.:
The membrane protein CD9/DRAP 27 potenti- ates the juxtacrine growth factor activity of the membrane-anchored heparin-binding EGF-like growth factor. J Cell Biol, 128:929-938, 1995.
09) Ito Y, Zheng J, Imanishi Y, Yonezawa K and Kasuga M: Protein-free cell culture on an artifi- cial substrate with covalently immobilized insulin. Cell Biology, 93:3598-3601, 1996.
10) Jaureguito JW and Paulos LE: Why grafts fail.
Clin Orthop, 325:25-41, 1996.
11) Kim SG, Akaike T, Sasagawa T, Atomi Y and Kurosawa H : Gene expression of type I and type III collagen by mechanical stretch in anteri- or cruciate ligament cells. Cell Structure And Function, 27:139-144, 2002.
12) Kobayashi D, Kurosaka M, Yoshiya S and Mizuno K: Effect of basic fibroblast growth fac- tor on the healing of defects in the canine anteri- or cruciate ligament. Knee Surg Sports Trauma- tol Arthrosc, 5:189-194, 1997.
13) Kuroda R, Kurosaka M, Yoshiya S and Mizuno K: Localization of growth factors in the reconstructed anterior cruciate ligament:
immunohistological study in dogs. Knee Surg Sports Traumatol Arthrosc, 8:120-126, 2000.
14) Kwon SY, Woo YK, Lee HS, Chung JH, Lee WH and Park YS : The effect of the photo- immobilized epidermal growth factor on the pro- liferation of the anterior cruciate ligament cell of the knee. J of Korean Orthopaedic Research Society, vol 5, No 2 :100-109, October, 2002.
15) Lee J, Chamberlin TA, Schreck PJ and Amiel D: In situ localization of growth factors during the early healing of knee ligaments. Trans Orthop Res Soc, 41:158, 1995.
16) Lee J, Harwood FL, Akeson WH and Amiel D: Growth factor expression in healing rabbit medial collateral and anterior cruciate ligaments.
Iowa Orthop J, 18:19-25, 1998.
17) Leston AK and Dahners EK : Influence of
growth factor on ligament healing. Clin Orthop, 308:207-212, 1994.
18) Nagineni NC, Amiel D, Green MH, Berchuck M and Akeson WH: Characterization of the intrinsic properties of the anterior cruciate and medial collateral ligament cells: an in vitro cell culture study. J Orthop Res, 10:465-475, 1992.
19) Neil AC and Laurence ED : The effect of growth factors on the healing of ligaments. Trans Orthop Res Soc, 39:60, 1993.
20) Niall M, Ryan GB and O ’Brien BM : The effect of epidermal growth factor on wound heal - ing in mice. J Surg Res, 33:164-169, 1982.
21) Noyes FR and Barber-Westin SD: Revision anterior cruciate surgery with use of bone-patel- lar tendon-bone autogenous grafts. J Bone Joint Surg, 83-A:1131-1143, 2001.
22) O’Donoghue DH, Frank GR, Jeter GL, John- son W, Zeiders JW, and Kenyon R : Repair and reconstruction of the anterior cruciate ligament in dogs. Factors influencing long-term results. J Bone Joint Surg, 53-A:710-718, 1971.
23) Park YS and Ito Y: Micropattern-immobiliza- tion of heparin to regulate cell growth with fibroblast growth factor. Cytotechnology, 33:117-122, 2000.
24) Schmidt CC, Georgescu HI, Kwoh CK et al.:
Effect of growth factors on the proliferation of fibroblasts from the medial collateral and anteri- or cruciate ligaments. J Orthop Res, 13:184-190, 1995.
25) Wiig ME, Amiel D, Ivarsson M, Nagineni CN, Wallace CD and Arfors KE: Type I procolla- gen gene expression in normal and early healing of medial collateral and anterior cruciate liga- ments in rabbits. An in situ hybridization study. J Orthop Res, 9:374-382, 1991.
26) Yoshida M and Fujii K: Differences in cellular properties and responses to growth factors between human ACL and MCL cells. J Orthop Sci, 4:293-298, 1999.