서장경으로부터 분리한 Homosyringaldehyde의 뇌신경세포 보호 활성
원진배*·이보형*·윤보라*·이지우*·마충제*,**,#
*강원대학교 의생명소재공학전공, **강원대학교 생명공학연구소 (Received June 29, 2012; September 19, 2012; Accepted September 22, 2012)
Neuroprotectuve Effect of Homosyringaldehyde Isolated from Cynanchum panuculatum against Glutamate-Induced Neurotoxicity
Jin Bae Weon*, Bohyoung Lee*, Bo-Ra Yun*, Jiwoo Lee* and Choong Je Ma*,**,#
*Department of Biomaterials Engineering, Division of Bioscience and Biotechnology, Kangwon National University, Chuncheon 200-701, Korea
**Research Institute of Biotechnology, Kangwon National University, Chuncheon 200-701, Korea
Abstract — Homosyringaldehyde was isolated and identified from the 80% methanol extract of roots of Cynanchum pan- iculatum. C. paniculatum has been widely used for the treatment of various diseases such as neurasthenia, insomnia, dys- menorrheal and toothache. This compound exerted significant neuroprotective activities against glutamate-induced neurotoxicity in hippocampal HT22 cell line by 37.53% (at the concentration of 100µM). We investigated mode of action of this compound. Homosyringaldehyde (100µM) significantly decreased the ROS level and Ca2+ concentration in the oxi- dative stress induced HT22 cells by oxidative glutamate toxicity. Thus, our results suggest that homosyringaldehyde sig- nificantly protect HT22 cells against glutamate-induced oxidative stress, via antioxidative activities. As the results, we suggest that homosyringaldehyde may be useful in the treatment of neurogenerative disorders.
Keywords □ Homosyringaldehyde, Cynanchum paniculatum, neuroprotective effect, HT22 cells, glutatmate
알츠하이머 병이나 파킨슨 병과 같은 퇴행성 뇌질환은 점진적 인지기능 저하, 행동 장애 그리고 다양한 정신 행동 증상을 초래 한다. 현재 치매는 인구의 고령화로 환자가 점차 증가하고 있고 최대의 노화 질환이다.1)
산화적 스트레스, β-amyloid plaque 의 축적 또는 tau protein 의 축적으로 인해 뇌신경 세포 사멸과 변성을 초래하고 퇴행성 뇌질환을 야기한다.2,3)흥분성 신경 전달 물질인 Glutamate는 뇌 신경 세포 사멸을 일으킨다. 과다한 Glutamate 농도는 cystine/
glutamate antiporter system을 통한 cystine을 억제하여 항산화 제인 glutathione을 감소시킨다. Glutathione의 감소는 세포 내 활성 산소종(ROS)을 축적 시켜 세포 사멸을 유도한다.4,5)또한 glutamate는 세포 내 칼슘 이온의 양을 증가시키고 증가된 칼슘은 미토콘드리아의 기능 장애를 초래하여 세포 사멸을 일으킨다.6) 현재 많은 노력과 연구에도 불구하고 퇴행성 뇌질환의 정확한 발
병기전은 밝혀지지 않았고 퇴행을 확실하게 억제하거나, 지연 시 킬 뚜렷한 치료제가 존재하지 않다. 최근까지의 치료제는 콜린 가설에 근거한 acetylcholinestrase 억제제나 아밀로이드 가설에 바탕을 둔 치료제들이 존재한다. 따라서 효과적인 치료제의 개 발이 필요하다.
생약의 경우, 보다 안전하고 다양한 생리 활성 성분이 포함되 어 있어 복잡한 기전을 가진 퇴행성 뇌신경계 질환 치료제로 이 용될 수 있으며 현재도 많은 생약을 치매 치료제에 이용하기 하 기 위한 연구가 진행 중이다.7,8)
서장경(Cynanchum paniculatum)은 박주가리과(Asclepiadaceae) 에 속한 다년생초본인 산해박의 뿌리로써 진통작용, 진정작용 그 리고 이뇨작용을 가지고 있다. 최근 연구보고에 따르면 항암작 용, 항염작용 및 항 혈소판 활성 등이 있는 것으로 나타났다.9) 서장경의 성분으로는 paeonol과 같은 phenolic compund가 주성 분으로 알려지고 있으며, 이외에도 C21 steroids와 alkaloids 성 분이 보고되고 있다.10,11) 예전 연구에서 우리는 서장경 80%
methanol 추출물의 분획물인 CHCl3추출물과 CHCl3추출물로부 터 분리된 화합물의 뇌신경세포 보호 활성 효과를 보고하였다.12)
#본 논문에 관한 문의는 저자에게로 (전화) 033-250-6565 (팩스) 033-253-6560 (E-mail) cjma@kangwon.ac.kr
종설
본 연구에서는 in vitro 모델로 산화적 스트레스에 의해 유도된 neurotoxity의 작용 기전을 설명할 수 있는 마우스 해마 기원 세 포주인 HT22 cell을 사용하였으며, 서장경의 CHCl3추출물에서 추가적으로 분리된 화합물의 glutamate에 의한 독성에 대한 HT22 cells 에서의 뇌신경 세포 보호 활성을 측정하였다.
실험방법
실험 재료
본 연구에서 사용된 서장경은 서울 경동시장에서 구입하였으 며, 형태학적 평가를 통하여 동정하였고 시료(NO. CJ021M)는 강 원대학교에 보관하였다.
시약 및 기기
추출 및 분리 용매는 대정화금 제품에서 구입하였다, TLC plates(Silica-gel 60 F254)와 silica gel(70~230 mesh)는 Merck (Darmstadt, Germany)에서 구입하였고 Sephadex LH-20(bead size 25~100µM)은 Sigma사(St. Louis, U.S.A.)로부터 구입하였 다. Dulbecco's modified Eagle's medium(DMEM)과 fetal bovine serum(FBS)은 Gibco BRL. Co.(Eggenstein, Germany) 사의 제품을 구입하여 사용하였으며, glutamate와 positive control으로 사용되는 6-hydroxy-2,5,7,8-tetramethylchroman-2- carbboxylic acid(trolox), 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT)는 Sigma사(St. Louis, U.S.A.)로부터 구입하여 사용하였다.
분리를 위해 Gilson사의 HPLC separation system을 사용하 였고, NMR spectrum은 Bruker Avance 600 spectrometer을 사용하였다.
화합물의 분리 및 구조
5.2 kg의 서장경의 뿌리 부분 정확히 무게를 잰 후 80%
methanol 2l에 3회 초음파 추출을 실시한 후, 추출물을 진공 evaporator를 이용하여 감압 농축하여 추출물을 제조하였다. 농 축한 추출물에 증류수를 넣고 현탁 시킨 후 극성이 낮은 유기용 매 Hexane, CHCl3, EtOAc, n-BuOH 순으로 분획하였다. 분획 층 중에서 32.9 g의 CHCl3층을 CHCl3/MeOH(100 : 1→0 : 1, v/v) 를 용출용매로 하는 silica gel column(90×10 cm, 70~230 mesh) 를 적용하여 8개 층(A-H)으로 나누었다. 8개 층 중 C층에서 100% methanol을 이동상으로 하여 Sephadex LH-20 컬럼 크로 마토그래피를 실시하여 5층(C1-C5)를 얻었다. C2에서 C18 YMC hydrosphere(250 mm×20 mm I.D. S-5 µm, acetonitrile/0.1%
TFA water, 10 : 90→20 : 80, v/v)의 preparative HPLC를 통해 compound A(1.4 mg)를 얻었다.
Compound A− ESI-MS m/z: 195[M-H]-; 1H-NMR(400 MHz,
CD3OD) δ 2.88(2H, s, -CH2), δ 3.91(6H, s, -OCH3), δ 7.23 (2H, s, H-2,6), δ 9.75(1H, s, C=O); 13C-NMR(600 MHz, CD3OD) δ 51.12(-CH2), δ 54.11(-OCH3), δ 55.94(-OCH3), δ 102.97(C-2,6), δ 131.67(C-3,5), 147.39(C-4), 202.76(-CHO).
HT22 cell 배양 및 뇌신경세포 보호활성 측정
마우스 해마 기원 세포주인 HT22 cells은 서울대학교 약학대 학에서 분양 받아 사용하였다. HT22 cell은 5 % CO2, 37oC의 CO2 incubator에서 10% heat-inactivated fetal bovine serum (FBS)가 포함된 DMEM 배지로 배양하여 사용하였다.
분리된 화합물의 HT22 cell 안에서 뇌신경세포 보호활성을 측 정하기 위해 MTT assay를 시행하였다. HT22 cell을 48-well plate에 1.5×104cells/well를 분주하여 24시간 배양한 후, 분리된 화합물과 2 mM glutamate를 첨가하고 24시간 동안 배양하였다.
배양 후 배지를 제거하고 MTT assay를 시행하였다. Positive control으로 trolox를 사용하였다. 세포생존율은 enzyme-linked immunosorbent assay(ELISA)를 통해 흡광도 570 nm에서 측정 하였다. 뇌신경세포 보호 활성 값은 relative protection(%)로 나 타냈다. 통계처리는 ANOVA test를 적용하였으며, 3회 반복한 실 험치를 이용하여 계산하여 나타냈다.
세포 내 활성 산소종(ROS) 생성의 측정
세포 내 활성 산소종(ROS) 생성은 2'7'-dichlorofluorescein diacetate(H2-DCF-DA)을 사용하여 측정하였다. 세포를 수확하기 전에 PBS로 세척한 후, 10 µM DCF-DA를 처리하여 37oC에서 30분간 배양한다. 배양된 세포는 PBS로 두 번 정도 세척하고 37oC에서 10분간 1% Triton X-100를 처리하여 세포를 추출한다.
세포 내 활성 산소종은 형광 분석기를 통해 490 nm의 들뜸 파 장과 525 nm의 방출 파장에서 측정하였다.
세포 내 칼슘 이온(Ca2+) 생성의 측정
세포 내 칼슘 이온(Ca2+)를 측정하기 위해, Fura-2AM을 사용 하였다. 세포를 수확하기 전에 2 µM Fura-2AM을 처리한다. 2시 간 후에 세포를 PBS로 세척한 후, 1% Triton X-100를 처리하여 세포를 추출한다. 칼슘 이온(Ca2+) 형광 분석기를 통해 400 nm 의 들뜸 파장과 535 nm의 방출 파장에서 측정하였다.
Hydrogen peroxide(H2O2) 소거 활성 측정
Hydrogen peroxide 소거 활성을 Muller14)의 방법인 2,2- azinobis(3-ethylbenzthiazolin)-6-sulfonicacid(ABTS)-peroxidase system을 이용해 측정하였다. 96 well plate에서 시료용액과 10 mM H2O2, phosphate buffer(pH 5.0, 0.1 M)를 넣어 37oC에서 5분간 반응시켰다. 1.25 mM ABTS와 1 U/ml peroxidase를 넣고 혼합한 후 다시 37oC에서 10분간 반응시키고 enzyme linked
immunosorbent assay(ELISA) reader 를 이용하여 405 nm에서 흡광도를 측정하였다.
결과 및 고찰
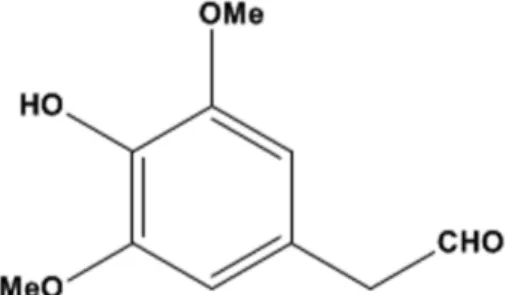
서장경으로부터 분리된 화합물은 1H-, 13C NMR spectra를 통 해 구조를 분석하여 분자식 C10H12O4을 확인하였다. 1H NMR spectra에서 methoxy group(δ 3.91; 6H, s, -OCH3)과 methylene group(δ 2.88; 2H, s, -CH2)을 확인하였고, 하나의 aldehyde group(δ 9.75; 1H, s, CHO)을 확인하였다. 1H, 13C NMR spectrum data의 결과 토대로 homosyringaldehyde으로 화합물의 구조를 추정하였고 기존 문헌의 data와 비교하여 이를 확정하였다.13)(Fig. 1)
MTT assay에 의한 뇌신경 세포 보호 활성
Homosyringaldehyde의 HT22 cells에서의 뇌신경 세포 보호 활성을 측정하기 위해 10 µM, 50 µM, 100 µM의 세가지 농도에 서 MTT assay를 통해 확인한 결과, 50 µM에서 8.29%와 100µM에서 37.53%으로 농도 의존적인 뇌신경 세포 보호 활성 을 나타내었다(Fig. 2).
Fig. 1− The chemical structure of homosyringaldehyde.
Fig. 2− The neuroprotective effects of homosyringaldehyde on glutamate-induced cytotoxicity in HT22 cells. HT22 cells were treated with 10, 50 and 100µM of homosyringaldehyde then incubated for 24 h with glutamate (2 mM). Positive control, trolox (50µM) exhibited relative protective activity (93.02±9.46%). Each bar represents the mean±SD of three independent experiments. *p<0.05, **p<0.01, ***p<
0.001 vs. SCRT (ANOVA).
Fig. 4− Effect of homosyringaldehyde on intracellular Ca2+ ac- cumulation in glutamate-treated HT22 cells. homosyring- aldehyde was treated with 2µM Fura-2 AM 1 h before exposure to glutamate. The alteration of Ca2+ concentration measured 2 hour after glutamate treated. The data present means±SD. *p<0.05, **p<0.01 and ***p<0.001 vs.
glutamate-injured cells (ANOVA).
Fig. 3− Inhibition of reactive oxygen species (ROS) generation.
HT22 cells were treated with 10, 50 and 100µM of homosyringaldehyde and then exposed to 2 mM glutamate for 8 h increased reactive oxygen species production (ROS). Trolox (10µM) was used as positive control. Each bar represents the Mean±SD of three independent experiments. *p<0.05, **p<0.01, ***p<0.001 vs glutamate- injured cells (ANOVA).
세포 내 활성산소종(ROS) 측정
Glutamate를 처리한 세포의 ROS량은 112.61%로 증가하였으 나, 50 µM와 100 µM 농도의 homosyringaldehyde을 처리한 세 포에서는 각각 100.71%와 100. 34%로 정상적인 세포의 활성산 소종의 량과 유사한 수준을 나타내었다(Fig. 3).
세포 내 칼슘이온(Ca2+) 측정
Glutamate를 처리한 세포 내의 칼슘 이온량 측정 결과, 108.50%로 증가하였으나, 100 µM 농도의 homosyringaldehyde 를 처리시 100.23%의 칼슘 이온량이 측정되어 정상적인 세포에 서의 칼슘이온과 비교하여 큰 변화가 없었다(Fig. 4).
Hydrogen peroxide(H2O2) 소거 활성
항산화 활성을 비교 측정하기 위해 H2O2 소거 활성을 측정하 였다. 측정한 결과, 농도 의존적으로 H2O2의 량을 감소시켰으며,
homosyringaldehyde의 IC50 값은 2266.33 µM을 나타내었다 (Fig. 5).
결 론
중추 신경계에서 아미노산계 신경 전달물질인 glutamate에 의 한 산화적 스트레스는 지질과산화를 유발시키고 세포의 단백질, DNA 및 세포막을 산화적 손상시켜 뇌신경세포의 변형 및 사멸 을 일으켜 알츠하이머 병이나 파킨슨병과 같은 퇴행성 뇌질환 및 다양한 병리적 원인이 된다.15) Superoxide anion radical(O2-), 과 산화수소(H2O2), hydroxyl radical(OH) 및 과산화지질(lipid peroxide) 등의 활성 산소종(ROS)에는 free radical을 가져 안정 되지 못한 상태이며, 세포 내 활성산소종의 량이 증가하게 되면, 산화적 스트레스를 일으켜 치명적인 세포 손상을 일으킨다.16) glutamate는 마우스 해마 유래 세포주인 HT22 cell에서 JNK와 p38 MAPK 신호전달 경로을 통해 glutathione의 농도를 저하하 여 ROS의 량을 증가시킨다.17)
본 연구에서 서장경으로부터 분리한 homosyringaldehyde의 HT22 cells에서 glutamate에 의해 유도된 뇌신경 세포 사멸에 대한 보호 활성을 측정하였으며, 100 µM에서 37.53%의 뇌신경 세포 보호 활성을 나타내었다. 예전 연구에서 서장경은 HT22 cell에서 뇌신경 세포 보호 활성을 나타냈으며, 분리된 화합물에 서도 뇌신경 세포 보호 활성을 확인하였다.12)이번에 분리된 homosyringaldehyde도 앞서 분리된 화합물과 유사한 구조의 phenolic compound 구조를 나타내었다. Phenolic compound들 의 항산화 활성은 많은 연구에 의해 보고되었고, 2,4,6- trimethylphenol은 HT22 cells에서 antioxidant neuroprotective effect를 나타내었다.18-20) 서장경으로부터 분리된 homosyring- aldehyde도 phenolic compound로서 항산화 활성에 의해 뇌신경 세포 보호 활성을 나타낸 것으로 판단되며, 세포 내 활성 산소종 (ROS) 축적 측정에서도 glutamate를 처리한 세포에서보다 homosyringaldehyde을 처리한 세포 에서 활성 산소량이 낮게 측
정되었다. 활성산소종의 일종인 hydrogen peroxide(H2O2)에 대 한 homosyringaldehyde의 소거 활성을 측정하였고, 농도 의존적 으로 H2O2의 량을 감소시켰다.
세포 내에서 신경 전달을 담당하는 요소 중인 하나인 칼슘 이 온의 경우, 증가된 glutamate에 의해 세포 내로의 유입되어 축적 되는 현상을 일으켜 뇌 세포 손상을 유도한다.21)칼슘 이온의 내 부 유입량이 증가하면 단백질 분해 효소인 calpain의 활성이 증 가하게 되고, 칼슘 이온을 세포 외부로 배출 시키는 단백질을 분 해하여, 세포 사멸로 이어진다. 이 연구에서 glutamate를 처리한 세포에서의 칼슘 이온량은 증가한 반면, glutamate와 homo- syringaldehyde를 함께 처리한 세포에서의 칼슘 이온량은 정상 적인 세포와 유사한 량을 나타내었다.22) Homosyringaldehyde는 칼슘 이온의 세포 유입을 억제하여 신경 세포를 보호 하는 것으 로 사료된다.
위의 실험 결과, homosyringaldehyde은 glutamate에 의한 산 화적 스트레스로부터 뇌신경 세포를 보호한다고 사료된다. 위 결 과를 바탕으로 추가적인 뇌신경세포 보호 활성 기전의 연구가 필 요할 것으로 판단된다.
감사의 말씀
본 연구는 한국연구재단의 지원을 받아 수행된 연구입니다 (2010-0005149).
참고문헌
1) Boller, F., Mizutani, T., Roessmann, U. and Gambetti, P. : Parkinson disease, dementia, and Alzheimer disease:
clinicopathological correlations. Ann. Neurol. 7, 329 (1980).
2) Smith, C. D., Carney, J. M., Starke-Reed, P. E., Oliver, C. N., Stadtman, E. R., Floyd, R. A. and Markesbery, W. R. : Excess brain protein oxidation and enzyme dysfunction in normal aging and in Alzheimer disease. Proc. Natl. Acad. Sci. U.S.A.
88, 10540 (1991).
3) Satoh, T., Enokido, Y., Kubo, T., Yamada, M. and Hatanaka, H. : Oxygen toxicity induces apoptosis in neuronal cells. Cell. Mol.
Neurobiol. 18, 649 (1998).
4) Coyle, J. T. and Puttfarchen, P. : Oxidative stress, glutamate, and neurodegenerative disorders. Science 262, 689 (1993).
5) Choi, D. W. : Glutamate neurotoxicity and diseases of the nervous system. Neuron. 1, 623 (1988).
6) Weikert, S., Freyer, D., Weh, M., Lsaev, N., Busch, C., Schultze, J., Megow, D. and Dirnal, U. : Rapid Ca2+ dependent NO-production from central nervous system cells in culture measured by NO-nitrite/ozone chemoluminescence. Brain Res. 748, 1 (1997).
Fig. 5− Hydrogenperoxide scavenging activity of homosyringaldehyde.
7) Wang, Z. G. and Ren, J. : Current status and future direction of Chinese herbal medicine. Trends. Pharmacol. Sci. 23, 347 (2003).
8) Normile, D. : Asian medicine. The new face of traditional Chinese medicine. Science 299, 188 (2003).
9) Choi, J.-H., Jung, B.-H., Kang, O.-H., Choi, H. J., Park, P. S., Cho, S. H., Kim, Y.-C., Sohn, D. H., Park, H., Lee, J. H. and Kwon, D.-Y. : The anti-inflammatory and anti-nociceptive effects of ethyl acetate fraction of Cynanchi paniculati radix.
Biol. Pharm. Bull. 29, 971 (2006).
10) Mitsuhashi, H., Sakurai, K. and Nomura, T. : Constituents of asclepiadaceae plants. XVII. Components of Cynanchum wifordi hemsley. Chem. Pharm. Bull. 14, 712 (1966).
11) Li, S.-L., Tan, H., Shen, Y.-M., Kawazoe, K. and Hao, X.-J. : A pair of new C-21 steroidal glycoside epimers from the roots of Cynanchum paniculatum. J. Nat. Prod. 67, 82 (2004).
12) Weon, J. B., Kim, C. Y., Yang, H. J. and Ma, C. J. : Neuroprotective compounds isolated from Cynanchum paniculatum. Arch. Pharm. Res. 35, 617 (2012).
13) Abdulkhani, A., Karimi, A., Mirshokrate, A., Hamzeh, Y., Marlin, N. and Mortha, G. : Isolation and chemical structure characterization of enzymatic lignin from populus deltoides wood. J. Appl. Polym. Sci. 118, 469 (2010).
14) Müller, H. E. : Detection of hydrogen peroxide produced by microorganism on ABTS peroxidase medium. Zentralbl.
Bakteriol. Mikrobiol. Hyg. A. 259, 151 (1995).
15) Yoon, M. Y., Lee, H. J., Lee, B. B., Lee, S. M., Kim, J. Y., Kim,
Y., Park, E. and Rark, H. R. : Protective effect of schizonepeta tenuifolia briquet extracts on oxidative DNA damage in human leucocytes and on hydrogen peroxide-induced cytotoxicity in PC12 cells. Food Sci. Biotechnol. 16, 858 (2007).
16) Halliwell, B. : Reactive oxygen species and the central nervous system. J. Neurochem. 59, 1609 (1992).
17) Fukui, M., Song, J. H., Choi, J., Choi, H. J. and Zhu, B. T. : Mechanism of glutamate-induced neurotoxicity in HT22 mouse hippocampal cells. Eur. J. Pharmacol. 617, 1 (2009).
18) Zheng, W. and Wang, S. Y. : Antioxidant activity and phenolic compounds in selected herbs. J. Agric. Food Chem. 49, 5165 (2001).
19) Cai, Y., Luo, Q., Sun, M. and Corke, H. : Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer. Life Sci. 74, 2157 (2004).
20) Moosmann, B. and Behl, C. : The antioxidant neuroprotective effects of estrogens and phenolic compounds are independent from their estrogenic properties. Proc. Natl. Acad. Sci. U.S.A.
96, 8867 (1999).
21) Ha, J. S. and Park, S. S. : Glutamate-induced oxidative stress, but not cell death, is largely dependent upon extracellular calcium in mouse neuronal HT22 cells. Neurosci. Lett. 393, 165 (2006).
22) Ray, S. K., Fidan, M., Nowak, M. W., Wilford, G. G., Hogan, E. L. and Banik, N. L. : Oxidative stress and Ca2+ influx upregulate calpain and induce apoptosis in PC12 cells. Brain Res. 852, 326 (2000).