저작자표시-비영리-동일조건변경허락 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. l 이차적 저작물을 작성할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 비영리. 귀하는 이 저작물을 영리 목적으로 이용할 수 없습니다. 동일조건변경허락. 귀하가 이 저작물을 개작, 변형 또는 가공했을 경우 에는, 이 저작물과 동일한 이용허락조건하에서만 배포할 수 있습니다.
이학 석사학위논문
허혈성 저산소증 생쥐 모델에서의
신경 재생에 관한 연구
아 주 대 학 교 대 학 원
의생명과학과 / 신경과학전공
박 신 영
허혈성 저산소증 생쥐 모델에서의
신경 재생에 관한 연구
지도교수 서 해 영
이 논문을 이학 석사학위 논문으로 제출함
2014년 8월
아 주 대 학 교 대 학 원
의생명과학과 / 신경과학전공
박 신 영
박신영의 이학 석사학위 논문을 인준함
심사위원장
서 해 영
(서명)
심 사 위 원
이 영 돈
(서명)
심 사 위 원
김 성 수
(서명)
아 주 대 학 교 대 학 원
2014 년 6 월 20 일
I -국 문 요 약 -
허 혈 성 저 산 소 증 생 쥐 모 델 에 서 의
신 경 재 생 에 관 한 연 구
뇌성마비(Cerebral palsy,CP)는 비 진행성의 신경 장애 중 하나로 태어나기 전 후로 많이 발병되며, 뇌 여러 영역에 존재하는 신경세포(Neuron), 교세포(Glia), 그리고 내피세포(Endothelial cell)에 막대한 손상을 받으며 그 기능 또한 저하된다. 보통 뇌성마비 환자는 평생 신체적인, 정신적인 장애를 갖고 살아가지만 일부 환자의 경우, 신경 손상이 지속적이지 않고 그 기능 또한 정상임이 보고되었다. 본 연구에서는, 뇌성마비 동물 질환모델을 이용하며 뇌 손상 후 병변의 진행 및 복구 기전을 알아보고자 하였다. 생후 7 일째 생쥐에 허혈성 저산소증(Hypoxic ischemia)을 유도한 경우, 선조체(Striatum), 해마(Hippocampus) 그리고 대뇌 피질(Cerebral Cortex) 영역의 손상이 확인되었고, HI 유도 하루부터 시작하여 많은 세포사멸(Apoptotic, Necrotic cell death)을 경유하는 신경세포들이 관찰되었다. 또한, 이 손상 영역은 HI 유도 후 4 일째 극심한 세포손실을 보였으며, 부종(Edema) 현상이 발견되었다. 반면에 손상 유도 2 주 뒤에는 해마를 제외한 영역의 조직의 구성이나 세포 모양은 정상 생쥐의 뇌에서 확인된 것과 비슷하였고, 대뇌피질 부위는 지속적으로 재생되고 있음을 확인하였다. 정상 생쥐의 뇌와 비교하여, 허혈성 저산소증 생쥐의 뇌에서 새로 분열하는 세포들이 여러 영역에서 증가하였고, 이 중, 신경줄기세포를 조절하는데 관여하는 Sonic hedgehog, SHH 에 반응하는 세포들이 많이 증가함을 확인하였다. 이 신경줄기세포들은 손상 유도 2 주 후 대뇌피질 부위에서 많이 발견되었고, 이들은 신경세포(Neuron), 교세포(Glia) 들로 분화함을 확인하였다. 따라서, 이러한 결과로 보아, 미성숙 뇌는 손상에 대응하여 스스로 재생 시킬 수 있는 능력을 가지고 있음을 알 수 있다. 따라서 뇌 손상에 대한 효과적인 치료방법을 연구하기 위해서는 내생적인 재생 메커니즘 또한 좀 더 정확히 연구할 필요가 있을 것이다. 핵 심 어 : 허 혈 성 저 산 소 증 , 소 닉 헤 지 호 그 , 재 생II
차 례
국 문 요 약 ... Ⅰ 차 례 ... Ⅱ 그 림 차 례 ... Ⅲ 표 차 례 ... Ⅳ Ⅰ . 서 론 ...1 1. 미 성 숙 뇌 에 서 발 생 하 는 허 혈 성 저 산 소 증 ...1 2. 허 혈 성 저 산 소 증 의 동 물 질 환 모 델 연 구 ...2 3. 허 혈 성 저 산 소 증 뇌 에 서 의 신 경 병 리 연 구 ...4 4. 손 상 받 은 뇌 의 신 경 보 호 작 용 기 전 ... 6 5. Gli1CreERt2 :: R26R 유전자 변형 생쥐...
8 Ⅱ . 재 료 및 방 법 ... 1 0 1. Animals and Neonatal hypoxia ischemia ... 1 0 2. 5-Bromo-2-deoxyuridine (BrdU) labeling experiment... 1 0 3. Cresyl violet staining for detection of Neuronal Degeneration ··· 1 1 4. Eriochrome Blue staining for detection of demyelination ··· 1 1 5. Immunohistochemistry ... 1 1 6. Genotyping (Gli1CreERT2/Rosa26lacZ Transgenic mouse) ··· 1 2 7. Tamoxifen injection for an activation of recombination ... 1 3 8. Detection of neural stem cell via X-gal staining ... 1 3 Ⅲ . 결 과 ... 1 7 Ⅳ . 결 론 및 고 찰 ... 3 9 참 고 문 헌 ... 4 4 ABS TR ACT ... 5 0III
그 림 차 례
그 림 . 1. 생 쥐 를 이 용 한 허 혈 성 저 산 소 증 유 도 방 법 ... 26 그 림 . 2. 허 혈 성 저 산 소 증 생 쥐 의 뇌 재 생 능 력 ... 27 그 림 . 3. 허 혈 성 저 산 소 증 유 도 에 의 한 뇌 신 경 세 포 변 화 ... 28 그 림 . 4. 재 생 된 대 뇌 피 질 영 역 에 존 재 하 는 세 포 ... 29 그 림 . 5. 허 혈 성 저 산 소 증 이 후 의 탈 수 초 현 상 ... 30 그 림 . 6. 허 혈 성 저 산 소 증 이 후 의 반 응 성 신 경 교 증 ... 31 그 림 . 7. 허 혈 성 저 산 소 증 이 후 의 세 포 증 식 ... 32 그 림 . 8. Gli1-CreER T2 ::R26R 생쥐에서의 재조합 활성. ... 33 그 림 . 9. 허 혈 성 저 산 소 증 유 도 에 따 른 신 경 줄 기 세 포 의 증 가 ... 34 그 림 . 10.손 상 유 도 2주 후 피 질 부 위 의 X-gal+ 세 포 증 가 (1) .... 35 그 림 . 11.손 상 유 도 2주 후 피 질 부 위 의 X-gal+ 세 포 증 가 (2) .... 36 그 림 . 12.손 상 유 도 2주 후 피 질 부 위 의 X-gal+세 포 분 화 타 입 .... 37 그 림 . 13.재 생 된 대 뇌 피 질 부 위 에 존 재 하 는 신 경 줄 기 세 포 ... 38IV
표 차 례
Tabl e.1. 생쥐의 유전형 확인을 위한 Primer 서열과 PCR 조건 ... 15 Tabl e 2. 사 용 된 항 체 정 보 와 조 건 ... ... 16
1
Ⅰ . 서 론
미 성 숙 뇌 에 서 발 생 하 는 허 혈 성 저 산 소 증
뇌성마비 (Crerebral palsy)는 중추신경계통 손상으로 일어나는 비 진행성의 신경 장애 중 하나로 뇌의 부위 중 주로 손상 받는 대뇌(Cerebrum)에서 Cerebral을, 운동장애를 지칭하는 Palalysis 라는 단어에서 palsy를 따와서 나온 합성어 이다. 새로 태어나는 태아의 1000명 중 1-6명 정도가 뇌성마비에 걸릴 위험이 있고, 이는 운동장애를 주로 나타나며 그 손상 정도에 따라 발달 장애에 의한 감각, 지각, 청력, 시력, 언어, 인지능력 등의 중복장애를 동반하며 (Dilenge et al., 2001), 이 중 25% 정도의 환자들은 사망 한다 (Ferriero, 2004; Rosenbaum et al., 2007). 만 2세 이전의 태아들에서 많이 발병하는 이 뇌성마비는 발생 시기에 따라 출생 전, 출생 시, 출생 후 세 가지로 나눠 볼 수 있으며, 뇌성마비는 하나 혹은 그 이상의 원인 인자가 복합적으로 작용하기 때문에 정확하게 그 원인을 알 수 없는 경우가 많고 조기진단 또한 어렵다 (Lafemina et al., 2006). 최근 연구 결과에 따르면, 조산에 의한 미숙아가 특히 이 뇌성마비를 일으키는 가장 큰 원인으로 들 수 있으며, 그 이 외에 X 방사선, 모체 감염, 약물중독, 호흡마비 기도 폐쇄, 태반이상 등에 의해서도 발병할 수 있다고 한다. (Busl and Greer, 2010). 또한 후천적인 원인으로는 사고, 감염, 뇌종양 등이 있고, 아주 미미 하지만 뇌성마비 환자 중 2% 정도는 glutamate decarboxylase-1의 유전에 의해서도 나타난다. 반면에, 뇌성마비 환자 중 10% 정도는 뇌 손상 정도가 그리 심하지 않고, 장애 또한 심하지 않아 일반 사람들처럼 살아가는데 지장이 없는 경우도 있다. 허혈성 저산소증 (Hypoxic-ischemia)은 뇌성마비의 가장 흔한 경우로, 산소와 혈액공급 결핍, 세포독성 이런 다양한 인자들이 조합되어 생기는 질환이며 (Busl and Greer, 2010), 이 질병에 대한 메커니즘이나 치료방법 등은 정확하게 알려져 있는 것이 없다. 사실, 특정 연구진에서 환자 체온의 3-4’c 낮은 환경에 뇌성마비
2
환자를 적정한 시간 동안 노출시키면 신경보호작용 효과가 나타난다고 밝힌 바가 있지만, 이 저 체온 치료의 효과는 뇌 손상 이후 6시간 이내에 실시 되어야지만 신경 보호작용이 있다 (Pfister and Soll, 2010). 이와 같이 현재까지는 뇌성마비를 완치시킬 수 있는 치료법은 아직 없으며, 줄기세포치료, 유전자치료, 분자 치료, 작업치료 등 다양한 분야에서 활발하게 연구 되어지고 있는 실정이다 (Cerio et al., 2013).
MRI 연구에 따르면 조기출산이나 체중미달에 의한 미성숙 태아의 brain은 일반 태아의 뇌의 발달과는 큰 구조적 차이를 보인다 (Inder et al., 2005; Gimenez et al., 2006; Ment et al., 2009). 특히, 이들은 일반 정상적인 태아에 비교하여 회백질(Graymatter), 기저핵(Basalganglia) 그리고 소뇌(Cere bellum)을 포함한 여러 영역에서 더 적은 부피를 가진다 (Inder et al., 2005; Nosarti et al., 2008). 이에 반해, 최근 여러 임상연구에서, 발달 중인 어린 태아의 뇌의 경우, 허혈(Ischemia), 저산소증(Hypoxia), 외상성 뇌손상 (Traumatic injury)에 대항하여 내재적으로 자가치료를 위한 반응을 보이며 이것에 의한 치료 가능성 또한 주목할 만 하다는 내용이 보고되어졌다(Arvidsson et al., 2002; Ment et al., 2003; Fagel et al., 2006; Kadam et al., 2008). 이처럼 뇌성마비를 효과적으로 치료하기 위해서는 진보적이고 향상 된 많은 후속 연구가 필요할 것이다.
허 혈 성 저 산 소 증 의 동 물 질 환 모 델 연 구
동물질환모델 연구는 전임상의 연구로써 질병의 손상기전과 재생 기작을 분자학적으로 이해할 수 있게 함에 있어 꼭 필요한 분야이다. 이 허혈성 저산소증 모델은 처음 Vannucci와 rice 라는 과학자에 의해 Rat에서 연구가 되었고, 이후 생쥐를 비롯한 다른 다양한 동물들에도 적용을 시켜 여러 연구들에서는 이를 뇌성마비를 위한 모델로 사용하고 있다 (Rice et al., 1981; Ditelberg et al., 1996).
3
태어나는 미성숙 태아에서 많이 발병 되는데, 이 질병을 모방하는
동물질환모델을 위해서는 생후 7일째에서 10일째 생쥐를 이용하였다. 이 시기는 사람의 태아에서 재태 기간 34–36주에 해당하는 시기로 세포증식(Cellular proliferation), 대뇌피질 구조(Cortical organization), 시냅스의 수(Synapse number), 신경전달물질합성효소(Neurotransmitter synthetic enzymes) 그리고 전기생리학적 (Electrophysiology)인 면 등에서 미성숙태아의 뇌와 비슷한 특징들을 보이기 때문이다 (Liu et al., 1999). 보통 동물모델을 이용한 허혈성 저산소증 연구에서는 이 질병을 유도하기 위해 총 경동맥 결찰술(Common carotid artery ligation)과 저산소 손상 (Hypoxic injury) 이 둘을 동시에 진행하게 되는데, 이 둘 중 한가지의 방법만을 이용해 손상을 준 경우에는 적절한 뇌 손상을 유도하지 못하게 된다. 이는 뇌 내의 대뇌 동맥륜(Circle of willis) 이라는 구조에 의한 결과로, 방향의 혈관이 손상을 입어 혈류가 차단이 되더라도 다른 한쪽으로의 혈액 공급이 가능하기 때문이다 (Tian et al., 2013). 허혈성 저산소증을 동물에서 유도할 경우 여러 가지 인자들이 뇌 손상 정도를 결정 하는데, 이 중 중요한 인자로 생후 일자와 저 산소 조건의 지속시간, 그리고 태아의 성별 세 가지를 들 수 있다. 생후 일자는 앞서 언급하였던 것과 같이, 미성숙 태아에 경우, 뇌 발달 구조 자체가 미성숙하게 이루어져 이러한 뇌 손상을 유발하는 기전에 취약한 모습을 보이기 때문이고, 질병을 유도하기 위한 총 경동맥 결찰술 이후의 저 산소 처리 지속시간의 경우, 보통 생후 7일의 생쥐에서는 15분에서 (Jiang et al., 2008) 2.5시간 (Nakanishi et al., 2009) 등 다양한데 반해, 지속시간이 증가 할수록 뇌 손상의 정도는 심해지며 또한 생존율 또한 감소하는 경향을 보이기 때문이다. 저산소 처리 시간을 30분 정도 주는 것이 적절한 대뇌 손상(Cerebral damage)을 일으키며, 대부분의 연구에서는 한쪽 뇌 반구의 혈류를 차단한 후 30분 또는 45분의 저산소 환경에 노출시켜 허혈성 저산소증 동물 모델을 유도한다 (Kendall et al., 2006). 이 외, 어떤 연구 결과에서는 성별에 따라서도 유도되는 뇌 손상 정도가 확연히 달라질 수 있음을 보여주었다. 사실, 임상연구에서는 이러한 결과들이 명확하게 알려지지 않았지만,
4
동물모델을 이용한 연구결과에서 보고된 바에 의하면, 수컷 생쥐의 경우 같은 조건에서 암컷 생쥐보다 더 심각한 뇌 손상을 유발하는데, 이러한 현상을
나타내는 이유 중 하나는 성별에 따른 호르몬 차이에 의한 것임을 밝혔다 (Yager
et al., 2005). 이에 관련된 논문들에서는 여성에 많이 존재하는 에스트로겐
(Estrogen)이 대뇌 재관류(Cerebral reperfusion), 항산화력(Antioxidant activity)을 증가시키고 흥분성 아미노산 (Excitatory amino acid)을 감소 시키는 효과가 있으며 (Hurn and Brass, 2003), 남성에 존재하는 테스토스테론(Testosterone)의 정도가 허혈성 저 산소 손상에 의한 신경세포의 흥분성 독성(Neuronal excitotoxicity)을 증가 시킬 수 있음을 소개하였다 (Yang et al., 2002). 이러하여 동물모델을 이용한 많은 연구들 에서는 유도되는 손상 정도의 다양성을 최소화 시키고자 수컷의 생쥐를 선호하는 편이다. 이 외에도, 생쥐의 종 등 여러 인자에 의해 유도하는 뇌 손상 결과의 정도가 달라질 수 있다 (Sheldon et al., 1998; Ferrazzano et al., 2013).
.
허 혈 성 저 산 소 증 뇌 에 서 의 신 경 병 리 연 구
신생아의 뇌의 한쪽의 목 동맥을 결찰 시킨 후(Unilateral common carotid artery) 8%의 저산소증 조건에 노출을 시키게 되면 포도당(Glucose)과 산소(oxygen) 공급이 차단 되면서 혈중 저산소증(Hypoxemia)이 일어나게 된다. 이러한 결과로, 뇌 내의 에너지 대사가(Brain energetic metabolism) 망가지면서 혐기성 해당작용(Anaerobic glycolysis)을 일으켜 젖산(Lactic acid)이 축적되면서 산성혈증 (Acidosis)을 야기한다 (Perlman, 2006). 이러한 변화에 즉각적인 반응으로 세포에서는 손상을 받은 지 수 분만에 괴사성 세포사멸 (Necrotic cell death)이 일어나게 되고, 수 시간 후에는 혈류가 차단되었던 영역이 재관류(Reperfusion) 되고 재산소화(Reoxygenation) 되면서 혈중 이산화탄소 농도가 비정상적으로 높은 상태인 저탄산증(Hypocapnia)을 일으키게 되며, 이에 의해, 신경세포사(Apoptotic cell death)가 일어나게 된다 (Wyatt et al., 1989; Yager et al., 1992; du Plessis and Volpe,
5
글루탐산(Glutamic acid)의 축적, 활성산소 발생(Free radical production), 세포 내 나트륨 농도의 증가 (Intracellular sodium accumulation), 세포독성부종 (Cytotoxic edema), 면역반응(Inflammatory reaction) 진행에 의한 사이토카인 (Cytokine) 방출 등 여러 반응이 일어나게 되고, 이러한 과정들을 거쳐 허혈성 저산소증에 의한 뇌 손상이 진행된다 (Inder and Huppi, 2000; Cerio et al., 2013).
신경병리학적 연구결과에 따르면 신생아의 뇌는 성인의 뇌 보다 허혈성 저산소증 상해 (Hypoxic ischemic injury)에 더 취약한 모습을 보이는데, 이는 미성숙 뇌의 경우 성숙한 뇌에 비해 더 많은 혈관을 가지고 조직 내 수분 함량이 많다는 구조적 차이가 있으며, (du Plessis and Volpe, 2002), 더 적은 미엘린(Myelin)을 갖고, 대뇌피질의 발달이 아직 덜 이루어 졌다는 조직학적 차이 때문이라 한다. (du Plessis and Volpe, 2002)
허혈성 저산소증이 유도된 신생아의 뇌에서는, 중반부 그리고 후반부의 대뇌 피질(Middle and posterior cortex), 해마의 CA영역, 치상회 영역(Dentate gyrus), 그리고 선조체를 포함하는 여러 영역에서 신경세포(Neuron)와 교세포(Glia)의
손상을 보였다 (Neil W. Kleman, 2010). 또한 상해가 시작되면서
미세아교세포(Microglia), 휴면상태의 성상교세포(Astrocyte)등이 자신의 형태를 변화시키며 활성화 되는 반응성 신경교증(Reactive gliosis)이 일어나는데 (Cai et al., 2006), 손상된 뇌 내에서의 이러한 세포들의 형태 변화와 재생, 회복(Recovery) 메커니즘에 관련해서는 정확히 입증된 바가 없다.
뇌졸증에 관련한 연구에 의하면 손상(Injury)에 의하여 활성화 되는 형태를 보이는 미세아교세포(Microglia)와 성상교세포(Astrocyte)는 사이토카인을 방출 하여 병변이 더 진행 되도록 하는데 (Yasuda et al., 2011), 최근 발표된 많은 논문들에서는 이와 같은 신경독성(Neurotoxic)과 병변진행(Worsen injury)의 부정적인 효과 말고도 재생, 회복을 위한 신경가소성(Neuroplasticity)의 일을 하는데도 연류 되어 있음을 소개하였다. 반응성 신경교증(Reactive gliosis)에 의한 신경가소성(Neuroplasticity) 기능에는 시냅스 부근 환경(Perisynaptic enviro-nment)의 개선, 항염증성 사이토카인(Anti-inflammatory cytokines)과 성장인자 (Growth factors)
6
분비 등 여러 가지가 있다 (Lalancette-Hebert et al., 2007; Tremblay et al., 2011). 뿐만 아니라, 많은 연구들에서 발달 중인 생쥐의 뇌에 저산소증(Hypoxia), 허혈증(Ischemia) 그리고 외상성 뇌손상(Traumatic injury) 등을 유도 하였을 때,
치아이랑(Dentate gyrus)의 과립세포하층(Subgranular layer)과 측뇌실(Lateral
ventricles)의 뇌실하 영역(Sub-ventricular zone)을 포함하는 발아영역 (Germinative
zones)에서 신경줄기/전구세포(Neural stem/progenitor cells)들의 발현이 촉진
되었음을 확인하였고, 이들은 증식(Proliferation) 되어 손상된 뇌 영역으로 이동한
후 신경세포(Neuron)와 희소돌기아교세포 (Oligodendrocyte)로 분화함을
확인하였다 (Plane et al., 2004; Fagel et al., 2006; Felling et al., 2006; Yang et al., 2007).
이러한 뇌 손상 유도후의 신경조직발생 (Neuroge-netic)과 교세포발생
(Gliogenetic)의 세포학적 메커니즘은 손상된 대뇌를 회복하기 위한 기전으로 사료 되어진다 (Scafidi and Gallo, 2008).
손 상 받 은 뇌 의 신 경 보 호 작 용 기 전 미성숙 태아의 뇌에 허혈성 저산소증을 유도하면 대부분의 환자들이 평생 운동장애, 언어장애 등을 갖고 살아가지만, 병변 정도가 약한 소수의 환자들은 자연적으로 치유가 되어 장애가 없는 일상적인 삶을 살아간다고 한다. 최근 발표된 많은 논문들에서는 생쥐에 허혈성 저산소증을 유도하여, 손상된 조직 영역의 재생과 회복에 관련한 가능성이 있는 세포학적 분자학적 메커니즘을 설명하였다. 이 중, 뇌 손상 유도 후에 발견되는 신경조직발생(Neurogenetic), 교세포발생(Gliogenetic) 그리고 내생적 환경의 변화가 손상 영역의 회복에 기여한다는 내용이 대두 되고 있다 (Bartley et al., 2005; Ong et al., 2005; Yang et al., 2007). 기존 허혈성 뇌 증후군(Ischemic brain injury)에 관련한 논문에서는, 이러한 상해가 대뇌 신경발생지역(Neurogenic area)인 뇌실하 영역(Sub-ventricular zone)을 확장시키고, 이 지역에 존재하는 Nestin을 발현하는 신경줄기세포(Neural stem
7 또한 허혈성 저산소증을 유발한 생쥐의 뇌 조직에서, BrdU 검정 방법을 이용하여 상해를 입은 동측성 반구의 뇌실하 영역(Sub-ventricular zone)에서 새롭게 증식되는 세포의 증가를 확인하였고, 대뇌 피질(Cerebral cortex)과 선조체(Striatum)에서도 마찬가지로 BrdU가 표지 된 증식된 세포들이 확인되었다 (Hayashi et al., 2005). 이러한 결과들은 허혈성 저산소증에 의해 새로 생겨난 세포들이 병변 부위로 이동 하는 가망성을 제기하며, 상해에 영향을 받은 뇌 영역 자체에서 전구세포가 증식하기 때문 일 수 있음을 시사하였다. 몇몇 연구에서는 허혈성 저산소증 동물모델의 뇌실하 영역, 선조체, 그리고 대뇌피질 영역에서 새롭게 분열하여 다른 영역으로 이동하는 신경원세포(Neuroblast)가 유의성 있게 증가함을 확인하였다. 결과에 따르면, 이들 세포 중에는 신경세포(Neuron)로 분화한 것보다 성상교세포(Astrocyte) 로 분화한 세포가 더 많음을 확인하였다 (Ong et al., 2005). 더하여, 동물의 뇌는 태어나는 그 순간에도 발달이 덜 이루어져 있어 생후 몇 일 까지도 활발한 뇌의 발달 과정이 진행 되는데, 천천히 분열하는 GFAP가 라벨 된 다분화능 전구세포는 신경세포(neuron)과 희소돌기아교세포 (Oligodendrocyte)로 분화 한다는 내용도 알려져 있다 (Doetsch et al., 1999) . 뿐만 아니라, 몇몇의 분자 인자(Molecular factors)가 손상 받은 뇌의 재생과 회복을 조절한다는 내용 또한 대두되고 있다. 일부 어떤 연구에서는, 허혈성 저산소증 유도 이후 성장인자(Growth facror)를 포함한 특정한 유전자 발현이 상향조절(Up-regulation) 되거나 하향조절(Down-regulation) 되는 현상을 확인하였고, 이 중 몇 가지 인자들은 신경발생(Neurogenesis)를 조절을 한다고 밝혔다. 특히 허혈성 저산소증 유도 후 동측성 뇌 병변 부위(Ipsilateral side)에서 Notch1과 상피세포성장인자 수용체(Epidermal growth factor receptor receptor, EGFR)는 신경발생 (Neurogenesis)을 조절하고 (Felling et al., 2006). 신경성장 인자(Nerve Growth factor, NGF), 섬유아세포 성장인자(Fibroblast growth factors, FGF), Neurotrophin(NT)-3, 인슐린 유사 성장인자(Insulin-like growth factor, IGF), 섬모 향신경성 인자(Ciliary neurotrophic factor, CNTF) 그리고 뇌 유리 신경 성장
8
인자(Brain-derived neurotrophic factor, BDNF)는 뇌 신경 손상 이후의 세포의 증식(Cell proliferation), 분화(Differentiation), 성숙(Maturation), 유지(Maintenance) 그리고 신경세포의 생존(Neuronal survival) 등에 관련한다고 한다 (Mattson and Scheff, 1994; Emerich et al., 1996; Johnston et al., 1996; Abe, 2000; Hossain et al., 2002). 더 나아가, 이러한 뇌 유래 신경영양인자(Neurotrophic factor)에 관련된 잠재적 효과의 발견들은 뇌 질환의 치료에 가져올 긍정적인 결과를 가져올 수 있음을 시사한다.
Gli1CreERt2 :: R26R 유전자 변형 생쥐
Gli1은 Hedgehog signaling의 효과기(Effector)로 세포 운명 결정(Cell fate
determination), 세포 증식(Cell proliferation) 등에 관여하는 유전자 이다. Gli는 세 개의 전사인자를 포함하는데 이는 각각 Gli1, Gli2, Gli3이다. 이 중 Gli1의 발현 수준이 Sonic hedgehog signaling을 대표 하기에 가장 적절하며, Gli1creERt2는 이 Gli1을 유전적으로 변형 하여 만든 유전자 변형 생쥐다 (Dahmane et al., 1997; Marti and Bovolenta, 2002).
사실, 이 Sonic hedgehog는 발달중인 뇌에서의 세포증식의 조절에 관련하여 잘 알려진 세포 신호전달 체계(Cell signaling mechanism) 중 하나인데 (Dahmane and Ruiz i Altaba, 1999; Rowitch et al., 1999; Wechsler-Reya and Scott, 1999), 최근, 이 신호 전달 체계의 활성이 성체줄기세포의 증식을 위한 것이라는 내용을 담은 논문들이 소개 되었고, Sonic hedgehog 세포신호가 새로 증식하는 세포를 신경으로 분화하도록 유도한다라는 내용도 발표되었다 (Ahn and Joyner, 2005).
또한 어떤 논문에서는, Sonic hedgehog signaling 또는 이의
하위단계인자(Downstream effector)를 억제시키거나 삭제시킬 경우, 생후 생쥐의 신경발생지역(Neurogenic niche)에서 세포증식이 감소함을 확인하였고 (Lai et al., 2003; Machold et al., 2003; Han et al., 2008), 생쥐에 Focal cerebral cortex injury 유도를 한 경우에는, 이러한 상해에 의해서 활성화 되는 성상교세포(Astrocyte)에서 Sonic hedgehog 신호가 작동되며 이는 신경원 세포의 증식에도 연관이 있음을
9
확인하였다 (Amankulor et al., 2009).
Sonic hedgehog 신호전달에 의해 발생된 신경줄기세포(Neural stem cells)를 조직학적으로 확인이 가능하도록 Gli1-CreERT2 유전자변형 생쥐를 Rosa floxed-stop-lacZ 와 교배를 시켜 Gli1CreERt2::R26R 생쥐를 생산하였다 (Ahn and Joyner, 2005). 이 유전자 변형 생쥐는 Tamoxifen의 조건하에, Sonic hedgehog 신호전달 기작에 의해 증식된 Gli1을 발현하는 세포의 에스트로겐 반응기(Estrogen receptor, ER)가 반응시켜 Cre recombinase가 활성을 띄게 하며, 이는 stop codon 양 쪽에 있는 flox site를 삭제하여 스탑코돈(Stop codon)을 함께 없애고 LacZ를 발현하게 한다. 간단히 말해서, Tamoxifen을 주입하는 시기에 Sonic hedgehog signaling에 의해 조절되는 세포를 X-gal 염색을 통하여 확인할 수 있는 것이다. Tamoxifen에 의해 LacZ를 한번 발현한 세포는 이의 활성을 잃지 않고 세포질에서 lacZ를 계속적으로 발현하고, 증식할 때 또한 딸 세포에서 유전시키기 때문에, 이들의 이동변화 까지도 유추 할 수 있다 (Ahn and Joyner, 2004). Tamoxifen은 CreER의 nuclear translocation을 6시간 이내에 유도하고, 약 36시간동안 nucleus에 남아있게 된다 (Danielian et al., 1998; Robinson et al., 1991; Zervas et al., 2004). 또한, LacZ 를 발현하는 세포는 Tamoxifen 주입 20시간 이후에 탐지 될 수 있다는 결과가 알려져 있다 (Ahn and Joyner, 2004).
10
Ⅱ . 재 료 및 방 법
1. Animals and Neonatal Hypoxic Ischemia
Postnatal day 6.5 male and female surrogate mouse were purchased from koatech where SPF facilities was equipped, and housed in individual cages and fed high fat laboratory chow. After adequate nutritional support from the dam as adult female mouse, cerebral hypoxia-ischemia (HI) was produced in postnatal day 7 male mouse (corresponding to a brain
development of 34–36 weeks gestational age in the human fetus, weighing 3 to 4 g) by right
common carotid artery occlusion under isoflurane anaesthesia followed by hypoxia condition (8% O2, balanced N2)
Once fully anesthetized, a midline neck incision was made and the right CCA was identified. The CCA was separated from the vagus nerve and then ligated using 4-0 silk. The pups were then placed with the dams for 2.5 hour prior to placement in hypoxic chamber. The pups were exposed to a humidified, hypoxic atmosphere (8% O2, 92% N2) at 37 °C for 45 min. After this hypoxic interval the pups were returned to their dam for recovery periods.
This procedure induced a lesion including hippocampus, neocortex, and striatum. Sham controls underwent anesthesia and middle incision only. Pups from different litters were used in each experimental group. Mortality (10%) only occurred during of Hypoxic condition or immediately after HI.
2. 5-Bromo-2-deoxyuridine (BrdU) Labeling Experiment
To detect many proliferating cells, we administered the cell proliferation–specific marker 5 bromodeoxyuridine (BrdU). 50mg/kg of BrdU (Sigma, B5002) in saline was injected intraperitoneally (IP) 1 time a day. Experimental group has divided in to 4 containing p10 group which BrdU was injected at 1,2,3 days post lesion(dpl) (p8,9,10), p12 group which BrdU injected at 3,4,5 dpl (p10,11,12), p15 group which BrdU injected at 6,7,8 dpl
11
(p13,14,15) and the last group p21, BrdU injected at 11,12,13 dpl (p18,19,20). Mice were sacrificed 1h after the last injection respectively.
3. Cresyl violet staining for Detection of Neuronal Degeneration
Cresyl violet staining is commonly applied as cellular marker for cell damage, so cellular nuclear morphology in degenerating cells can be detected via this staining method. After HI insult in postnatal day 6.5 (p6.5) of mice, animals were perfused with 0.1 M PBS and fixed
with 4% paraformaldehyde in each scheduled day (1,2,4,7,14 dpl). The rapidly dissected
brains have been performed post fixation for overnight followed by tissue processing and paraffin embedding step. Paraffin-embedded brain has sectioned every 5mm thickness and these are deparaffinized in xylene and rehydrated through treating in graded ethanol series for each 3 minutes. After then, tissue has deionized in distilled water for 3 minutes again and placed in the cresyl violet solution chamber for about 5 minutes. Tissue goes through the washing step in D.W and dehydration step in 70%, 80%, 90%, 95% and 100% of ethanol in order. Lastly tissue has been kept in xylene and mounted and with an non aqueous-based mounting medium such as synthetic solution. Mid-striatal and hippocampal section were cresyl-violet stained to assess tissue damage, edema and atrophy.
4. Eriochrome Cyanine RC Staining
To confirm demyelination of hypoxic ischemic mouse model, mice were induced hypoxic ischemia at postnatal day 7 and sacrificed 2 weeks post lesion. They were perfused with 0.1M PBS and fixed with 4% paraformaldehyde for overnight and conducted tissue processing followed by embedding with paraffin. 5um coronal sectioned brain tissues pass through the deparaffination and rehydration with graded ethanol. It was stained with Eriochrome cyanine RC for 8 minutes, rinsed in running tap water for 7 minutes, placed in fresh 1% NH4OH for 2 minutes, placed in fresh DW for 2minutes, dehydrated with in clean alcohol gradient and then mounted with synthetic solution.
12
To evaluate histopathologic outcomes, mice were sacrificed and perfused with 0.1 M PBS and fixed with 4% paraformaldehyde in each scheduled day (1,2,4,7,14 dpl). Immunohistochemistry were performed with the paraffin-embedded brain. 5um of sectioned brain pass through the deparaffination and rehydration with graded ethanol. Antigen retrieval was performed following the heat induced protocol in 10mM sodium citrate buffer (pH 6.0) using a microwave oven with 5-minute cooling intervals. Section was rinsed with PBS (pH 7.4), PBS-TritonX-100(0.1%). Endogenous peroxidase activity was inactivated by 30 minutes incubation in freshly prepared 0.3% H2O2 solution diluted in D.W or methanol and then rinsed with PBS-T.
To stain BrdU, some steps should be added. For the denaturation of DNA, brain section has to be treated with 2 N HCl for 20minutes and then 0.1 M sodium boric acid (pH 9.0) for 10 minutes. After then, next steps given below are conducted.
Except in the case of BrdU, sections are rinsed with PBS-T and incubated with 10% blocking serum in PBS-T for a hour at room temperature. Slides are incubated with a
primary antibody in blocking serum for overnight at 4oC followed by further treatment of 1st
antibody at room temperature for a hour, PBS-T rinsing, incubation with biotinylated secondary antibody in blocking serum for 1hour and then rinsed with PBS-T. The signal was developed using avidin-biotin horseradish peroxidase (HRP) (Vectastain ABC Elite kit, Vector) and stained with diaminobenzidine (DAB, Sigma). Images were captured with confocal microscope and used antibody lists are shown in Table 2.
For double immune staining, sections which finished up to antigen retrieval step have rinsed with PBS-T then treated 10% of blocking solution. Two kinds of Primary antibodies
which are diluted in blocking serum have treated to the brain sections and kept in 4oC at
overnight followed by further treatment of 1st antibody at room temperature for an hour and
PBS-T rinsing. Antibody reaction was visualized with Alexa Fluor-488 and -568 conjugated anti-mouse or -rabbit secondary antibodies. Also, cells were counterstained with Hoechst. Fluorescent images were captured using a confocal laser-scanning microscope and processed using Adobe Photoshop.
13
To identify genotype of mouse we used, tail was cut, then placed into 1.5ml eppendorf tube. After addition of 300ul lysis solution which is composed of 0.025N NaOH, 0.2mM EDTA and 2.5% Triton X-100 to each tail sample, the tail sample was placed on heat block with
100oC for 1-2 hrs. When the lysate was boiled enough, DNA was precipitated from the bone,
hair by centrifugation at 12,000 rpm for 10min at 4oC followed by transference of
supernatant to new 1.5 ml eppendorf tube. Polymerase chain reation (PCR) has been performed in total 2ul volume of reaction mixture and including 2ul of 10x reaction buffer, 0.5 ul of taq polymerase, 1ul of 10mM dNTP, 1 ul of forward and reverse primers balanced with D.W, and 1ul of template DNA. Primer information and PCR condition are shown in Table 1.
7. Tamoxifen Injection
In order to induce Cre recombination in Gli1 promoter expressing cells, Gli1-CreERT2;R26R mice were orally injected with tamoxifen(Sigma,T 5648) at a dosage of 0.15 mg/g daily from postnatal day 7 (P7) to P9, from p9 to p11, and from p11 to p13. The density of stock solution was 20 mg/ml , prepared in autoclaved corn oil and stored at −4 °C.
8. Detection of Neural stem cell via X-gal staining
To detect lacZ signals which are labelled newly formed neural stem cells by Sonic hedgehog signaling following a Hypoxic-ischemic injury, X-gal staining was conducted. Carefully dissected brain, perfusion with PBS and fixation with 4% paraformaldehyde (PFA) proceed, post fixed in PFA for 2 hours at 4°C. Tissues are sliced every 2mm and
cryoprotected with 30% sucrose in PBS overnight at 4oC. These are directly moved to the
isopentane solution for about 10 seconds to freeze rapidly. The frozen sections are embedded in OCT compound (Tissue-Tek) and equipped on the cryotome machine. The temperature of
cryotome should be -21 oC and frozen sections were prepared at every 30um and subjected to
14
perform X-gal staining and representative sections were selected for further immune staining after getting X-gal positive result.
15
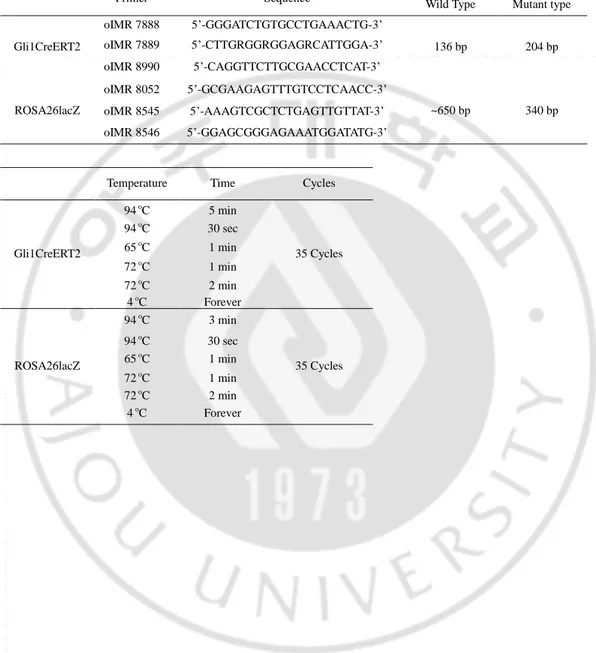
Table 1. 생쥐의 유전형을 확인하기 위한 Primer서열과 PCR 조건
Primer Sequence Size
Wild Type Mutant type Gli1CreERT2 oIMR 7888 5’-GGGATCTGTGCCTGAAACTG-3’ 136 bp 204 bp oIMR 7889 5’-CTTGRGGRGGAGRCATTGGA-3’ oIMR 8990 5’-CAGGTTCTTGCGAACCTCAT-3’ ROSA26lacZ oIMR 8052 5’-GCGAAGAGTTTGTCCTCAACC-3’ ~650 bp 340 bp oIMR 8545 5’-AAAGTCGCTCTGAGTTGTTAT-3’ oIMR 8546 5’-GGAGCGGGAGAAATGGATATG-3’
Temperature Time Cycles
Gli1CreERT2 94 oC 5 min 35 Cycles 94 oC 30 sec 65 oC 1 min 72 oC 1 min 72 oC 2 min 4 oC Forever ROSA26lacZ 94 oC 3 min 35 Cycles 94 oC 30 sec 65 oC 1 min 72 oC 1 min 72 oC 2 min 4 oC Forever
16 Table 2. 사용된 항체의 정보와 조건
Antibodies Source Dilution factor Company Catalog No. NeuN Mouse 1:100 Millipore MAB377 CNPase Mouse 1:100 Millipore MAB326R
GFAP Mouse 1:200 Sigma G3893
GFAP Rabbit 1:200 Sigma G9269
Iba1 Rabbit 1:3000 Wako 019-19741 MAP2 Rabbit 1:100 Millipore AB5622
BrdU Mouse 1:100 BD Biosciences 347580
17
Ⅲ . 결 과
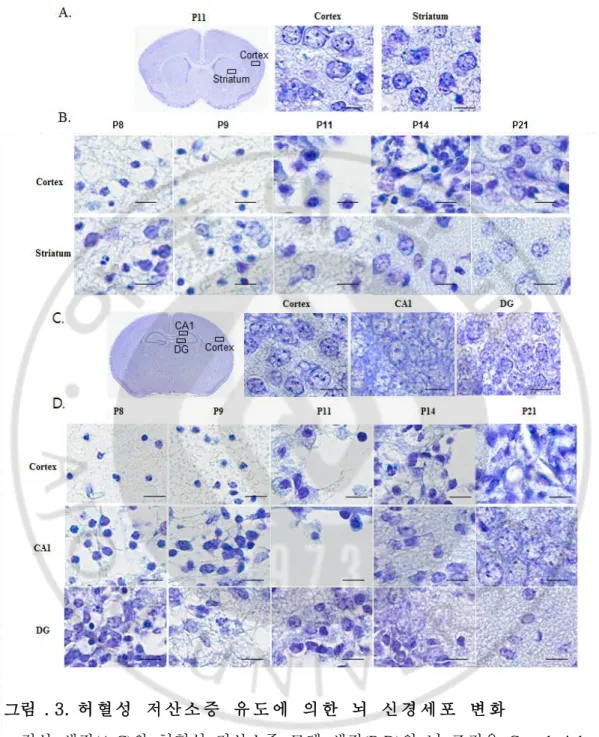
1. 허혈성 저산소증이 유도된 생후 생쥐의 뇌 재생 능력 이 결과는 생후 7일째 된 생쥐에 허혈성 저산소증(Hypoxic ischemia)을 유도 한 1, 2, 4, 7, 14일 이후의 뇌의 측면 사진과(그림.2. B) 정상 생쥐와 허혈성 저산소증 모델 각각의 뇌 조직을 여러 공정을 거친 후 파라핀으로 포매시켜 5㎛로 잘라 Cresyl violet 염색한 사진 이다(그림.2. A, B). 생후 일자에 따른 정상적인 뇌 조직 의 Cresyl violet 결과, 양쪽 반구 사이의 크기 차이 또는 염색 패턴의 차이는 확 인되지 않았다(그림.2. A). 측면을 나타낸 결과에서는, 허혈성 저산소증을 유도한 초기 시기에 동측 반구(Ipsilateral hemisphere)의 영역이 반대쪽 반구(Contralateral hemisphere)에 나타난 조직 영역(dotted line)의 색에 비해 더 밝은 색을 띄었다(그 림.2.B). 허혈성 저산소증을 유도한 4일 이후에는, 대뇌피질(Cerebral cortex)의 병변 부위(Infarct region) 조직이 허물어지고 부종(Edema) 현상이 관찰되었으며, 세포손 실이 심했던 대뇌피질의 병변 부위의 크기는 시간이 지남에 따라 줄어들고 세포 로 다시 채워지는 현상이 확인되었다. 또한 병변 유도 14일 이후(Postnatal day 21, P21)에는 대뇌피질의 공동부위(Cavity)가 깔끔하게 메워졌다(그림.2. B). 그럼에도 불구하고, 병변 유도 14일 이후(Postnatal day 11, P11), 뇌 반구의 크기를 확인한 결 과에서는 상해를 입은 동측 반구(Ipsilateral hemisphere)의 크기가 반대쪽 반구 (Contralateral hemisphere)보다 확연히 작았다 (그림.2. B). 2. 허혈성 저산소증에 영향을 받은 뇌 신경세포의 형태적 측정 생쥐에서 허혈성 저산소증에 의한 뇌의 병변 부위는 크게 해마(Hippocampus), 선조체(Striatum), 그리고 대뇌 피질(Cerebral cortex)을 들 수 있다. 이런 뇌 상해에 의해 영향을 받은 세포를 측정하기 위해서 Cresyl violet 염색이 진행되었고, 염색 된 세포를 400배로 확대하여 확인하였다(그림.3.). 정상 생쥐의 뇌 조직에서 염색18
된 안정되고 정상적인 상태(Steady state)의 신경세포들과는 달리 병변 유도 후 하 루 째 (Postnatal day 8, P8), Cresyl violet으로 염색된 신경세포들은 선조체(Striatum), 대뇌피질(Cerebral cortex), 해마(Hippocampus)부위에서 응축된 모양(Shrunken shape) 을 나타내고, 염색이 진하게 되는(Dense staining) 경향을 나타내며, 세포질 내에 공포가 형성(Vacuolation) 된다. 이러한 경향을 보이는 세포의 집단은 Apoptotic, Pyknotic 세포사멸(Cell death)을 거치고 있음을 의미하며, 손상된 뇌의 세포들은 병변 유도 후 4일(Postnatal day 11, P11)까지 계속적으로 모양을 변화시키고, 결국 엔 사라지게 되어 세포가 가득 메워졌던 영역에서 부종(Edema)현상을 나타내었 다 (그림.3.B.D). 병변 유도 후 14일째에는 대뇌 피질 부위의 손상 핵심부위(Core region)와 그 주변부(Penumbra)에서 정상적인 모양의 진핵을 가진 신경세포들 (Euchromatic neurons)이 확인되었다(그림.3. B,D). 반면에 해마의 CA 영역은 허혈 성 저산소증 환경에 가장 취약한 부위로 손상이 매우 심한 경우에는 재생, 회복 이 되지 않음을 확인 하였다 (그림.3. B,D). 3. 허혈성 저산소증 유도 2주 후의 대뇌 피질 부위의 신경세포와 교세포 생후 7일된 생쥐에 허혈성 저산소증을 유도할 경우, 동측성의 대뇌 피질부위에 서 극심한 세포 손실과 부종(Edema)현상을 손상 유도 4일 후 확인 하였다. 그러 나, 시간이 지남에 따라 손상된 부위의 영역이 줄어들며, 정상적인 세포로 다시 메워짐을 확인 하였다 (그림.3. B,D). 세포 손실이 관찰되었던 부위를 채운 신생된 세포의 특성을 확인하기 위해서, 대뇌 피질의 재생이 확인된 손상 유도 후 14일 째의 뇌 조직(Postnatal day 21, p21)을 가지고 면역조직화학 염색법 (Immunohistochemistry)를 실시하였다(그림.4.). 사용된 항체는 각각 성숙한 신경세 포 (Mature neuron)를 염색하기 위한 NeuN, 성숙한 희소돌기 아교세포(Mature oligodendrocyte)를 염색하기 위한 CNPase, 그리고 성숙한 성상교세포(Mature astrocyte)를 염색하기 위한 GFAP 이다 (그림.4.). 그 결과, 손상 동측성 반구 (Ipsilateral hemisphere)의 피질(Cortex) 부위에서 모여있는 NeuN+ 그리고 GFAP+
19 세포들을 확인하였으며, 모여있는 패턴 또한 매우 불규칙하였다. 반면에 손상 받 았던 영역인 피질(Cortex) 부위에서 CNPase에 염색된 희소돌기아교세포 (Oligodendrocyte)들은 허혈성 저산소증을 유도하지 않은 정상 뇌조직과 비교하여 큰 차이점이 발견되지 않았으며, 두 집단 모두의 결과에서, 염색된 뇌의 피질영 역의 희소돌기세포는 방사상을 지향(Radially oriented) 하는 모습임을 확인하였다. (그림.4). 4. 허혈성 저산소증 이후의 탈수초 현상 탈수초(Demyelination)란 신경세포돌기를 감싸는 미엘린(Myelin) 또는 미엘린(Myelin)을 생성하는 희소돌기아교세포(Oligodendrocyte)가 염증, 순환장애, 변성 등 여러 가지 원인으로 신경세포가 상해 될 때 파괴되는 현상이다. 이 탈수초(Demyelination) 현상은 허혈성 저산소증 손상유도 14 일 이후의
대뇌피질(Cerebral cortex) 부위에서 CNPase 결과에서 확인하기 어려웠지만 (그림.4.), Eriochrome Cyanine 염색을 통해 뇌 백질 안쪽 영역의 섬유 영역에서 확인할 수 있었다(그림.5.). 따라서 미성숙한 생쥐에서의 허혈성 저산소증 유도는
뇌 백질 손상(White matter injury)을 관찰하기에 적절한 모델이라 말할 수 있다.
5. 허혈성 저산소증 이후의 반응성 신경교증
허혈성 저산소증에 의한 포도당(Glucose)과 산소공급(Oxygen supplying)의 결핍 은 미세아교세포(Microglia)와 휴면기의 성상교세포(Dormant astrocyte)가 형태적으 로 변하며 활성을 띄게 한다. 미세아교세포(Microglia)와 성상교세포(Astrocyte)는 CNS에서 질병 그리고 상해 정도를 판단하기에 좋은 척도로 쓰이며, 이들 세포들 이 상해에 의하여 형태적으로 변하며 활성을 띄는 현상을 반응성 신경교증 (Reactive gliosis)라 한다. 허혈성 저산소증에 의한 반응성 신경교증(Reactive gliosis) 를 확인하기 위해 본 연구에서는 생후 7일된 생쥐에 허혈성 저산소증을 유도한 각각 1, 2, 4, 7, 14일 이후의 뇌 조직을 가지고 면역조직화학법(Immuno
20
histochemistry)염색을 하여 성상교세포(Astrocyte)와 미세아교세포(Microglia)의 발 현과 그들의 모양 변화 패턴을 확인하였다(그림.6.). 그 결과, 휴면기의 성상교세 포(Astrocyte) 활성은 허혈성 저산소증 손상을 받은 이틀 뒤(Postnatal day 9, P9)부 터 동측성의 대뇌 피질부위(Ipsilateral cerebral cortex)에서 심해짐을 확인하였으며, GFAP로 염색된 세포는 팽창되어 크기가 커지고, 그를 둘러싼 돌기 들은 매우 두 꺼워지며 세포와 세포 사이에 공포가 많이 형성(Vacuolization)됨을 확인할 수 있 었다(그림.6. B). 이러한 현상은 손상 유도 후 4일 (Postnatal day 11, P11)까지 지속 적으로 보였으며, 극심한 세포 손실(Cell loss)이 관찰되었다. GFAP에 염색된 세포 들은 손상 후 7일(Postnatal day 14, P14)째, 차츰 안정된 형태로 변화하며 세포가 사라졌던 사이 사이로 근처에 있는 세포끼리 서로 다리를 놓으며 연결 되어 있 었다 (그림.6.B). 더하여, 손상 유도 14일 이후(Postnatal day 21, P21)에는 동측성의 대뇌 피질(Ipsilateral cerebral cortex)의 여러 부위에서 분지(Branching)는 되어있지 않으나 돌기(Process)들이 얇고 길며, 서로 모여있는 GFAP가 염색된 성상교세포
(Astrocyte)들을 확인 할 수 있었다. (그림 .6. B)
미세아교세포(Microglia)와 대식세포(Macrophage)를 염색하는 Iba1을 이용한 면역 조직화학염색(Immunohistochemisty) 결과에서는, 허혈성 저산소증 유도 하루 뒤(P8) 부터 염색된 세포의 크기가 정상 뇌의 조직에서 확인 된 세포들에 비해 팽창되 기 시작하였고, 이틀 뒤(P9) 이들 염색된 세포들의 크기는 하루 뒤(P8)에 비해 두 배 이상이었다(그림.6. C). 이 시기에 염색된 Iba1+ 세포들은 아메바성 형태 (Ameboid form) 형태를 나타내고, GFAP결과와 마찬가지로 세포와 세포 사이로 많 은 공포들이 형성 되었으며, 4일 째 (P11)에는 심한 세포 손실을, 7일 후에(P14)는 돌기를 가진 세포들이 염색되었다. 허혈성 저산소증 유도 2주 뒤(P21), 흥미롭게 도 손상 받은 핵심 부위(Core region)의 Iba1+ 세포들은 정상 생쥐의 동일 부위에 서 확인된 세포들이 보이는 같은 패턴으로 염색됨을 확인하였다(그림.6. C).
6. 허혈성 저산소증 이후의 세포 증식
21 아있는 유기체에서 증식하는 세포들을 표지 할 수 있다. 본 연구에서는 허혈성 저산소증에 의해 심각한 세포 손실과 부종(Edema) 현상을 보였던 대뇌 피질 (Cerebral cortex)부위가 손상 유도 2주 후, 다시 메워지는 현상을 확인하였는데, 이 현상을 특정 부위에서 새로 생겨나고 손상부위로 이동하여 신경세포(Neuron) 또 는 교세포(Glia)로 분화된 세포들에 의한 것 일거라고 추측하였다. 이 세포들의 기원을 확인 하고자, 정상 생쥐와 질병 모델 생쥐를 각각 세 집단으로 나누어 생 쥐 무게 1kg당 50mg의 BrdU를 하루에 한 번, 3일 동안 복강을 통해 (Intraperitoneally, IP) 주입 하였다. BrdU는 각각 허혈성 저산소증을 생후 7일째 유 도한 후 각각 (1, 2, 3일), (6, 7, 8일), (11, 12, 13일) 집단으로 나누어 3일 동안 주사 하여 주었고, 마지막 주사 1시간 이후 마취시켜 뇌 조직을 적출 하였다. 각 생쥐 의 뇌 조직은 조직 공정(Tissue processing)을 거쳐, 파라핀(Paraffine)으로 포매 (Embedding) 한 후, 5㎛로 절편(Section) 되었다. 이 조직을 이용해 BrdU 항체를 이용한 면역조직염색법(Immunohistochemistry)을 시행 하여 새로 증식하는 세포들 (Proliferating cells)을 확인하였다(그림.7.). 이 결과를 통하여, BrdU를 투여한 집단 중, 허혈성 저산소증을 유도한 1, 2, 3일 이후에 새로 생겨난 세포들이 같은 조건 의 BrdU를 처리해 준 정상 생쥐들 보다 치아 이랑(Dentate gyrus), 측뇌실(Lateral ventricles)의 뇌실하 영역(Subventricular zone), 그리고 뇌량하 영역(Subcallosal region)에서 가장 많이 증가함이 확인되었다(그림.7.). 또한 손상 유도 후 1, 2, 3일 에 증식한 세포들 보다는 더 적은 세포들이 두 번째 집단 (6, 7, 8일 발생)에서 확 인되었으며, 11, 12, 13일에 새로 생겨난 세포들은 정상 생쥐에 비교하여 차이가 없었다(그림.7.). 7. 허혈성 저산소증 유도에 따른 신경 줄기세포의 증가 우리는 앞서 얻은 결과(그림.7.)로부터 손상된 대뇌 피질 부위를 재생시키기 위한 세포 증식(Cell proliferation) 현상이 가장 활발한 시기를 유추해 낼 수 있었다. BrdU 결과에 따르면, 상해를 입은 뒤 이른 시기에 세포들이 활발하게
22
증식하였기에 이 시기가 대뇌피질(Cerebral cortex) 부위의 자연 치유(Endogenous regeneration)를 위한 중요한 시기라 판단되었다. 또한 손상 유도 이후 증식한 세포들의 타입에는 미세아교세포(Microglia)를 포함하여 여러 가지가 있겠지만, 신경줄기세포 (Neural stem cell) 또한 증식하고, 손상 부위로 이동하고, 신경세포(Neuron) 또는 교세포(Glial cell)로 분화하여 세포 손실이 매우 컸던 대뇌피질(Cerebral cortex) 부위를 채웠을 거라고 생각하였다. 따라서 허혈성 저산소증을 유도한 이후 1, 2, 3일 그리고 6, 7, 8일에 각각 BrdU를 주입하였고, 조직 재생이 이루어진 시기인 손상 유도 2주 뒤 (P21), 생쥐 뇌 조직을 적출하여 몇 가지 공정을 거친 후 면역조직염색법을 시행하였다. 손상 유도 2주 뒤 (Postnatal day 21, P21), 새로 증식되어 대뇌피질로 이동한 세포의 수와 정상 생쥐에서 확인된 세포의 수에서 큰 차이점을 확인 할 수 없었고, BrdU와 각각 NeuN, CNPase, GFAP로 이중 면역조직염색법(Double immunohistochemistry)을 시행한 결과, 동등 표지(Co-labelling)된 세포들을 확인하기는 어려웠다 (Data is not
shown). 다른 연구에서 확인된 바에 따르면, 줄기세포연구(Stem cell
research)에서의 BrdU 사용에는 세포가 분화하는데 영향을 끼치거나
방해한다라는 내용이 발표된 바가 있어, 본 연구에서는 새로 증식된 세포의 분화 형태를 확인하기 위해, BrdU를 사용 하는 것 대신 Gli1을 유전적으로 변형시킨
Gli1-CreERT2 생쥐를 가지고 실험을 진행하였다.
Gli1은 소닉헤지호그 신호전달 (Sonic hedgehog signaling)에 연관된 단백질 중
하나로 신경줄기세포(neural stem cell)의 증식(Proliferation) 또는 분화
(Differentiation)에 관여하기 때문에 이 유전자 변형 생쥐를 이용한다면, 대뇌 피질이 재생되는 현상을 일부 확인할 수 있을 것 이라고 생각하였다. 소닉헤지호그경로 (Sonic hedgehog pathway)에 반응하는 신경 줄기세포(Neural stem
cell)를 조직학적으로 확인하기 위하여, Gli1-CreERT2 유전자 변형 생쥐는 Rosa
floxed-stop-lacZ (R26R)와 교배되었고, 이 Gli1-CreERT2::R26R 유전자변형
(Transgenic, TG) 생쥐를 이용하여 Tamoxifen을 주입한 시기에 발현하는
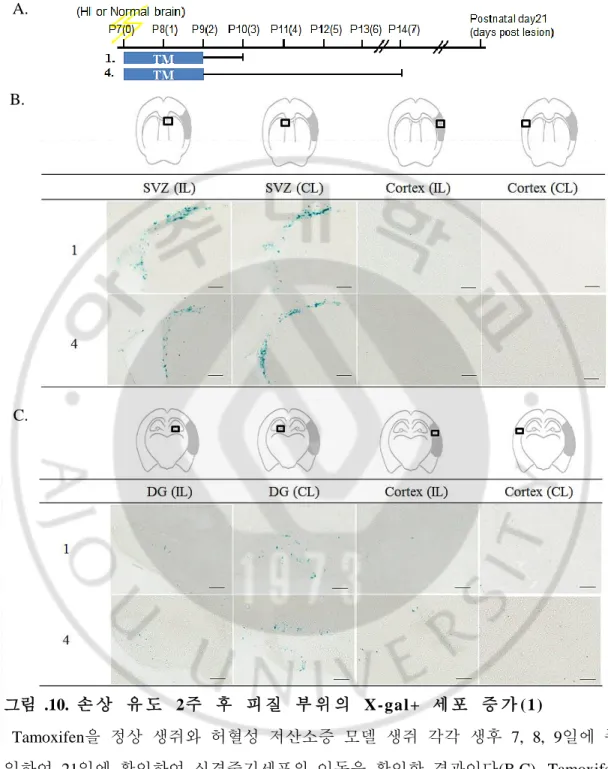
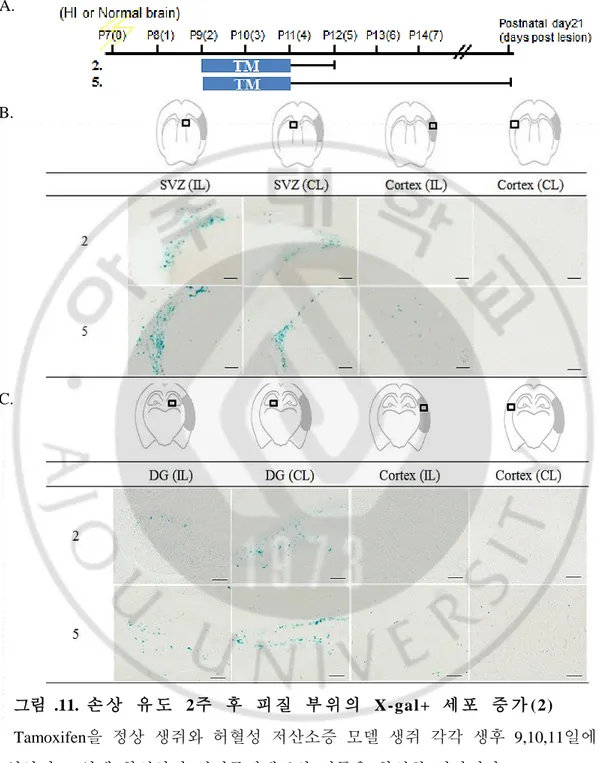
23 정상 생쥐와 허혈성 저산소증 유도 생쥐는 Tamoxifen의 주입 시기에 따라 각각 세 집단으로 나누어 졌는데, 기존 BrdU 결과에서 손상 유도 후 1, 2, 3일 그리고 6, 7, 8일에 증식한 세포들이 많았던 것을 토대로 이 두 시기 사이를 세 집단으로 나누어 Tamoxifen을 투여하여 준 것이다. Gli1-CreERT2 ::R26R TG mouse에서 소닉헤지호그경로(Sonic hedgehog pathway)에 반응하는 신경줄기세포(Neural stem cell)는 Tamoxifen 주입 20시간 이후에 lacZ를 발현한다는 기존 연구결과의 언급에 따라 본 연구에서는 Tamoxifen을 BrdU를 주입한 시기 하루 전부터 3일 동안 경구투여 해 주었다. 따라서 Tamoxifen은 각각 생후 7일째 허혈성 저산소증을 유도한 생쥐와 정상 생쥐에 각각 (0, 1, 2일), (2, 3, 4일), (4, 5, 6일) 집단으로 나누어 3일 동안 경구 투여하여 주었고, 마지막 투여 24시간 후 뇌 조직을 적출해 30㎛로 동결절편(Cryosection) 하여 X-gal 염색을 하였다. 그 결과, 정상 생쥐에 비해서 허혈성 저산소증을 유도한 뇌의 치아 이랑(Dentate gyrus)과 뇌실하 영역(Subventricular zone)에서 신경줄기세포(Neural stem cell)들이 유의성 있게 증가 되었다(그림.9. B,C). 세 집단 중 (0, 1, 2일), (2, 3, 4일)에 Tamoxifen을 투여해 준 집단에서 정상 생쥐에 비해 유의성 있게 증가된 신경줄기세포(Neural stem cell)의 발현을 확인하였고, 이러한 변화는 손상 동측성 반구(Ipsilateral
hemisphere)와 반대측 반구(Contralateral hemisphere) 모두에서 동등하게
확인되었다(그림.9. B,C). 이뿐만 아니라 (0, 1, 2일) 또는 (2, 3, 4일)에 Tamoxifen을 투여하고 2주 뒤(p21)에 뇌 조직을 적출해 X-gal 염색을 한 결과에서는, 정상 생쥐에서의 결과에 비교하여 lacZ로 표지 된 세포들이 대뇌 피질(Cerebral cortex)에 많이 존재함을 확인하였고(그림.10,.11.), 이들 세포의 양은 Tamoxifen을 2, 3, 4일에 투여 하였을 때 가장 많았다(그림.11.). 더하여, 허혈성 저산소증 모델의 손상 반대측 반구(Contralateral hemisphere)의 대뇌피질 (Cerebral cortex)에 존재하는 lacZ로 표지 된 세포들에 비해, 동측성 반구(Ipsilateral hemisphere)의 피질(Cortex) 부위에서 확인되는 세포들이 훨씬 많았다(그림.11 B,C.). 하지만 손상 유도 2주 뒤 피질영역에서 확인된 세포들은 어디로부터 이동 되어 온 것인지, 손상 정도가 심했던 대뇌 피질의 환경의 영향으로 스스로 증식 했는지에 대한
24 것 등 세포의 기원에 대해서는 확인하기 어려웠다. 8. 대뇌 피질에서 확인된 X-gal+ 세포들의 타입 생후7일 Gli1-CreERT2 ::R26R TG 생쥐에 허혈성 저산소증을 이후 (0, 1, 2일), (2, 3, 4일)에 발현하고, 2주 뒤(Postnatal day 21, P21) 대뇌피질(Cortex) 부위에서 확인된 세포들의 타입이 무엇인지 확인하기 위하여 손상유도 이후 14일이 지난 생쥐 (Postnatal 21, P21) 뇌 조직을 가지고 X-gal 염색을 진행 한 후, 면역조직화학염색 법(Immunohistochemistry)을 실시 하였다(그림.12.). 이들 세포를 확인하기 위해 쓰 여진 항체로는 각각 신경세포(Neuron)을 염색하기 위한 NeuN, 희소돌기아교세포 (Oligodendrocyte)를 염색하기 위한 CNPase, 성상교세포(Astrocyte)를 염색하기 위 한 GFAP가 있다. 그 결과, P21에 대뇌 피질(Cerebral cortex) 부위에서 확인된 X-gal+한 세포들은 신경세포(Neuronal cell)와 교세포(Glial cell) 모두로 분화함이 확인 되었고, 대부분은 성상교세포(Astrocyte)의 marker인 GFAP와 동등표지(Co-labeling) 됨을 확인하였다(그림.12.).
9. 재 생 된 대 뇌 피 질 부 위 에 존 재 하 는 신 경 줄 기 세 포
생후 7일된 생쥐에 허혈성 저산소증을 유도한 2주 후의 조직을 가지고 Cresyl violet을 염색 한 결과, 재생된 대뇌 피질(Cerebral cortex) 부위에서 군데군데 서 로 모여 있는 염색된 세포들을 확인할 수 있었다(그림.13. A). 면역조직화학 염 색(Immunohistochemistry)을 하여 이들의 세포 타입을 확인한 결과, 이들은 GFAP+한 성격을 띄었고, 성상교세포(Astrocyte)와 신경줄기세포(Neural stem cell) 모두를 염색하는 GFAP의 특징상, 대뇌피질에서 염색된 세포들이 성상교세포 (Astrocyte)가 아닌 신경줄기세포(Neural stem cell)인지 확인하기 위해, 면역형광염 색법(Immunofluorescence)을 통하여 신경줄기세포(Neural stem cell)를 표지 하는 Sox2와 이중염색(Double staining) 하였다(그림.13. B). 그 결과, 생후 21일의 정상
25
생쥐의 대뇌 피질보다 허혈성 저산소증 모델의 대뇌피질(Cerebral cortex)에서 확 인된 Sox2+ 신경줄기세포(Neural stem cell)가 두 반구 모두에서 증가하였고, 이들 세포들은 정상 생쥐에서 확인된 세포들과는 달리 GFAP도 함께 발현하였다. 더 하여, 손상 동측성 반구(Ipsilateral hemisphere)의 대뇌피질(Cerebral cortex) 부위에 서는 이들 이중으로 염색(Double staining)된 세포들이 군데군데 서로 모여서 존 재하는 것이 확인되었다(그림.13. B). 이러한 다른 염색 패턴을 보이는 신경줄기 세포가 상해에 의해 활성화되고, 조직의 재생에 어떻게 기여하는지는 더 확인해 야 할 부분이다.
26
그 림 .1. 생 쥐 를 이 용 한 허 혈 성 저 산 소 증 유 도 방 법
생 후 7일 째 의 수 컷 생 쥐 에 허 혈 성 저 산 소 증 을 유 발 하 기 위 해 호 흡 마 취 를 실 행 하 였 고 , 총 경동맥 결찰술(Common carotid artery ligation)을 실시한 후 2.5 시간의 회복 시간을 준 후 저 산소(Hypoxic) 조건 (8% O2, 92% N2, 37°C)에 노출시켰다. 허혈성 저산소증 유도 생쥐들은 대리모에게 돌려 보내어 돌봄을 받 게 한다. 이후 각 세포의 변화를 확인하고자 계획했던 생후 일자에 따라 희생시 킨다.
27 그 림 .2. 허혈성 저산소증 생쥐의 뇌 재생 능력 생후 일자에 따라 얻은 정상 생쥐와(A) 허혈성 저산소증 모델 생쥐(B)의 뇌 조 직을 Cresyl violet으로 염색한 결과이다. 정상 생쥐의 뇌 조직은 조밀하고 온전한 염색 패턴을 보이는(A) 반면에 허혈성 저산소증을 유도한 생쥐의 경우 동측성 뇌 반구에서 심각한 세포 손실이 확인 되었다(B). 점선으로 표시된 세포 손실이 확인 되었던 대뇌 피질 손상 영역은 시간이 지남에 줄어 들고 손상 유도 14일 이후 깔끔하게 메워졌다(B).
28
그림 . 3. 허 혈 성 저 산 소 증 유 도 에 의 한 뇌 신 경 세 포 변 화
정상 생쥐(A.C)와 허혈성 저산소증 모델 생쥐(B,D)의 뇌 조직을 Cresyl violet 으 로 염색하고 400배로 확대하여 확인한 결과이다. 정상 생쥐와는 달리, 허혈성 저 산소증 생쥐 뇌의 일부 영역에서 응축된 모양, 진한 염색 패턴, 공포가 형성된 신경세포들이 확인되었다(B,D). Scale bar=10㎛
29
그림 .4. 재 생 된 대 뇌 피 질 영 역 에 존 재 하 는 세 포
허혈성 저산소증 손상 유도 14일 이후 생쥐의 뇌 조직을 가지고, 각각 CNPase, NeuN 그리고 GFAP를 면역조직화학염색을 한 결과이다. 정상 생쥐에 비해, 손상 동측 부위(Ipsilateral region)의 피질(Cortex) 부위에서 모여있는 NeuN+ 그리고 GFAP+ 세포들을 확인하였으며, 그 세포가 존재하는 패턴 또한 매우 불규칙 함을 확인 하였다. 반면에 재생된 피질(Cortex) 부위에서 CNPase에 염색된 세포들은 정 상 뇌 조직과 비교하여 큰 차이점이 발견되지 않았다. Scale bar=50㎛
30 그림 .5. 허혈성 저산소증 이후의 탈수초 현상 허혈성 저산소증 손상유도 14일 이후의 뇌 조직을 가지고 Eriochrome Cyanine 염색을 한 결과이다. 생후 21일째 정상 생쥐와 허혈성 저산소증 모델 생쥐의 뇌 를 비교하였을 때 손상 모델 동측성 반구의 뇌 백질 부위의 염색 패턴이 반대 반구와 정상 생쥐의 결과와 다른 것이 확인되었다(A,B). 이를 5배 확대한 결과 (a,b,c), 정상생쥐(a)와 손상 모델 반대측 반구(c)에서 확인된 탈수초 정도에 비하 여, 손상 동측성 반구의 뇌 백질 안쪽 영역의 섬유 영역(b)에서 심각한 탈수초 현상이 확인되었다. * P: Postnatal day A. B. a. b. c.
31
그림.6. 허혈성 저산소증 이후의 반응성 신경교증
허혈성 저산소증 유도 각각 1, 2, 4, 7, 14일 이후의 뇌조직의 성상교세포(B)와 미
세아교세포(C)를 염색하였다. 관찰된 세포들은 Hippocampal level의 피질 부위(A) 에 존재하는 것이고, 이들 세포들은 손상 유도 후 모양을 변화 시키며 활성화 되 는 현상을 보이고 2주 후에는 안정된 형태로 변화한다(B,C). 이러한 변화는 손상 된 부위의 대뇌 피질 부위에서 가장 많이 관찰되었다. Scale bar= 25㎛ A. B. C.
32 그림. 7. 허혈성 저산소증 이후의 세포 증식 손상된 부위를 재생시킨 여러 세포들의 기원을 확인하고자 BrdU assay를 진행 하였다. BrdU 항체를 이용한 면역조직염색법을 시행 하여 새로 증식하는 세포들 을 확인한 결과, BrdU를 투여한 집단 중, 허혈성 저산소증을 유도한 1, 2, 3일 그 리고 6, 7, 8일 이후에 새로 생겨난 세포들이 같은 조건의 BrdU를 처리해 준 정상 생쥐들 보다 치아 이랑, 측뇌실의 뇌실하 영역, 그리고 뇌량하 영역에서 가장 많 았음을 확인 하였다.
33
그림. 8. Gli1-CreERT2
;R26R 생쥐에서의 재조합 활성
LacZ는 Tamoxifen을 주입한 시간에 Sonic hedgehog 신호전달에 반응하여 생겨나 는 신경줄기세포를 특이적으로 표지한다. 따라서, 특정시기에 발현하는 신경줄기 세포들을 확인하는 것이 가능하다(A). X-gal+ 세포들은 Sox2와 동등표지 되므로 신경줄기세포임이 증명 되었다(White arrows in B). Scale bar=50㎛
A.
34
그림 .9. 허혈성 저산소증 유도에 따른 신경 줄기세포의 증가
생쥐의 대뇌를 시상면으로 자른 도식과 그림(9-B,C)에서 보이는 관상면으로 자 른 부위의 도식(A, a, b)이다. 허혈성 저산소증 유도 후, 정상 생쥐보다 증가된 X-gal+ 세포들이 신경발생지역에서 확인되었다(B,C). Scale bar=100㎛
* IL :Ipsilateral region, CL: Contralateral region, TM: Tamoxifen A.
B.
C.
B.
35
그림 .10. 손 상 유 도 2주 후 피 질 부 위 의 X-gal+ 세 포 증 가 (1)
Tamoxifen을 정상 생쥐와 허혈성 저산소증 모델 생쥐 각각 생후 7, 8, 9일에 주 입하여 21일에 확인하여 신경줄기세포의 이동을 확인한 결과이다(B,C). Tamoxifen
투여 후 2주 뒤, 정상 생쥐에 비하여 허혈성 저산소증 모델 생쥐의 대뇌피질에서
증가된 X-gal+ 세포들이 확인되었다(B,C). Scale bar=100㎛ A.
B.
36
그림 .11. 손 상 유 도 2주 후 피 질 부 위 의 X-gal+ 세 포 증 가 (2)
Tamoxifen을 정상 생쥐와 허혈성 저산소증 모델 생쥐 각각 생후 9,10,11일에 주 입하여 21일에 확인하여 신경줄기세포의 이동을 확인한 결과이다(B,C). Tamoxifen 투여 후 2주 뒤, 정상 생쥐에 비하여 허혈성 저산소증 모델의 대뇌피질에서 증가 된 X-gal+ 세포들이 확인되었다(B.C). Scale bar=100㎛
A.
B.
37 그림 .12. 손 상 유 도 2주 후 피 질 부 위 의 X-gal+세 포 분 화 타 입 허혈성 저산소증 유도 후 생후 9,10,11에 Tamoxifen을 투여하여 얻은 증가된 신 경 줄기세포들이 손상 유도 2주 후 재생된 대뇌 피질부위에서 확인 되었는데, 이 세포들의 타입을 확인하고자 gal 염색 후 면역조직화학염색을 진행하였다. X-gal+ 세포들은 신경세포와 교세포 모두로 분화 할 수 있음이 확인되었다. Scale bar=100㎛
38 그림 .13. 재 생 된 대 뇌 피 질 부 위 에 존 재 하 는 신 경 줄 기 세 포 생후 7일된 생쥐에 허혈성 저산소증을 유도한 2주 후의 조직을 가지고 Cresyl violet을 염색 한 결과(A)와 재생된 대뇌 피질 부위에서 확인되는 서로 모여서 존 재하는 세포들의 타입을 면역형광염색을 통해 확인한 결과(B)이다. 생후 21일의 정상 생쥐의 대뇌 피질에서 보다 허혈성 저산소증 모델의 대뇌 피질에서 확인된 Sox2+ 신경줄기세포가 두 반구 모두에서 증가하고, GFAP+와 이중으로 염색되었 다(B). 또한 손상 동측성 부위의 대뇌피질에서는 이들 이중으로 염색된 세포들이 모여서 존재하였다(B). A. B.
39