나노 세라믹재료
특 집
CERAMIST
1. 서론
기존의 화석연료 기반의 에너지원을 대체할 수 있는 지 속 가능하고 친환경적인 에너지원에 대한 연구가 최근 활 발히 이루어지고 있다. 태양에너지, 풍력에너지, 조력에너 지 등 다양한 대체 에너지원들이 제안되었지만 에너지를 얻을 수 있는 조건이 한정적이고 생성한 에너지를 그대로 저장할 수 없는 단점이 있다. 반면, 수소 에너지는 외부 조건에 상관없이 물을 전기 분해하여 쉽게 얻을 수 있으 며, 수소의 형태로 에너지를 저장할 수 있기 때문에 화석 연료를 대체할 수 있는 에너지원으로서 큰 주목을 받고 있다. 또한, 수소에너지는 연소 과정에서 물이 생성되기 때문에 친환경적이고 에너지 밀도가 약 142 kJ/g 수준으 로 석유(46 kJ/g)나 천연가스(47.2 kJ/g)에 비해 월등히 우수하다는 특징을 갖는다.
2. 물 분해의 원리
물 전기분해를 통해 전기에너지를 물 분자에 가하면 수 소와 산소 분자가 생성되며, 전체 반응식은 아래와 같이 표현된다.
전체 반응은 수소 발생 반응(HER,
Hydrogen Evolution Reaction)과 산소 발생 반응(OER, Oxygen Evolution Reaction)의 두 가지의 반쪽 반응으로
이루어지며, 수소 발생 반응은 환원 전극, 산소 발생 반 응은 산화 전극에서 각각 일어난다. 각 반쪽 반응식은 일 반적으로 아래와 같이 표현된다.
각 반쪽 반응의 전위는 표준 수소 전극(NHE, Normal Hydrogen Electrode) 기준으로 표현 가능하며, pH에 따 라 전위 값이 변화한다. 하지만, 전체 반응의 관점에서 보 면 pH에 따른 효과는 서로 상쇄되기 때문에, 열역학적으 로 물 전기분해는 pH에 상관없이 1.23 V에서 일어난다.
그런데 실제로 1.23 V를 가하면 반응 속도가 매우 느 리기 때문에 물 전기 분해가 거의 일어나지 않는다. 따라 서 실제로 물 전기 분해를 통해 수소를 생산하기 위해서 는 1.23 V 이상의 과전압(overpotential, η)이 필요하다. 그 림 1. (a)과 같이 과전압이 클수록 수소와 산소 발생량은 기하급수적으로 증가한다. 물 전기 분해시 환원 전극에 흐 르는 전류(ia)와 산화 전극에 흐르는 전류(ic)가 에너지 보 존의 측면에서 같아야 하며, 이 때 각 전극에 걸리는 과 전압은 전극 재료의 특성에 따라 달라질 수 있다. 또한, 전해질의 전기 전도도나 이온 이동성에 의한 추가적인 저 항 요소(Rs)가 발생하며, 이러한 요소들을 고려하여 물 전 기 분해 시 필요한 전체 과전압 ηtot은 아래와 같이 표현
물 전기 분해로부터 수소 생산을 위한 망간 기반의 물 산화 촉매
글 _ 장우제, 서홍민, 하헌진, 조강희, 진경석, 남기태 서울대학교 재료공학부
(1)
(2)
(3)
장우제, 서홍민, 하헌진, 조강희, 진경석, 남기태
특 집
CERAMIST
된다.
과전압이 높을수록 더 많은 양의 수소를 생산할 수 있 지만 그만큼 전기 에너지 비용도 증가한다는 문제가 발생 하는데, 이 때 각 전극의 반쪽 반응에 필요한 과전압을 줄일 수 있다면 낮은 과전압에서도 충분한 양의 수소를 생산해 낼 수 있다. 이러한 이유로 수소 발생 반응과 산 소 발생 반응에서 과전압을 줄일 수 있는 촉매 개발과 연 구가 필요하며, 일반적으로 물 전기 분해 회로에 10 mA/
cm2의 전류 밀도가 흐를 때 걸리는 과전압을 기준으로 촉 매 재료간 물 전기 분해 특성을 비교한다.
한편, 물 전기 분해 장치는 Fig. 1. (b)와 같이 환원 전 극과 산화 전극 사이에 선택적으로 이온을 통과시키는 고 분자 막을 삽입하여 각 반쪽 반응의 구역을 분리한 two compartment cell이 산업적으로 가장 많이 사용되고 있 다. 전극 사이에 고분자 막을 삽입함으로써 각 전극에서 발생한 수소와 산소가 다시 물로 결합하는 반응을 막을 뿐만 아니라 수소의 순도를 비약적으로 향상시키기 때문 에 수소 생산 효율이 향상되는 특징이 있다.
3. DOE 목표
미국 Department of Energy(DOE)는 연료 전지 및 수 소 에너지 기술과 관련하여 최근 연구 동향을 분석하여 향후 기술 수준을 예측하고 있으며, 이를 주기적으로 반 영하여 관련 기술들의 구체적인 목표 달성치를 제시하고 있다. 이러한 기술적 목표 달성치를 DOE 목표(DOE target)
라고 하며, DOE 목표는 신재생 에너지 관련 연구의 방향 과 목표를 설정하는 데에 있어 중요한 지표로 작용한다.
특히, DOE는 수소에너지 기술과 관련하여 수소 생산, 전 달, 저장의 세 부분으로 구분하여 DOE 목표를 각각 제시 하고 있으며, 2020년까지 1kg 수소당 44.7 kWh의 에너 지 소모량을 물 전기분해를 통한 수소 생산 기술의 DOE 목표로 제시하고 있다.
일반적으로 물 전기분해 장치의 시스템 에너지 효율은 100 mA/cm2 기준으로 생성된 수소의 총 에너지를 물 전 기분해를 위해 사용한 총 에너지로 나눈 값으로 정의한다.
전기에너지가 모두 수소 생산에 기여하였다는 가정 하에 1kg 수소당 44.7 kWh의 에너지 소모량을 달성하기 위해 필요한 과전압을 계산하면 100 mA/cm2 기준에서 450 mV 의 과전압이 필요하다. 다시 말해, 2020년 DOE 목표를 달성하기 위해서는 물 전기분해 회로에 100 mA/cm2의 전 류밀도가 흐를 때 450 mV 수준의 전체 과전압이 걸릴 수 있는 수소 및 산소 발생 촉매의 개발이 필수적으로 필 요하다.
4. 산소 발생 촉매 연구의 필요성
물 전기분해시 필요한 전체 과전압을 줄이기 위해서는 수소 및 산소 발생 반응시 걸리는 과전압을 모두 줄여야 만 가능하다. 수소 발생 반응의 경우, 반응 메커니즘이 산 소 발생 반응에 비해 단순하기 때문에 100 mA/cm2 기준 100 mV 수준의 낮은 과전압의 우수한 수소 발생 촉매가 다수 존재한다. 반면, 산소 발생 반응의 경우, 반응 메커 니즘이 복잡하고 반응간 다양한 중간물들이 형성되기 때 문에 산소 발생 촉매들은 일반적으로 100 mA/cm2 기준 400 mV 수준의 높은 과전압을 갖는다. 예를 들어, 대표 적인 수소 발생 촉매인 백금(Pt) 의 경우 100 mA/cm2 기 준 60 mV 의 특성을 보이는 반면, 산소 발생 반응의 대 표적인 촉매인 이리듐(Ir)의 경우 100 mA/cm2 기준 330 mV의 특성을 보인다.1,2) 따라서 수소 발생 촉매에 견줄 만한 낮은 과전압을 가지는 산소 발생 촉매 개발과 연구 가 고효율의 물 전기분해 장치를 위해 극복하여야 할 큰 (4)
(5)
Fig. 1. (a) 물 전기 분해에 필요한 과전압. (b) 물 전기 분해의 모식도.
CERAMIST
물 전기 분해로부터 수소 생산을 위한 망간 기반의 물 산화 촉매
도전 중 하나이며, DOE 목표를 달성하기 위해 필수적으 로 해결되어야 할 과제이다.
5. 자연계에서의 물 산화 반응
자연계 역시 광합성을 통한 포도당 생합성 과정 중에 산소를 발생시키며 이를 위한 효소가 존재하고 있다. 특 히 식물에 존재하는 photosystem 2 (PS II) 에는 망간과 칼슘으로 이루어진 물 산화 복합체(water oxidation complex, WOC)가 존재하고 있다.3) 이 WOC는 광합성 과정 명반응 시 틸라코이드 표면에서 전자 전달이 이루어질 때 물에서 부터 전자가 전달 되어 시작이 되며 이 때 물은 산소로 변하면서 전자를 제공한다. 이처럼 물 산화를 통한 산소 생산에는 추가적인 에너지를 요하게 된다. 특히 이를 매 개하는 복합체는 Mn4CaO5 cluster로서, 중성의 액성 조건 에서 160 mV 정도의 매우 낮은 과전압으로 물을 산화시 킬 수 있는 매우 효율적인 물 분해 촉매이다. 이 복합체 는 주변의 Arg, Glu, Al, His, Asp 등의 아미노산에 의해 리간드 결합을 하고 있다. 또한 발생한 전자와 양성자는 이 복합체 주변에 존재하는 Tyr 아미노산을 매개로 하여 PS II에 전달이 되게 된다. 그리고 이 복합체의 자체의 구 조는 아직 정확하게 알려진 바가 없지만 Cubane 구조를 가지고 있을 것이라고 추측을 하고 있다. 그리하여 많은 연구진들은 Fig. 2와 같은 구조를 지닌 Mn4CaO5 복합체 를 모방하려고 노력하였고, 그 과정에서 자연스럽게 복합 체의 구성 성분인 칼슘과 망간에 주목하게 되었다. 또한 연구진들은 Mn4CaO5의 비대칭적 구조와 Mn3+와 Mn4+
로 이루어진 혼합된 산화 가수에 주목하고 이런 특징을 지닌 재료를 합성하기 위해 노력하였다.
Fig. 2. Mn4CaO5 cluster의 구조 및 결합 양상 분석4) 특히 이와 같은 비대칭 적인 산화 가수물 산화 반응에 서 매우 중요한 역할을 할 것으로 기대를 하였다. 먼저, 2011년에 Agapie group은 Mn4CaO5를 유기물과 금속 이 온을 사용하여 모사하고 이에 대한 산화-환원 반응을 분 석하였다. Mn(OAc)2와 1,3,5-triarylbenzene에 pyridine과 alcohol 작용기를 붙인 리간드를 이용하여 망간 클러스터 와 거의 비슷한 클러스터를 유기 용매 상에서 합성하였 다.5) 그리고 이를 extended x-ray absorption fine structure(EXAFS)를 이용하여 망간 원자 및 칼슘, 산소 원 자와의 결합 길이 및 산화수를 분석하여 이가 실제로 Mn4CaO5 구조와 매우 비슷하다는 사실을 알아낼 수 있 었다. 또한 이렇게 합성된 클러스터를 유기 용매 상에서 전압에 따른 전류변화를 측정하였으며 이 때 산화수가 3 가에서 4가로 변화함을 확인할 수 있었음. 그 후 전기 화 학 반응을 일으키는 Mn4CaO5 cluster 내에 존재하지만 산 화환원 반응에는 참여하지 않는 칼슘의 역할이 무엇인지 규명하기 위하여 Mn3M(μ4-O)(μ2-O)(M = Ca2+, Sr2+, Na+, Zn2+, Y3+)를 만들고 M에 해당하는 금속에 따라서 촉매의 특성이 어떻게 달라지는지 비교하였다.6) 그 결과 칼슘이 Mn원자의 redox potential을 조절한다는 사실을 밝혀내었다. 또한 2015년에는 Holger Dau group에서 Mn4CaO5에 가장 유사한 구조체를 합성하였다.7) 기존 연 구에서 칼슘망간 클러스터를 모사하는 경우는 많았지만 그 구조에서 4번째 망간 이온의 배위 구조를 정확하게 모사 한 것은 처음이었다. 뿐만 아니라, 선행 연구와의 비교를 통해서 자연계 물 분해 효소에서 4번째 망간 이온이 산 화-환원 반응 전위와 자기적 성질을 결정하는 데 중요한 역할을 한다는 것을 밝힐 수 있었다. 이처럼 많은 연구진 들이 WOC를 모방한 전기촉매를 인공적으로 합성하기 위 해 노력하였다. 그 외에도 Mn은 Manganese superoxide dismutase (MnSOD), dinuclear manganese catalse (MnCat) 등의 효소 역시 존재하는 등 생물체의 화학 반응에서 매 우 중요한 역할을 하고 있다.8)
6. Mn의 산업적 이용
Fig. 2. Mn4CaO5 cluster의 구조 및 결합 양상 분석.4)
장우제, 서홍민, 하헌진, 조강희, 진경석, 남기태
특 집
CERAMIST
망간은 지구에서 12번째로 풍부한 원소로 지구 지각 구 성성분의 약 0.1%를 차지한다.9) 현재 망간의 세계 매장량 은 2011년 자료 기준으로 약 5억 4천만톤으로 추정된다.
현재 망간이 쓰이는 분야는 크게 Metallurgical use 와 Nonmetallurgical use로 구분할 수 있다. 우선 Metallurgical use 로 사용되는 망간은 주로 steelmaking 과 알루미늄, 구리와 같은 몇몇 금속들의 합금을 만드는데 쓰인다. 총 망간 수요의 85~90%는 철강 제조(steelmaking)에 쓰인다 고 알려져 있는데, 이를 통해서 알 수 있듯이 망간은 철 강 제조에 매우 중요하게 사용이 된다.10)
망간 혼합물은 철강 제조 과정에서 몇 가지의 중요한 역할을 한다. 우선 탈산, 탈황제로 사용돼 불순물을 제거 를 통해 철강의 강도를 증가시키고 성형성과 경량화에 핵 심적인 역할을 한다. 그렇기에 고부가가치 강에 10% 이상 사용된다. 특히 최근 개발된 고망간강 (high Mn steel) 은 망간 함유량을 25%로 늘려 저열팽창•절삭성•가공성을 높인 첨단 제품으로 기존 LNG탱크의 저장 능력을 20배 까지 향상시킬 수 있다. 다음으로 망간은 금속들의 합금 을 만드는데 약 1.5%정도의 용해 한도까지 alloying agent 로 사용되는데 그 예로는 알루미늄, 구리 합금이 있다. 약 1.5%정도의 망간 성분을 가진 알루미늄 합금의 경우 부식 에 대하여 향상된 저항을 가지게 되는데, 이는 galvanic corrosion을 일으키는 불순물들을 형성된 grain들이 흡수 하기 때문이다.11)
망간이 non-metallurgical application에서 가장 중요하 게 쓰이는 형태는 manganese dioxide의 형태로 dry-cell batteries 의 depolarizer로 사용된다. 배터리 안에서의 망 간의 역할은 단순하면서도 중요하다. 배터리 셀에서 음극 과 양극은 근본적으로 습할 수밖에 없다. 방전되는 동안 두 전극 중 어느 한곳에서 수소가 발생하게 되고 발생한 수소가 다른 전극을 가스 film으로 코팅하게 되어 추가적 인 wetting을 막게 된다. 그 결과 전기 발생이 줄어들게 되는데, manganese dioxide의 역할은 바로 수소를 산화 시키고 물을 형성하는 것이다. 이 반응이 진행되는 속도 는 dioxide의 반응성에 의존한다.12)
7. 물 분해 산화 촉매
그러나 현재 산업적으로 사용되는 물 전기분해 촉매는 망간과 같은 전이 금속이 아닌 귀금속 기반 촉매가 사용 되고 있다. 특히 루테늄이나 이리듐, 백금, 금과 같은 귀 금속들의 촉매가 사용이 되며 이들은 다양한 조건하에서 특성이 측정 되었다. 특히 귀금속들의 경우 d-band에 전 자가 완전히 차 있기 때문에 페르미 에너지 준위에 어떤 영향을 주지 않는 독특한 전자 구조를 가지고 있어서, 전 자들은 산소 발생 반응 중에 화학적 거동을 더 자유롭게 바꿀 수 있다. 이러한 이유로, 귀금속 기반 촉매들은 다 른 종류의 촉매들과 비교했을 때 더 높은 촉매 특성을 가 진다. 예를 들어, IrOx의 경우 200 mV 정도의 과전압(1.43 V vs. RHE)만으로도 1 mA/cm2의 전류 밀도로 산소를 발 생시킬 수 있으며, 40 mV/dec의 매우 낮은 타펠 기울기 를 가진다. RuO2의 경우, RHE 대비 산성 조건일 때 1.36 V에서 1 mA/cm2의 전류밀도를 나타내며, IrOx와 비슷한 40 mV/dec의 작은 타펠 기울기를 가진다. Trasatti그룹은 RuO2와 IrOx의 적절한 금속-산소 결합력이 높은 물 산 화 특성에 기인한다고 주장했다.13) 더군다나, Norskov와 Rossmeisl 그룹은 전체 물 산화 과정에서 rate-determining step으로 여겨지는 O*와 OH*의 결합에너지 차이에 근거 하여 RuO2의 높은 촉매 특성을 계산 과학적으로 증명하 였다.14) DFT 계산 결과, RuO¬2는 다양한 전이금속 기 반 OER 촉매들 중 가장 낮은 차이를 보였고, 이를 통해 RuO2의 높은 촉매 특성의 원인을 이론적으로 확인하였다.
한편, 귀금속 기반 OER 촉매들은 보고된 촉매들 중 거의 최고의 안정성을 가지고 있다고 알려져 있다. 장기간 안 정성과 높은 촉매능 때문에 귀금속 기반 촉매들은 전체 물 전기분해 반응을 위한 물 산화 촉매로서 각광 받아 왔 다. 그러나, 귀금속 기반 촉매의 경우 가격이 매우 비싸 다는. 1 온스당 평균 가격이 루테늄은 $151.96/oz, 백금은
$1035.62/oz, 이리듐은 $476.15/oz 정도로 매우 비싸다. 그 러므로, 귀금속 기반 OER 촉매들은 물 전기분해를 통한 장기적으로 수소 대량 생산을 하기에 굉장히 부적합하다 고 볼 수 있다.
앞서 살펴 본 것처럼 RuO2나 IrO2와 같은 귀금속 기반 촉매들은 뛰어난 OER 촉매 특성을 갖지만, 높은 가격 때 문으로 인해 장기적인 전기 분해 촉매로는 사용되기가 어
CERAMIST
물 전기 분해로부터 수소 생산을 위한 망간 기반의 물 산화 촉매
렵다. 특히 대부분의 전극의 수명이 5년이라고 할 때 이 를 교체하기 위해서는 천문학적인 비용이 들어가게 된다.
이러한 이유로, 특성도 좋으면서 가격도 저렴한 촉매들을 개발하기 위한 연구가 진행되었는데, 많은 연구진들이 주 목한 것이 바로 전이 금속 기반의 물 산화 촉매이다. 이 러한 전이 금속 기반 촉매들은 분자 단위 촉매와 무기 촉 매로 나누어져 있다.
무기 촉매의 일례로는 Nocera 그룹에서는 코발트 2가 이온이 들어 있는 포스페이트 완충 용액 안에서 ITO 기 판 위에 전기 증착을 통해 코발트 원자와 포스페이트 음 이온을 포함하는 Co-Pi 비정질 무기 필름을 증착하였다.15) 흥미롭게도, in-situ로 Co-Pi 촉매가 생성되었고 중성 조 건에서도 적당한 과전압 값(~430 mV)을 보이며 물을 산 소로 바꾸었다. 게다가, Co-Pi 필름은 산소 발생 반응 도 중에 전구체가 들어 있는 용액상에서 계속적으로 ITO 기 판 위에 생겨나기 때문에, 자가 치유의 특징을 지니고 있 어 그 안정성이 매우 뛰어나다.
Nocera 그룹은 Co-Pi 개발 이후에도 Ni과 borate(Bi) 이온이 녹아 있는 용액에서 전기 증착법을 통하여 비정질 필름을 만들었고 이의 물 산화 특성을 연구 하였다.16) Ni-Bi 촉매는 pH 9.2에서 약 620 mV의 과전압 가지고 물을 분해하였으며 그 안정성 역시 매우 뛰어나다. 코발 트와 니켈 기반 비정질 필름의 높은 촉매 특성에 영감을 받아서, Berlinguette 그룹은 최근에 비정질 Fe100-y-
zCoyNizOx films을 개발하였다.17) 그들은 저온에서 비정질 필름을 만들기 위해서 광화학 금속-유기 증착법을 이용하 였고, 그 결과 금속이 필름 내에 균일하게 분포 하였다.
놀랍게도, 이 촉매의 특성은 염기 조건에서 IrOx 촉매와
비견할만한 성능을 가지고 있었다. 한편, Hongjie Dai 그 룹은 약하게 산화된 CNT위에 매우 얇은 Ni-Fe layered double hydroxide plate를 합성하였다.18) 여기서 CNT는 전기를 잘 흘려줄 수 있는 도선과 같은 역할을 하고, Ni-Fe LDH는 OER 촉매의 역할을 한다. 이 촉매는 염기 조건에서 기존에 사용되던 이리듐 기반 전기 촉매와 비슷 한 촉매 특성을 가진다.
전이 금속 기반 전기 촉매의 특성을 체계적으로 이해하 고 비교하기 위하여, Jaramillo 그룹은 전기증착 방법을 이용하여 다양한 전이 금속 기반의 전기 촉매들을 증착 하였고 이의 물 분해 특성을 측정하였다.19) 이 때 이 그 룹은 10 mA/cm2에 도달하기 위한 촉매들의 과전압을 기 준으로 성능을 비교하였다. 이는 물 전기 분해 장치가 태 양 전지와 결합되었을 때 태양 에너지가 수소와 산소로 변환되는 효율을 잠정적으로 나타낼 수 있기 때문이다. 또 한 이러한 촉매들은 염기 조건에서, 촉매들은 350 mV에 서 470 mV 사이의 과전압 값을 나타내었다. 최근에는 porous한 전극을 이용하여 특정 면적에 비해 기하학적 면 적이 크도록 재료를 설계하여 그 물 분해 산화 특성을 증 가시킨 사례가 존재한다. 대표적인 전극은 Nickel foam 전극이 존재하며 nickel 자체가 염기성 용액에서 물 산화 특성이 좋다는 특성을 이용하여 촉매 성능이 좋은 물질들 을 이 위에 올려 사용을 하게 된다. 그 일례로 Gratzel group에서는 NiFeLDH 촉매를 Nickel foam 위에 올려 뛰 어난 물 산화와 환원 특성을 가지는 전극을 개발하고 이 를 태양전지와 결합하여 물 분해를 할 수 있는 시스템을 개발하였다.20) 그 외에도 Spiccia 그룹에서는 그냥 nickel foam 역시 뛰어난 물 전기 분해 특성을 가지고 있다는 사실 이용해 태양 전지와 결합하여 높은 수소 발생 효율 을 기록할 수 있었다.21) 또 다른 방법으로, 많은 연구진 들은 전이 금속과 유기 리간드로 이루어진 분자 촉매들을 개발하였다. 유기 리간드는 금속 이온에 배위하여 적절한 활성 부위를 디자인하고 금속의 산화 가수나 구조를 안정 화하기 위하여 이용되었다. 유기 리간드는 다루기가 용이 하기 때문에 많은 전이 금속 복합체들이 개발되었다. Meyer 그룹은 염기 포스페이트 완충 용액에서 높은 촉매 특성을 가지는 구리 기반 전기 촉매를 개발하였다.22) 또한 그들
Fig. 3. Nocera 그룹에서 개발한 Co-Pi 촉매 특성.
장우제, 서홍민, 하헌진, 조강희, 진경석, 남기태
특 집
CERAMIST
은 2012년에 산소 발생 반응 메커니즘이 분명한 구리-펩 타이드 분자 촉매를 추가로 보고하였다.23) 그들은 초기 구 리의 산화수인 2가가 3가로 변하는 것과 과산화물의 형성 과 함께 중간체의 구리 4가 이온이 생겨나는 것을 확인하 였다. 과전압은 물 분해가 시작하기 위해 필요한 과전압 이 pH 11에서 약 0.52 V로 비교적 높은 값이지만, 높은 TOF(turn of frequency)를 가지는 구리-펩타이드 복합체 의 인상적인 촉매 안정성은 물 산화 반응을 위한 전이 금 속 기반 촉매를 개발하는 방법론을 제시하였다. 하지만 다 음과 같은 분자 촉매들은 대체적으로 그 성능이 산업적으 로 이용하기에 부족하다는 단점을 가지고 있다.
하지만 다음과 같은 망간 역시 물 산화 촉매로써 연구 가 진행이 되고 있었으며 현재도 여러 연구실에서 관련 연구가 활발히 진행 중이다.
예전에 진행되었던 망간 관련 연구 주제를 살펴보면 페 로브스카이트 구조를 가진 특정 망간 화합물에서 electrical conduction와 ferromagnetism 사이에 실증적인 상관관계 를 찾아낸 연구와 intrinsic antiferromagnetic spin structure 을 가진 magnetic manganese oxide La0.72Ca0.25MnOz films에서-53%정도의 isotropic magnetoresistance가 관찰 된 연구도 있었다.24) 위의 연구들은 주로 망간의 자기적 인 성질에 초점을 맞추어 진행한 연구들이었다. 최근의 망 간관련 연구 동향을 살펴보면 물 분해 촉매로서의 망간에 중점을 두고 많은 연구들이 진행되고 있다는 것을 알 수 있다.
망간을 기반으로 한 다양한 촉매들이 다음과 같이 연구 개발되어 왔다. 아래에서 간단하게 몇몇 대표 연구를 요 약하여 소개하고자 한다. 먼저, Driess 그룹에서는 비활성 촉매로 알려진 MnO 나노입자를 Ceric ammonium nitrate (CAN)를 이용하여 산화시켜 비정질 MnOx 나노입자로 변
형시켰고(Fig. 5a), 이렇게 만들어진 촉매의 경우 MnO 나 노입자에 비해 촉매 특성이 향상 되었다고 보고하였다(Fig.
5b).25) Kuo는 촉매 활성 사이트라고 알려진 Mn3+와 높 은 표면적을 가지는 mesoporous Mn2O¬3를 개발하였다.26) Nakamura 그룹은 MnO2표면에 PAH (poly-(allylamine hydrochloride)) 유기 분자를 붙임으로서, 부분적인 구조 비대칭화를 유도하여 MnO2의 촉매 특성을 향상 시켰다.27) Kurz그룹에서는 자연계에 존재하는 Mn4CaO5클러스터의 구조를 모방하여 CaMn2O4-4H2O촉매를 개발하였다.28) 또 한 Dismukes 그룹은 리튬 이온 배터리 재료인 LiMn2O4 로부터 Li 이온을 제거함으로써 Mn4CaO5내에 존재하는 Mn4O4 core unit과 유사한 구조를 지니는 λ-MnO2를 개 발하였고 이 촉매의 특성이 뛰어남을 보고하였다.27)
8. 망간 기반의 촉매의 특성 조절을 통한 성능 향상
1) 기하 구조 조절을 통한 망간 기반 촉매 합성 - Mn3(PO4)2-3H2O29)
위에서 언급한 망간 기반 촉매들의 한계점을 극복하기 위해 남기태 교수 연구진에서는 비대칭적인 구조를 갖는 촉매를 개발했다. 그 결과, Mn3(PO4)2-3H2O라는 기존에 알려지지 않은 새로운 물질을 합성하였고 이를 물 분해 촉매에 적용하였다. Fig. 6에서 볼 수 있듯이, Mn3(PO4)2- 3H2O는 Mn4CaO5 복합체와 유사한 triclinic 구조를 지니 고 있으며, 3개의 물 분자가 구조 내에 존재한다. 물 분 해 특성을 평가한 결과, 기존 망간 산화물 촉매들보다 더 뛰어난 효율을 가진 것을 확인할 수 있었다.
이러한 높은 효율을 설명하기 위해 전산모사 방법을 통 하여 Mn(III) 의 안정성이 평가되었다. Mn3(PO4)2-3H2O 촉매와 함께 대표적인 망간 산화물인 MnO2와 MnO로부
Fig. 4. Meyer 그룹에서 개발한 Cu-peptide 물 산화 촉매.
Fig. 5. Diress 그룹에서 제안한 CAN 처리시 MnOx의 변화 및 촉매 특성 비교.
CERAMIST
물 전기 분해로부터 수소 생산을 위한 망간 기반의 물 산화 촉매
터 전자를 빼내 Mn(III)를 만들어주고, 쌍분포함수(pair distribution function, pdf)와 내부 압력 측정하여 얀-텔 러 효과를 확인했다. Fig. 7을 보면, Mn3(PO4)2-3H2O의 경우, 얀-텔러 효과가 잘 일어나며 내부 압력이 적은 것 을 확인할 수 있다. 이에 반해, MnO2는 기존 연구에서 보고된 것과 일치하게 얀-텔러 효과가 일어나지 않고, 내 부 압력이 크게 걸리며, MnO 물질은 얀-텔러 효과가 어 느 정도 일어나지만 내부 압력이 크게 걸려 불안정해진다.
이 연구를 통해 우리 Mn3(PO4)2-3H2O 촉매는 망간의 구 조적 특성, 즉 국소적 기하 구조 조절에 의해 물 전기분 해에 Mn(III)이 안정화되어 물 분해 성능이 향상된 촉매라 는 것을 알 수 있었다.
2) 망간의 산화가수 조절을 통한 촉매 합성 - LiMnP2O730) 기하 구조에 의한 Mn(III)의 안정화가 망간 기반 촉매의 물분해 특성을 향상시킨다는 선행 연구를 확장하여 남기태 교수 연구진에서는 산화가수 조절이 망간 촉매에 미치는 영향을 살펴 보았다. LiMnP2O7 물 분해 촉매를 개발한
후, 탈리 과정을 통해 리튬 원자를 빼주면서 망간의 산화 가수를 순차적으로 변화시키며 물 분해 특성을 측정했다.
그 결과, Fig. 8에서 나타난 것과 같이 망간의 산화가
수가 증가할 수록 물 분해 특성이 향상된 것을 확인할 수 있었다.
즉, Mn(III) 의 비율이 높아질수록, 그에 따라 물 분해 특성도 향상 되는 것이다.
망간의 산화 가수가 미치는 효과를 정확히 이해하고자, DFT(density functional theory) 계산을 통해 망간의 국소 적 전자구조를 분석하고, 망간-산소 결합 길이를 분석하 였다. Fig. 9를 보면 리튬이 빠질수록 Mn(III) 비율이 순 차적으로 증가하고, 이에 비례하게 Mn-O 결합 길이가 증
Fig. 6. (a) 여러 망간 화합물의 구조 (b) Mn3(PO4)2-3H2O의 LSV 그래프.
Fig. 7. (a) MnO2, (b) Mn3(PO4)2-3H2O, (c) MnO의 Mn(III) 상태에서 의 쌍분포 함수 그래프 및 내부 압력.
Fig. 8. LiMnP2O7 derivatives 촉매들의 물 분해 특성.
Fig. 9. LiMnP2O7 derivatives 촉매에서 Mn의 기하학적 구조와 전자 구조 모형.
장우제, 서홍민, 하헌진, 조강희, 진경석, 남기태
특 집
CERAMIST
가하는 것을 확인할 수 있다. 이는 전체 구조의 뒤틀림 정도가 커진 것을 의미하고, 이로 인해 생성된 Mn(III) 상 태가 LiMnP2O7 구조 안에서 안정화되어 물 분해 특성을 향상시킨다는 것을 알 수 있다.
3) 나노 입자 합성법을 통한 망간 기반 촉매 합성 - Partially oxidized MnO NPs31)
남기 태교수 연구진은 defined system으로서 망간 기반 촉매 개발을 위해 동일한 크기와 외형의 나노 입자로 이 루어진 망간 기반 촉매를 개발하였다. 나노 입자 합성법 으로 잘 알려진 Hot injection 합성법을 이용하여 10 nm 정도 크기의 균일한 구형 나노입자를 얻을 수 있었다.
(Fig. 10)
위에 Fig. 11. (a)에서 확인할 수 있듯이, Hot injection 으로 합성된 망간 옥사이드 물질(MnO) 는 10 nm 크기는 갖는 구형의 나노입자(nanoparticles) 이다. 이때, 합성 특 성상, 계면 활성제가 표면에 연결되어 있다. 이는 전기 전 도도를 감소시키는 역할을 하여, 물분해 특성을 저하시킨 다. 따라서 이를 제거하기 위해, 암모니아 처리를 실시하
고, 낮은 온도에서 열처리를 실시하였다. 이 과정들을 통 하여 MnO 상과 Mn3O4 상이 혼합된 구조가 만들어지고 이를 “Partially oxidized MnO NPs” 로 명명한다.
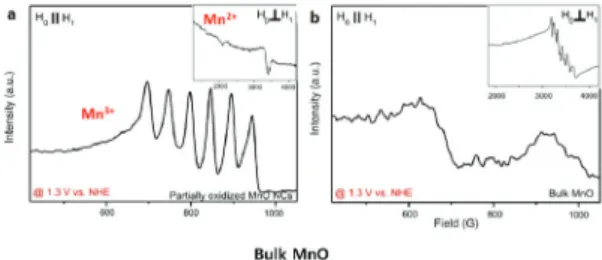
Partially oxidized MnO NPs는 Fig. 11. (b)에서 확인할 수 있듯이, 중성에서 매우 뛰어난 물 분해 특성을 보이는 것을 알 수 있다. 기존에 전이 금속 중 가장 좋은 촉매로 알려진 Co-Pi, MnOx 비정질 film 보다도 뛰어난 특성을 가지는 것을 알 수 있다. 이는 앞서 연구진들이 지적하였 던 중성에서의 낮은 특성을 지니는 망간 기반 촉매의 한 계점을 극복한 것을 의미한다. 본 연구진은 이에 더 나아 가 중성에서의 뛰어난 특성의 원인을 찾고자 EPR(electron paramagnetic resonance) 분석을 실시하였다. EPR 분석 은 paramagnetic 한 Mn 양이온을 분석할 수 있는 분석 방법으로, 특정 망간 산화가수 마다 고유한 신호를 관찰 할 수 있어, 산화가수 변화를 관찰하기 매우 효과적인 방 법이다. Fig. 12에서 확인할 수 있듯, Partially oxidized MnO NPs 의 경우 벌크 MnO 물질와는 달리 물 분해중 에서 Mn(III) 신호가 관찰되는 것을 확인할 수 있다. 이는 나노 크기의 망간 산화물 표면에서 Mn(III)가 안정화 될 수 있음을 의미한다.
추가적으로, 결정구조와 촉매 입자의 크기가 물 분해 반
Fig. 10. Hot injection을 이용한 입자 합성.
Fig. 11. (a) MnO NPs TEM image (b) Partially oxidized MnO NPs 의 물분해 특성 및 비교 그래프.
Fig. 12. EPR을 이용한 물 분해 중 Mn 산화가수 분석 (a) Partially oxidized MnO NPs, (b) Bulk MnO.
Fig. 13. 다양한 Mn 산화물 상의 (a) 합성을 위한 열처리 조건 및 (b) 각각의 SEM image.
CERAMIST
물 전기 분해로부터 수소 생산을 위한 망간 기반의 물 산화 촉매
응에 미치는 영향을 확인하기 위해, 동일한 크기를 유지 한 채, 다양한 상을 지니는 산화물 나노 입자를 합성할 수 있는 조건을 확립하였다. (Fig. 13)32)
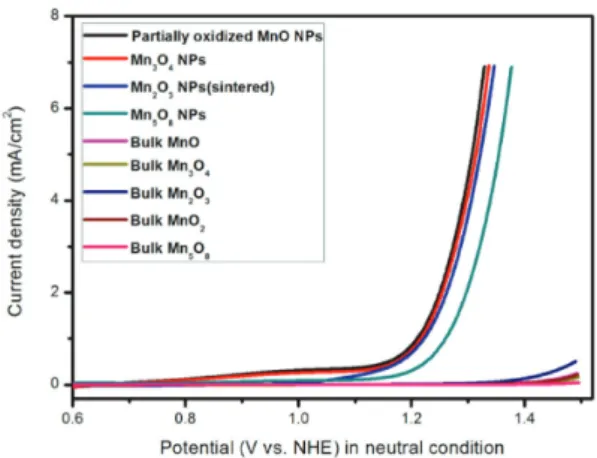
Fig. 13. (a)를 보면 열처리 분위기와, 처리온도, 시간을 조절 함으로서, 다양한 상 (MnO, Mn3O4, Mn2O3, 그리 고 Mn5O8) 나노 입자의 가능함을 알 수 있다.
Fig. 14에서 확인할 수 있듯, 나노 사이즈 망간 산화물 입자의 물 분해 특성은 벌크 사이즈 망간 산화물의 특성 과 비교하였을 때 훨씬 뛰어난 특성을 보이는 것을 확인 할 수 있다. 각각의 물질을 비표면적(surface area)를 고 려하여 비교하더라도 onset potential, 면적당 전류 등의 특성 측면에서 나노 망간 옥사이드 물질이 더 우수한 물 분해 특성을 보임을 확인하였다. 또한 한가지 주목할 점 은, 나노 입자들간에는 뚜렷한 특성 차이가 보이지 않는 다는 점이다. 따라서 결정구조가 미치는 영향보다는 나노 사이즈가 되었을 때의 표면 상태의 변화가 촉매 특성에 더 큰 영향을 미친다는 결론을 도출 할 수 있다.
9. 결론
지속 가능한 미래를 위한 재료 개발이 중요한 현 시점 에서 수소에너지는 친환경적이고 물 분해를 통하여 쉽게 얻을 수 있고 다른 에너지원보다 높은 에너지 밀도를 가 지고 있어 미래 에너지원으로 주목 받고 있다. 이러한 수 소에너지는 물 전기 분해를 통하여 얻을 수 있는데, 물전
기 분해에는 1.23V 이상의 과전압이라는 장벽이 존재한다.
이러한 과전압을 줄이기 위한 다양한 금속 기반의 촉매가 연구되고 있는데, 특히 자연계의 Mn4CaO5 cluster 에서 영감을 얻어 망간 기반의 촉매 연구가 진행되어 왔다. 그 일례로 기하구조 조절을 통해 Mn3(PO4)2-3H2O라는 촉매 를 개발하여 기존의 망간 기반 촉매들보다 높은 효율을 가지는 것을 확인하였고, 기하 구조에 의한 Mn(III)의 안 정화가 망간 기반 촉매의 물 분해 특성을 향상시킨다는 선행 연구를 기반으로 LiMnP2O7 물 분해 촉매를 합성하 였다. 또한 Hot-injection method를 이용하여 10nm 정도 의 균일한 구형의 나노 입자 합성 후 열처리를 통하여 MnO 상과 Mn3O4 상이 혼합된 Partially oxidized MnO NPs를 얻을 수 있었고, 기존의 전이 금속 중 가장 좋은 촉매로 알려진 Co-Pi, MnOx 비정질 film 보다 좋은 특 성을 가지는 것을 확인할 수 있었다.
참고문헌
1 Y. Li, et al., “MoS2 Nanoparticles Grown on Graphene: An Advanced Catalyst for the viation Hydrogen Evolution Reaction,” J. Am. Chem. Soc., 133 [19] 7296-99 (2011).
2 Sim, U. et al., “Hydrogen Production by Electrolysis and Photoelectrochemi viation cal System,” Wiley- Blackwell, 2014.
3 J. Barber, “Photosynthetic Energy Conversion:
Natural and Artificial,” Chem. Soc. Rev., 38 [1]
185-96 (2009).
4 J. Yano, et al., “Where Water is Oxidized to Dioxygen: Structure of the Photosynthetic Mn4Ca Cluster,” Science, 314 [5800] 821-25 (2006).
5 J. S. Kanady, E. Y. Tsui, M. W. Day, and T.
Agapie, “A Synthetic Model of the Mn3Ca Subsite of the Oxygen-Evolving Complex in Photosystem II,” Science, 333 [6043] 733-36 (2011).
6 E. Y. Tsui, R. Tran, J. Yano, and T. Agapie,
“Redox-Inactive Metals Modulate the Reduction Potential in Heterometallic Manganese–Oxido Clusters,” Nat. Chem., 5 [4] 293-99 (2013).
7 C. Zhang, et al., “A Synthetic Mn4Ca-Cluster Mimicking the Oxygen-Evolving Center of Photosynthesis,” Science, 348 [6235] 690-93 (2015).
8 Y. Li, et al., “Dilated Cardiomyopathy and Neonatal Lethality in Mutant Mice Lacking Manganese
Fig. 14. 다양한 Mn oxide 나노 입자의 물분해 특성 평가 및 bulk 상 들과의 비교 그래프.
장우제, 서홍민, 하헌진, 조강희, 진경석, 남기태
특 집
CERAMIST
Superoxide Dismutase,” Nature Genetics, 11 [4] 376- 81 (1995).
9 J. Emsley, “Nature's Building Blocks: an AZ Guide to the Elements,” Oxford University Press, 2011.
10 W. Zhang and C. Y. Cheng, “Manganese Metallurgy Review. Part I: Leaching of Ores/Secondary Materials and Recovery of Electrolytic/Chemical Manganese Dioxide,” Hydrometallurgy, 89 [3] 137- 59 (2007).
11 T. O. Bergman and J. G. Gahn, General properties Name, symbol, number.
12 N. Cahoon, “An Electrochemical Evaluation of Manganese Dioxide for Dry Battery Use,” J.
Electrochem. Soc., 99 [9] 343-48 (1952).
13 S. Trasatti, “Electrocatalysis in the Anodic Evolution of Oxygen and Chlorine,” Electrochim. Acta, 29 [11] 1503-12 (1984).
14 J. Rossmeisl, Z.-W. Qu, H. Zhu, G.-J. Kroes, and J. K. Nørskov, “Electrolysis of Water on Oxide Surfaces,” J. Electroanal. Chem., 607 [1]
83-9 (2007).
15 M. W. Kanan and D. G. Nocera, “In Situ Formation of an Oxygen-Evolving Catalyst in Neutral Water Containing Phosphate and Co2+,” Science, 321 [5892]
1072-75 (2008).
16 M. Dincă, Y. Surendranath, and D. G. Nocera,
“Nickel-Borate Oxygen-Evolving Catalyst that Functions under Benign Conditions,” PNAS., 107 [23] 10337-41 (2010).
17 R. D. L. Smith, M. S. Prѐvot, R. D. Fagan, S.
Trudel, and C. P. Berlinguette, “Water Oxidation Catalysis: Electrocatalytic Response to Metal Stoichiometry in Amorphous Metal Oxide Films Containing Iron, Cobalt, and Nickel,” J. Am. Chem.
Soc., 135 [31] 11580-86 (2013).
18 M. Gong, et al., “An Advanced Ni–Fe Layered Double Hydroxide Electrocatalyst for Water Oxidation,” J. Am. Chem. Soc., 135 [23] 8452-55 (2013).
19 C. C. McCrory, et al., “Benchmarking Hydrogen Evolving Reaction and Oxygen Evolving Reaction Electrocatalysts for Solar Water Splitting Devices,”
J. Am. Chem. Soc., 137 [13] 4347-57 (2015).
20 J. Luo, et al., “Water Photolysis at 12.3% Efficiency via Perovskite Photovoltaics and Earth-Abundant Catalysts,” Science, 345 [6204] 1593-96 (2014).
21 S. A. Bonke, M. Wiechen, D. R. MacFarlane, and L. Spiccia, “Renewable Fuels from Concentrated
Solar Power: towards Practical Artificial Photosynthesis,” Energy Environ. Sci., 8 [9] 2791- 96 (2015).
22 Z. Chen and T. J. Meyer, “Copper(II) Catalysis of Water Oxidation,” Angew. Chem. Int. Ed., 52 [2]
700-3 (2013).
23 M.-T. Zhang, Z. Chen, P. Kang, and T. J. Meyer,
“Electrocatalytic Water Oxidation with a Copper(II) Polypeptide Complex,” J. Am. Chem. Soc., 135 [6]
2048-51 (2013).
24 K. I. Chahara, T. Ohno, M. Kasai, and Y. Kozono,
“Magnetoresistance in Magnetic Manganese Oxide with Intrinsic Antiferromagnetic Spin Structure,”
Appl. Phys. Lett., 63 [14] 1990-92 (1993).
25 A. Indra, et al., “Active Mixed-Valent MnOx Water Oxidation Catalysts through Partial Oxidation (Corrosion) of Nanostructured MnO Particles,”
Angewandte. Chem. Int. Ed., 52 [50] 13206-10 (2013).
26 C.-H. Kuo, et al., “Robust Mesoporous Manganese Oxide Catalysts for Water Oxidation,” ACS Catal., 5 [3] 1693-99 (2015).
27 D. M. Robinson, Y. B. Go, M. Greenblatt, and G. C. Dismukes, “Water Oxidation by λ-MnO2: Catalysis by the Cubical Mn4O4 Subcluster Obtained by Delithiation of Spinel LiMn2O4,” J. Am. Chem.
Soc., 132 [33] 11467-69 (2010).
28 M. M. Najafpour, T. Ehrenberg, M. Wiechen, and P. Kurz, “Calcium Manganese(III) Oxides (CaMn2O4•x H2O) as Biomimetic Oxygen-Evolving Catalysts,” Angew. Chem. Int. Ed., 49 [12] 2233- 37 (2010).
29 K. Jin, et al., “Hydrated Manganese(II) Phosphate (Mn3(PO4)2•3H2O) as a Water Oxidation Catalyst,”
J. Am. Chem. Soc., 136 7435-43 (2014).
30 J. Park, et al., “A New Water Oxidation Catalyst:
Lithium Manganese Pyrophosphate with Tunable Mn Valency,” J. Am. Chem. Soc., 136 [11] 4201- 11 (2014).
31 K. Jin, et al., “Partially Oxidized Sub-10 nm MnO Nanocrystals with High Activity for Water Oxidation Catalysis,” Scientific reports, 5 (2015).
32 D. Jeong, et al. “Mn5O8 Nanoparticles as Efficient Water Oxidation Catalysts at Neutral pH,” ACS Catal., 5 [8] 4624-28 (2015).
CERAMIST
물 전기 분해로부터 수소 생산을 위한 망간 기반의 물 산화 촉매
장우제
서울대학교 재료공학부
학사과정 졸업
서울대학교 협동과정
바이오엔지니어링 전공
석사과정 졸업
서홍민
서울대학교 재료공학부
학사과정 졸업
서울대학교 재료공학부
석사과정 재학 중
하헌진
포항공과대학교 신소재공학과
학사과정 졸업
서울대학교 재료공학부
석사과정 재학 중
조강희
고려대학교 신소재공학부
학사과정 졸업
서울대학교 재료공학부
석사과정 재학 중
진경석
서울대학교 재료공학부
학사과정 졸업
서울대학교 재료공학부
박사과정 재학 중
남기태
서울대학교 재료공학부 학사과정 졸업
서울대학교 재료공학부 석사과정 졸업
Massachusetts Institute of Technology Materials Science and Engineering 박사과정 졸업
Lawrence Berkeley National Laboratory 박사 후 과정 수료
서울대학교 재료공학부 부교수