세포치료를 위한 줄기세포의 연금술
Stem Cell Alchemy for Cell-Based Therapy
이은아ㆍ손영숙 | EunAh LeeㆍYoungsook Son Laboratory of Tissue Engineering, College of Life Science and Graduate School of Biotechnology, Kyung Hee University, 1732 Deogyeong-daero, Giheung-gu, Yongin-si, Gyeonggi-do 446-701, Korea
E-mail: eunahlee@khu.ac.kr
이은아
1993 건국대학교 (학사) 1997 건국대학교 (석사) 2002 건국대학교 (박사) 2002-2003 서강대학교
제올라이트초결정연구단 (Post-Doc.)
2003-2006 NIH/NIDCR/CSDB (Visiting/Research Fellow) 2006-현재 경희대학교
근골격계바이오장기센터 연구교수
손영숙
1980 서울대학교 (학사) 1982 서울대학교 (석사) 1989 UCSF대학교 (박사)
1982-1983 서울대학교 의과대학 약리학교실 연구조교
1989-1991 Univ. of Chicago, HHMI (Post-Doc.) 1992-1993 서울대학교 의과대학 약리학교실
전임강사
1993-2006 원자력의학원 생체조직재생연구실 실장 2006-현재 경희대학교 생명과학대학 유전공학과
교수
1. 서론
사고나 외상에 의한 조직 결손을 포함하여 난치성 질병을 극복하기 위한 재생의학의 연구는 생체재료, 줄기 세포, 성장인자, 바이오리액터 등을 포함한 다양한 요소를 포함하고 있다. 따라서, 재생의학은 다양한 분야의 학 문적 요소를 복합적으로 이용하여 효과적으로 조직 재생을 이루고자 하는 목적을 가지고 있으며, 균형있는 다 학제간 참여를 통한 융복합적인 연구에 의해 뛰어난 성과를 창조할 수 있는 분야이다. 이러한 성공적인 재생의 학적 연구를 위하여 다방면으로 기술개발 및 노력이 필요하지만, 생체조직은 세포가 만들어내는 산물이므로, 재생의학적인 목적을 가지고 이용하는 여러 기술요소 중 세포치료제를 구성하는 줄기세포는 다른 어떤 것으로 도 대체할 수 없는 기능을 제공한다.
결손을 가지고 있는 조직을 형성할 수 있는 충분한 수의 체세포를 얻을 수가 있다면 타겟으로 하는 조직의 형 성에 적절한 특성을 가지고 있는 생체재료를 이용하여 결손조직의 복구가 가능할 것이다. 그러나, 이미 결손이 일어난 조직에서 필요한 만큼의 충분한 숫자의 세포를 얻는 데는 한계가 있으며, 이미 terminal differentiation 이 일어난 세포는 더 이상 증식하지 않는 특성을 가지고 있으므로, 필요한 만큼의 충분한 수의 세포를 얻기 위해 서 줄기세포를 이용하기 위한 연구가 활발하게 이루어지고 있다. 줄기세포는 클론을 형성하여 세포의 군집을 이루는 과정에서 자기복제를 하여 군집 내에 새로운 하나의 줄기세포를 유지할 수 있으며 분화를 통하여 한가 지 이상의 특징적인 세포 형태를 형성할 수 있는 능력이 있는 세포이다.
줄기세포에는 출처에 따라 배아줄기세포와 성체줄기세포가 있다. 그리고 최근에는 체세포를 이용하여 유도 만능 줄기세포를 유도하는 기술이 개발되어 윤리적, 기술적인 한계를 뛰어넘었다. 그러나 이러한 기술들에는 장 단점이 있으며 실제 재생의학에 적용하기 위해서 안전성을 확보하여야 하는 과제를 안고 있다. 그러한 의미 에서 현재로서 가장 응용가능성이 높은 것은 성체줄기세포이나, 그 역시 여러가지 점에서 극복해야 할 한계가 있다. 그러므로 본 특집에서는 근골격계 조직의 재생에 이용하기 위한 골격줄기세포에 중점을 두어 다양한 성 체줄기세포에 대하여 소개하고 그 이용성을 높이기 위한 방법에 대한 기존의 연구들을 살펴봄으로써 향후의 발 전방향에 대해 통합적으로 고찰할 수 있는 기회를 제공하고자 한다.
그림 1. 골수유래 다분화성 중기세포의 확인 및 특성분석과정.
그림 2. CFU-F(colony forming unit-fibroblast) assay를 통한 골수, 지방, 연골, 건, 인대에서 유래한 다양한 성체줄기세포의 클론형성능력 확인.17
2. 본론
2.1 성체줄기세포의 종류와 개별적 특성
성체줄기세포(adult stem cell)는 그 이름 때문에 어른에 서만 발견된다고 오해 받을 수 있으나, 출생 후 발견되는 다 분화성을 가지는 세포를 성체줄기세포라고 하며, 그러한 의 미에서 adult stem cell보다는 post-natal stem cell이라는 표현이 더 적절하다.
현재까지 골격계 및 결합조직의 형성능력이 있는 다양한 성체줄기세포가 발견되어 특성분석이 되어 있다. 그 중 gold standard로 여겨지는 골수줄기세포는 1968년 Friedenstein에 의해 발견된 후로1 현재까지 가장 잘 characterization이 되어 있 는 세포군이며,2 BM-MSCs(bone marrow-mesenchymal stem cells), BMSCs(bone marrow stromal cells), MSCs (mesenchymal stem cells/multipotent stem cells)등 여러 가지 이름을 가 지고 있으나, MSC라는 이름으로 가장 많이 불리고 있다.
MSC는 여러 중배엽성 조직(뼈, 연골, 근육, 지방조직 등) 으로 분화되는 성격을 갖고 있으며, 그림 1에 표시된 바와 같 이 플라스틱 배양접시에 부착하여 자랄 수 있는 능력, 세포표 면에 발현되는 특정 마커의 존재 여부(표 1), 그리고 다양한 계통으로의 분화가 가능한지의 여부(다분화성: osteogenesis, chondrogenesis, 및 adipogenesis)를 확인함으로써 줄기세 포의 확인 및 특성분석이 이루어진다3.
이러한 MSC와 유사한 성격을 가진 세포는 골수뿐만 아니 라, 근육,4 연골,5 활액막,6 치아, 지방,7 태반,8 제대혈,9 건,10
말초혈액11,12 등의 내배엽성 및 외배엽성의 다양한 여러 조직
에서도 발견되어 확인되었고,13 발견된 위치에 따라 골수 줄기세포(BM-MSC, BMSC, MSC), 지방줄기세포(ASCs:
adipose stem cells, adsc: adipose-derived stromal cells, AD-MSC: adipose-derived multipotent stem cells), 근육 줄기세포(muscle-derived stem cells), 건 줄기세포(TSCs:
tendon stem cells), 치수줄기세포(DPSCs: dental pulp stem cells), 치아인대줄기세포(PDLSCs: periodontal ligament stem cells), SCAP (stem cells from apical papilla)등의 이 름을 가지고 있다.
현재까지 발표된 연구논문들을 종합하면, 신체의 거의 모 든 조직은 해당 조직을 재생하기 위한 줄기세포를 포함하고 있는 것으로 여겨지고 있다. 이러한 성체줄기세포들은 분화 가 안정적이고 pluripotency를 가지고 있지 않기 때문에 암 세포(teratoma)형성 가능성이 없고, 이미 임상적 적용이 가 능한 단계에 와있다.
이들 줄기세포들 중 치아주변조직에서 발견된 DPSCs, PDLSCs 등의 줄기세포들은 거의 모두 Songtao Shi 연구 그룹에서 분리 동정되어 발표되어 동일한 조건에서 배양 및 특성분석이 되었으므로 BMSCs와 체내 뼈분화(in vivo osteogenesis)의 측면에서 상호 비교분석이 된 바가 있다.14-16 동일한 조건에서 배양된 DPSCs, PDLSC, 그리고 BMSCs는 HA/TCP표면에 seeding 하여 누드마우스의 피하에 이식하 였을 때, 모두 미네랄화된 조직의 형성을 나타냈으나 조직의 형태는 유래한 조직에 따른 특성을 분명하게 보여준다.
BMSCs는 carrier인 HA/TCP의 표면에 뼈조직을 형성하였 고, 뼈조직 표면에는 조혈세포(hematopoietic cluster)로 구 성된 골수를 형성하였으나, PDLSCs는 HA/TCP 표면에 cementum과 유사한 미네랄화된 구조를 형성하였으며, 미 네랄화되지 않은 조직 부분은 섬유상의(fibrous) 치아인대 (periodontal ligament)와 유사한 형태를 형성하였다. 또한 DPSCs 역시 HA/TCP 표면에 dentin과 유사한 구조를 형성 하였으며 조혈세포로 구성된 골수의 형성은 보이지 않았다.
위의 결과로 미루어볼 때, 서로 다른 조직에서 발견된 MSCs 들은 조직 형성능에 있어서 특징적인 양상을 보일 것 으로 예측된다. 그러나, 새로이 발견되어 발표된 서로 다른 줄기세포들은 각각 여러 다른 연구그룹에 의해 발견되어 특
그림 3. 골수, 지방, 연골, 건, 인대에서 유래한 성체줄기세포의 체내 뼈분화유도(in vivo osteogenesis) 후 H&E 조직학적 염색 결과 (위)와 체외 지방분화유도 (in vitro adipogenesis) 후 oil-red O 염색 결과 (아래).17
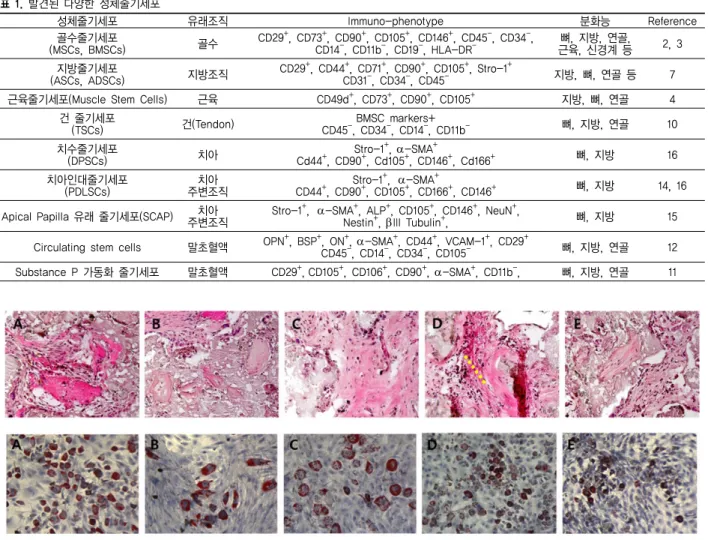
성체줄기세포 유래조직 Immuno-phenotype 분화능 Reference
골수줄기세포
(MSCs, BMSCs) 골수 CD29+, CD73+, CD90+, CD105+, CD146+, CD45-, CD34-,
CD14-, CD11b-, CD19-, HLA-DR- 뼈, 지방, 연골, 근육, 신경계 등 2, 3 지방줄기세포
(ASCs, ADSCs) 지방조직 CD29+, CD44+, CD71+, CD90+, CD105+, Stro-1+
CD31-, CD34-, CD45- 지방, 뼈, 연골 등 7 근육줄기세포(Muscle Stem Cells) 근육 CD49d+, CD73+, CD90+, CD105+ 지방, 뼈, 연골 4
건 줄기세포
(TSCs) 건(Tendon) BMSC markers+
CD45-, CD34-, CD14-, CD11b- 뼈, 지방, 연골 10 치수줄기세포
(DPSCs) 치아 Stro-1+, α-SMA+
Cd44+, CD90+, Cd105+, CD146+, Cd166+ 뼈, 지방 16 치아인대줄기세포
(PDLSCs) 치아
주변조직 Stro-1+, α-SMA+
CD44+, CD90+, CD105+, CD166+, CD146+ 뼈, 지방 14, 16 Apical Papilla 유래 줄기세포(SCAP) 치아
주변조직 Stro-1+, α-SMA+, ALP+, CD105+, CD146+, NeuN+,
Nestin+, βIII Tubulin+, 뼈, 지방 15 Circulating stem cells 말초혈액 OPN+, BSP+, ON+, α-SMA+, CD44+, VCAM-1+, CD29+
CD45-, CD14-, CD34-, CD105- 뼈, 지방, 연골 12 Substance P 가동화 줄기세포 말초혈액 CD29+,CD105+, CD106+, CD90+, α-SMA+, CD11b-, 뼈, 지방, 연골 11 표 1. 발견된 다양한 성체줄기세포
성분석이 이루어졌으므로, 각각 발표된 연구 논문 별로 사용 한 동물의 종이 다르고, 세포를 배양하는 시스템도 동일하지 않아, 분화능과 줄기세포의 이용성에 있어서 그 특징을 면밀 하게 비교할 수가 없었다.
그러므로 본 연구진에서는 근골격계 조직의 재생의 가능 한 세포들을 중심으로 동일한 실험동물에서 줄기세포를 분 리한 뒤, 엄밀하게 동일한 조건에서 각각 줄기세포들의 분화 특성을 비교 분석하였다.17
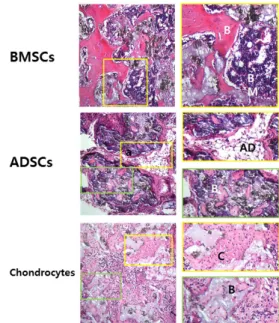
각각 골수, 지방, 연골, 건(tendon), 인대(ligament)에서 분리한 줄기세포들은 그림 2와 같이 유사한 수준의 클론 형 성 능력을 보였다. 그리고, 체외 지방분화 유도에 의해 지방 세포의 형성을 보였으며, HA/TCP와 함께 누드마우스의 피 하에 이식 시 모두 미네랄화 된 조직의 형성을 보였다(그림 3).
그러나, 체내 이식하여 형성된 조직들의 형태는 각각 유래 한 조직의 특징을 분명하게 나타내었다. 골수에서 유래된 BMSCs는 뼈조직 사이에 조혈세포로 구성된 골수를 형성한 반면 지방과 연골에서 유래된 세포들은 골수의 형성이 나타 나지 않았다. 또한, 지방유래의 줄기세포는 지방 조직을, 연
골유래의 줄기세포는 연골조직을 비교적 많이 형성하는 양 상을 보였다.
이러한 분화적 양상은 in vitro 연골분화과정에서도 분명 하게 나타난다. 그림 5에 나타난 바와 같이, 다양한 성체줄기 세포들은 모두 연골조직을 형성해냈으나, 연골유래 줄기세 포에서 가장 우수한 연골기질의 형성을 관찰할 수 있었다.
즉, 같은 조건의 개체로부터 얻은 다양한 조직에 존재하는 성체줄기세포는 유래조직에 따라 그 특성이 다름을 확인할 수 있었다. 이러한 결과를 표 2에 요약하였다.
성체줄기세포는 배아줄기세포와는 달리 배아의 형성과 파괴를 거치지 않으므로 실용화를 위한 개발에 있어서 윤리 적인 문제의 소지가 적으며, 안전성 면에서도 배아줄기세포 보다 뛰어나지만, 다음과 같은 단점이 존재한다.
첫째, 성체줄기세포는 조직 내에 극히 제한된 수가 존재하 므로 얻을 수 있는 세포수의 한계가 있다. 이러한 한계를 극 복하기 위하여 체외에서 확장배양을 하는 방법을 이용하게 되는데, 체외배양이 진행됨에 따라 줄기세포의 분화능은 감 소되며 노화가 일어나므로 세포 분화 유도시에 기능성을 제
성체줄기세포 In vitro 분화능
In vivo 분화능** 실용화 가능성 Osteogenesis Adipogenesis Chondrogenesis
BMSCs +++++ ++ ++ B + BM +++++
ADSCs ++ + NC* B + AD +++
XDSCs*** + + +++++ B + C +++
TLSCs + ++ +++ B +
LDSCs + ++ +++ B +
*Not Confirmed
**B: Bone matrix, BM: Bone marrow, AD: Adipose tissue, C: Cartilage
***XDSCs: xiphoid process cartilage-derived stem cells 표 2. 성체줄기세포의 특성 비교분석17
그림 4. 골수, 지방, 연골에서 분리한 성체줄기세포의 in vivo 분화결과 각각 유래 조직의 특징적인 분화특성을 나타낸다(B: 뼈조직, AD: 지방조직, C:
연골조직).17
그림 5. 골수(A), 연골(B), 건(C), 인대(D)에서 유래한 성체줄기세포를 이용한 in vitro 연골분화 결과(Saffranin O staining).17
대로 발휘하기 어렵다. 둘째, 이와 같은 확장배양에 따른 분 화능 감소와 더불어, 각 줄기세포가 유래한 조직의 특성을 보 유하는 경향을 가짐으로써 보이는 분화능의 한계가 cell plasticity의 한계를 결정하므로, 특정 성체줄기세포를 이용 할 때 특정 계통의 세포로만 분화가 가능하거나 분화능이 제한 된다는 단점이 있다. 예를 들어, 지방유래 줄기세포(ADSCs) 는 공여조직을 다량으로 얻을 수 있고, 공여조직을 얻는 과정 에서 donor site morbidity를 유발하지 않으므로 자가유래 줄기세포(autologous stem cell)로 이용이 용이하다. 그러 나, 표 2에 나타난 바와 같이, gold standard인 BMSCs에 비 교해볼 때 분화능이 현저하게 낮으므로 지방줄기세포의 이 러한 단점을 극복하기 위한 연구가 아직도 진행 중이다.
골격조직으로의 분화 과정에서 가장 우수한 분화능을 보 이는 것은 골수에서 분리한 BMSC이며, 다른 조직에서 유래 된 MSC들은 골격 조직으로의 분화 유도 시 비교적 낮은 분 화능을 보이기 때문에, 보다 분화능이 높은 줄기세포를 형성 하는 조건 형성에 대한 연구가 끊임없이 계속되어 왔다.
2.2 줄기세포의 우수한 분화능력을 얻기 위한 실험적 방법 성체줄기세포가 가지고 있는 한계를 극복하기 위하여 세 포의 plasticity의 조절을 통하여 줄기세포를 확보하기 위한 다양한 시도가 있었으며 이를 연금술로 비유하기도 한다.18,19
체세포의 분화능을 높이기 위하여 plasticity를 조절하는 실험적 방법은 Somatic Cell Nuclear Transfer (SCNT), cell fusion, 그리고 전사인자의 도입에 의하여 reprogramming 을 유도하는 유도만능줄기세포(iPSC)의 형성방법이 있다 (그림 6).
SCNT는 미수정난자의 핵을 제거하고 다른 세포의 핵을 치 환해 넣어 수정란의 상태를 유도하는 방법으로, pluripotent 한 줄기세포를 얻을 수 있으나, 배아의 형성과 파괴 과정을 거치므로 윤리적 문제를 안고 있다.
Cell fusion 방법은 체세포와 pluripotent stem cell을 융 합시켜, 도입된 체세포의 핵에 reprogramming을 유도하는 실험적인 방법이다.
유도만능줄기세포는 Shinya Yamanaka의 연구그룹에 서 마우스 및 인간의 체세포에 4개의 전사인자를 인위적 으로 발현시킴으로써 형성하였으며, 그 결과로 얻은 세포의 pluripotency는 teratoma(기형종)의 형성을 통하여 증명하 였다. 이들 방법의 장단점을 표 3에 요약하였다.
그림 6. Pluripotency를 유도하기 위한 방법.
SCNT Cell Fusion iPS Cells
생식세포 이용 이용 이용 이용하지 않음
배아형성 여부 포함 포함하지 않음 포함하지 않음
Plasticity Pluripotent 제한적 Pluripotent
염색체의 배수성(Ploidy) 2n 4n 2n
기술적 난점 Donor와 recipient 모두 stress가 커서
성공율이 극히 낮음. Fusion rate 낮음 Teratoma 형성 제어 필요
표 3. Pluripotency를 얻기 위한 실험적 방법 비교
이 세가지 방법은 각각 분화 잠재력을 높일 수 있다는 점 에서 장점이 있으나, 실용화가 되기 위해서는 윤리성 또는 안 전성 측면에서 해결해야 할 많은 문제가 남아있다. 그러므로 성체줄기세포의 분화능을 높게 유지할 수 있는 확장배양 및 stemness 유지 기술을 개발하여 이용하는 것이 보다 타당한 방법이라고 생각된다.
2.3 성체줄기세포의 이용성을 높이기 위한 방법
성체줄기세포의 이용성을 높이는 방법은 세포 자체가 가 지고 있는 기능성을 극대화시킬 수 있는 조건을 수립함으로 써 이루어질 수 있으며, 이를 위하여 달성하고자 하는 기술적 방법은 다음과 같이 요약될 수 있다.
첫째, 성체줄기세포의 특성분석을 통하여 보다 우수한 분 화능을 가지는 줄기세포의 탐색 및 분리기술 개발.
둘째, 충분히 필요한 수의 줄기세포를 확보할 수 있는 확 장배양 기술.
셋째, 성체줄기세포의 stemness를 유지하며 확장배양함 으로써 성체줄기세포에 내재된 분화능을 잃지 않거나, 극대 화할 수 있는 세포처리 기술.
이 중 첫번째 접근 방법의 예는 Paolo Bianco 연구 그룹에 서 2007년도에 Cell지에 발표한 연구논문에서 찾을 수 있다.
BMSCs라고 통칭되는 성체줄기 세포 군은 오랜 동안 특성분석 이 이루어졌으며 골수 내에 다양한 세포 표면 molecular marker 의 발현을 나타내는 heterogeneous한 subpopulation의 집 합체인 것으로 밝혀져 있다. 그 중 CD146을 발현하는 세포들 을 분리하여 배양하였을 때, 이들은 낮은 빈도의 세포를 배양 시에도 탁월한 클론생성능력을 보였으며, in vivo osteogenesis 측면에서 특히 월등한 분화능을 보이는 결과를 얻었다. 이러 한 세포들을 방사선조사된 마우스에 이식한 뒤 다시 동일 marker로 분리하여 특성분석을 하였을 때, 이식 하여준 수 와 유사한 수준의 CD146+ BMSCs를 얻을 수 있었다2.
두번째 접근방법의 연구는 다양한 방법으로 이루어지고 있다. 줄기세포 배양 시 성장인자를 처리하거나(그림 7),20 생 체재료를 이용하여 세포가 자랄 수 있는 표면적을 크게 제공 함으로써 확장배양이 유리하도록 하는 방법이 개발되었으 며, 이러한 방법들은 줄기세포의 확장 배양에 효과적인 것으 로 평가되고 있다.
세번째 접근방법은 배양 환경에 대한 세포의 반응성을 이 해하고 제어하여야 하는 방법이다. 성체줄기세포는 특징적 으로 유래한 조직의 특성을 보유하고 있으나, 이러한 특징은 성장인자나 배양방법을 변화시킴으로써 조절될 수 있다는 연구결과가 다수 보고되었으며, 따라서 성체줄기세포 역시 plasticity의 조절이 가능하다는 것을 의미한다. 이러한 방법 은 체외 확장배양기간 동안 계대가 진행됨에 따라 분화능이 감소되는 현상을 억제함으로써 성체줄기세포의 stemness를 유지할 수 있는 방법을 제공할 뿐만 아니라, 지방줄기세포와 같이 유래 조직의 특성을 보유함으로 인해 sub-optimal의 분화능을 보이는 성체줄기세포에 적용하여 분화능을 극대화 하여 나타내도록 하기 위한 방법을 제공할 수도 있을 것으로 기대된다. 발표되는 연구논문들을 고찰해보면, 신호전달인 자의 사용, 생체재료, 바이오리액터(bioreactor) 등 다양한 방 법을 이용하여 이러한 세포의 반응성을 제어한 경우를 찾아 볼 수 있으며, 이용되는 방법 별로 자세히 살펴보고자 한다.
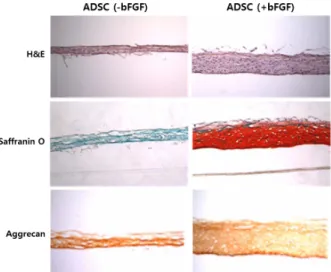
그림 8. bFGF의 전처리가 지방줄기세포의 연골분화능력에 미치는 영향.20 그림 7. bFGF의 지방줄기세포 확장배양에 대한 영향.20
2.3.1 생체재료(Biomaterials)
생체재료는 줄기세포를 원하는 형태로 이식할 수 있도록 하 는 지지체의 역할을 할 수 있으며, 분화과정에서 세포의 표현형 이 충분히 발휘될 수 있도록 하는 여건을 제공하는 기능을 가진 다. 이러한 현상에는 생체재료의 화학적 특성과 topology, stiffness, elasticity 등이 영향을 미치는 것으로 보고되었으며,21 일부 생체유래 세포외기질을 이용하여 성체줄기세포의 stemness 를 조절함으로써 분화능을 개선시킨 결과가 보고되기도 하 였으나,22 이러한 보고는 극히 제한적이고, 생체재료의 성체 줄기세포에 대한 영향은 줄기세포의 plasticity의 조절보다 는 분화과정에서 더 크게 나타나는 것으로 이해되고 있다.
2.3.2 성장인자 및 사이토카인(Growth Factors & Cytokines) 배양과정 중 배지에 첨가할 수 있는 성장인자나 cytokine, 배지 첨가물 등의 soluble factor들은 세포에서 다양한 신호 전달과정에 관여하며, 세포의 활성에 큰 영향을 미친다. 단순 한 성장인자의 처리 역시 생체재료와 마찬가지로 세포의 plasticity에는 명백한 영향을 미치지 못하나, 분화과정의 여 건이 변화된다기 보다는 세포자체의 특성을 변화시킴으로써 분화조건에 대한 반응을 증가시킨다는 점에서 그 기전이 다 르다. 이에 대한 예로, 본 연구팀에서 지방줄기세포의 확장배 양기간 동안만 bFGF를 처리한 후 처리하지 않은 세포와 동 일한 조건에서 분화 유도를 하였을 때, 분화능이 월등하게 높 아지는 결과를 얻었다.
bFGF는 배아 발생과정 중 발달중인 중배엽성 조직이 stemness를 잃지 않으면서 증식 상태(proliferating state)를 유지하여 조직형성에 필요한 만큼의 충분한 수의 세포를 만 들어낼 수 있도록 함으로써 중배엽 발생에서 중요한 역할을 담당한다. 발생과정에서 나타나는 이러한 현상을 조직공학 적인 조직재생 과정에 이용하기 위하여 bFGF를 stem/progenitor cell population 확장배양시에 이용하려는 시도가 여러 그룹 에서 연구되었는데, BMSCs를 이용한 연구에서 bFGF 처리 에 의해 mesenchymal progenitor cell의 체외배양시 줄기
세포의 질(stem cell quality)을 높이는 것이 확인되었으며,23 bFGF가 BMSC의 골분화를 촉진하고 골절 재생에 도움을 주 는 것으로 보고되었다.24,25 전반적으로 bFGF는 BMSCs의 골 형성 측면에서 긍정적인 영향을 나타내는 것이 보고된 반면, 지방줄기세포의 경우에는 bFGF가 근골격계 조직으로의 분 화에 있어서 분화능을 낮추는 것으로 지속적으로 보고가 되
어왔다.26,27 이는 분화배지에 bFGF가 포함되어 있을 때, 세
포분열을 촉진하는 bFGF의 기능이 분화과정을 방해하는 역 할을 하는데 기인한 것으로 생각된다. 따라서, 본 연구진은 bFGF를 분화과정 이전에 확장배양 중 4번의 계대를 진행하 는 동안 bFGF를 전처리한 뒤 연골조직으로 분화시킨 결과 보다 월등하고 우수한 연골분화를 확인하였다(그림 8). 이러 한 방법을 이용하면, 지방줄기세포와 같은 최적의 분화능을 보이지 않지만 얻기는 쉬운 지방줄기세포와 같은 성체줄기 세포의 이용성을 높여 재생의학적인 목적으로 이용가능성을 높일 수 있다. 이와 유사하게 줄기세포의 capacity를 높이는 영 향을 나타내는 성장인자 및 cytokine등으로 SDF-1,28 IL-6,29 Wnt,30 EGF, PDGF 등이 보고되어 있다.
2.3.3 바이오리액터(Bio-Reactor)
일반적인 세포의 배양 조건은 물리적인 자극을 포함하고 있지 않으나, 특수하게 설계된 배양 시스템을 이용하여(그림 9) 물리적인 자극을 조절 가능한 방법으로 세포에 전달할 수 있다. 세포에 물리적인 자극이 전달되었을 때, 세포의 분열과 생존에 영향을 미치는 여러 성장인자들이 활성화된다는 결 과가 보고되어 있으므로 이러한 mechano-transduction을 적절하게 조절하는 방법은 성체줄기세포의 이용가능성을 높 이는 데에 이용될 수 있다. 본 연구팀에서 마우스에서 분리한 섬유아세포(fibroblast)에 tensile stimulus를 전달한 뒤 당 뇨모델의 마우스의 피부결손 부위에 이식한 결과, tensile
분화계통 전사인자 Species Pluripotent SC Oct4, Sox2, Klf4, c-Myc Human,
Mouse
Myocyte MyoD Human,
Mouse Macrophages c/EBPα, PU.1 Human,
Mouse Brown fat PRDM16, c/EBPβ Human,
Mouse Hematopoietic
progenitors Oct4 Human
Cardiomyocytes Gata4, Tbx5, Mef2c Mouse Hepatocytes Gata4, Hnf4α, HNF1α,
Foxa1, Foxa3 Mouse
Glutamatergic neurons
Brn2, Ascl1, Myt1 Human Ascl1, Brn2, Zic1 Human,
Mouse Brn2, Myt1, miR-124 Human Glutamatergic+
GABAergic neurons
Ascl1, Myt1, NeuroD2,
miR-9, miR-124 Human Motor neurons BAM+, Lhx3, Hb9, Isl1, Ngn2 Human,
Mouse Neural progenitors Brn2, Sox2, Foxg1 Mouse
Dopaminergic neurons
Ascl1, Nurr1, Lmx1a, BAM+, Lmx1a, Foxa2
Human, Mouse 표 4. 전사인자를 이용한 체세포의 직접교차분화 유도방법32 그림 9. 세포 배양 중 tensile stimulus를 전달하는 데 사용되는 FlexCell(R)
FX4000 system의 작동 방식.31
그림 10. 물리적자극을 이용하여 활성화 시킨 섬유아세포의 체내 이식 후 생존능력(A)과 상처치유 효과(B).31
stimulus를 가한 그룹에서는 대조군에 비해 이식한 세포의 생존능력이 현저하게 증가하였으며, 이러한 결과는 상처치 유과정에 큰 차이를 나타냈다(그림 10).31
2.3.4 직접교차분화(Direct Conversion)
유도만능줄기세포를 형성하는 방법과 같이 전사인자를 세포 내에 도입함으로써 체세포를 타겟으로하는 조직의 전 구세포로 직접 교차분화를 유도할 수 있는 방법에 대한 연구 는 유도만능줄기세포가 개발되기 이전부터 시도되어 왔다.
이러한 직접교차분화 연구의 초기에는 섬유아세포에 MyoD 유전자를 발현시켜 근육모세포를 제조하거나, 췌장세포에 c/EBP- β유전자를 발현시켜 간세포로 유도하는 등 같은 배 엽성 내에서의 교차분화만이 가능한 것으로 생각되었으나, 현 재에는 표 4에 요약된 바와 같이 다양한 시도가 이루어지고 있다. 이러한 직접교차분화의 결과로 타겟조직에서 나타나는 유전자의 발현을 교차분화의 증거로 삼는 경향이 있으나, 궁극 적으로 기능성을 나타내는 세포로의 변화가 일어날 수 있는 핵심 타겟 유전자의 발굴에 대한 계속적인 연구가 필요하다.
또한, 전사인자를 세포내에 도입을 유도하는 과정을 포함하는 유도만능즐기세포나 직접교차분화 방법은 도입된 유전자가 유전체 상에 무작위로 Knock-in 방식의 돌연변이를 형성할 수
있으며, 또한 유전자 도입과정에서 바이러스성 machinery 를 이용하는 등 안전성 측면에서 우려되는 점이 있으므로 세 포치료에 이용되기 위해서 극복해야 할 과제가 남아있다.
2.3.5 소분자화합물(Small Molecules)
유기합성 방법의 발전에 따라 chemical library라 부르는 대략 40,000-100,000개의 화합물로 구성된 high throughput screening system을 이용하여 세포에 대하여 특별한 활성을 나타내는 소분자 화합물을 선별하는 연구가 진행되었다. 이 러한 초기의 screening 방법에 의해 동정된 화합물 중 myoseverin이라는 화합물은 분화된 근세포의 동일한 세포 질에 존재하는 핵이 세포분열을 거쳐 단핵세포의 형태로 변 화되는 탈분화와 유사한 과정을 유도하였다. 또한, reversine 은 마우스의 근육모세포(myoblast)인 C2C12 세포를 보다 덜 분화된 상태로 유도하여 지방분화 및 뼈분화가 가능한 세 포로 변화시켰다. 이 외에도 Oct4와 Klf4 두개의 전사인자 만을 도입함으로써 유도만능줄기세포를 형성할 수 있도록 작용하는 소분자 화합물(BIX-01294, RG108)과 역분화 과 정의 효율을 높일 수 있는 5-Azacytidine, Trichostatin A, Valproicacid 등과 같은 다양한 소분자 화합물의 기능이 확 인되어 있다.33,34
3. 결론
유도만능줄기세포는 환자 유래의 세포로부터 만능줄기세 포를 형성함으로써 면역거부반응을 유도하지 않는 환자맞춤
유도만능줄기세포 직접교차분화
세포분열 필요 필요하지 않음
역분화 강도 완만 빠름
역분화 효율 낮음 높음
잠재적 종양 가능성 높음 낮음
타겟 세포 형성방법 2단계
(역분화 후 분화유도) 1단계
세포 확장 능력 높음 제한적
표 5. 유도만능줄기세포와 직접교차분화 유도 방법의 특징 비교
형 줄기세포를 형성할 수 있다는 장점이 있으나, teratoma의 형성을 제어할 수 있는 안전성을 확보하기 위한 기술이 개발 되기 까지는 직접적인 재생의학적 이용성이 가능하지 않은 상 태이다. 그러나, 유전적 질병에 대한 환자 맞춤형 screening system을 형성하여 질환의 진단 및 타겟 약물 발굴 등에 효 율성 있게 이용할 수 있다.
이에 비교하여 직접교차분화 방법은 pluripotency를 유 도하지 않으므로 잠재적 종양 위험성의 측면에서는 안전성 이 더 높으나, 세포의 확장배양이 어려우므로 타겟 조직의 특 성상 충분히 많은 수의 세포가 확보 되어야 하는 경우 실용 가능성이 떨어진다는 단점이 있다. 또한, 외래 유전자를 도입 하는 과정의 효율성과 안전성의 문제에 있어서 개선의 여지 가 남아있다.
그러므로, 성체줄기세포의 활성을 조절하여 이용가능성 을 높이는 방법이 현재로서는 세포치료제로 실용화하는데 있어서 가장 실현가능성이 높은 방법이라고 볼 수 있다.
줄기세포에 대한 연구를 통하여 타겟 조직으로 전환시키 기 위한 분화 프로토콜이 지속적으로 연구되어 보고되고 있 으므로, 다양한 타겟 조직으로의 재현성 있는 분화과정에 대 한 확실한 제어를 통해 더 큰 줄기세포의 이용가능성 및 학 문적 측면의 발전이 있을 것으로 기대된다.
참고문헌
1. A. J. Friedenstein, K. V. Petrakova, A. I. Kurolesova, and G. P.
Frolova, Transplantation, 6, 237 (1968).
2. B. Sacchetti, A. Funari, S. Michienzi, S. D. Cesare, S. Piersanti, I. Saggio, E. Tagliafico, S. Ferrari, P. G. Robey, M. Riminucci, and P. Bianco, Cell, 131, 324 (2007).
3. M. Dominici, K. L. Blank, I. Mueller, I. Slaper-Cortenbach, F.
C. Marini, D. S. Krause, R. J. Deans, A. Keating, D. J. Prockop, and E. M. Horwitz, Cytotherapy, 8, 315 (2006).
4. W. M. Jackson, T. P. Lozito, F. Djouad, N. Z. Kuhn, L. J. Nesti, and R. S. Tuan, J. Cell Mol. Med., 15, 2377 (2011).
5. K. Hiraoke, S. Grogan, T. Olee, and M. Lotz, Biotheology, 43, 447 (2006).
6. C. De Bari, F. Dell’Accio, P. Tylzanowski, and F. P. Luyten, Arthritis. Reum., 44, 1928 (2001)
7. P. A. Zuk, M. Zhu, H. Mizuno, J. Huang, J. W. Futrell, A. J. Katz, P.
Benhaim, H. P. Lorenz, and M. H. Hedrick, Tissue Eng. 7, 211 (2001).
8. B. L. Yen, H. I. Huang, C. C. Chien, H. Y. Jui, B. S. Ko, M. Yao, C. T. Shun, M. L. Yen, M. C. Lee, and Y. C. Chen, Stem Cells, 23, 3 (2005).
9. O. K. Lee, T. K. Kuo, W. M. Chen, K. D. Lee, S. L. Hsieh, and T. H. Chen, Blood, 103, 1669 (2004).
10. Y. Bi, D. Ehirchiouo, T. M. Kilts, C. A. Inkson, M. C. Embree, W. Sonoyama, L. Li, A. I. Leet, B. M. Seo, L. Zhang, S. Shi, and M. F. Young, Nature Med., 13, 1219 (2007).
11. H. S. Hong, J. Lee, E. A. Lee, Y. S. Kwon, E. Lee, W. Ahn, M.
H. Jiang J. C. Kim, and Y. Son, Nature Med., 4, 425 (2009).
12. S. A. Kuznetsov, M. H. Mankani, S. Gronthos, K. Satomura, P.
Bianco, and P. G. Robey, J. Cell Bio., 153, 1133 (2001).
13. N. Z. Kuhn and R. S. Tuan, J. Cell Phys., 222, 268 (2009).
14. B. M. Seo, M. Miura, S. Gronthos, P. M. Bartold, S. Batouli, J.
Brahim, M. Young, P. G. Robey, C. Y. Wang, and S. Shi, Lancet, 364, 149 (2004).
15. W. Sonoyama Y. Liu, T. Yamaza, R. S. Tuan, S. Wang, S. Shi, and G. T. J. Huang, J. Endod., 34, 166 (2008).
16. N. Wada, D. Menicanin, S. Shi, P. M. Bartold, and S. Gronthos, J. Cell. Phys., 219, 667 (2009).
17. H. M. Cho, S. W. Nam, J. Jang, E. Lee, E. A. Lee, and Y. Son, Tissue Eng. Regen. Med., 7, 355 (2010).
18. M. S. Rutenberg, T. Hamazaki, A. M. Singh, and N. Terada, Int.
J. Hematol., 79, 15 (2004).
19. R. S. Oliveri, Future Medicine, 2, 795 (2007).
20. G. S. Yoo, E. Lee, J. Jang, E. A. Lee, Y. Son, Tissue Eng. Regen.
Med., 7, 93 (2010).
21. D. E. Discher, D. J. Mooney, and P. W. Zandstra, Science, 324, 1673 (2009).
22. B. Sudha, S. Jasty, S. Krishnan, and S. Krishnakumar, Indian J.
Med. Res., 129, 382 (2009).
23. E. Yamachika, H. Tsujigiwa, M. Matsubara, Y. Hirata, K. Kita, K. Takabatake, N. Mizukawa, Y. Kaneda, H. Nagatsuka, and S.
Iida, J. Mol. Histol., 43, 223 (2012).
24. X. Jiang, S. Zou, B. Ye, S. Zhu, Y. Liu, and J. Hu, Bone, 46, 1156 (2010).
25. K. Kamo, N. Miyakoshi, Y. Kasukawa, H. Sasaki, and Y.
Shimada, J. Orthop. Sci., 14, 811 (2009).
26. N. Quarto and M. T. Longaker, Tissue Eng., 12, 1405 (2006).
27. N. Quarto, D. C. Wan, and M. T. Longaker, Bone., 42, 1040 (2008).
28. A. Kortesidis, A. Zannettino, S. Isenmann, S. Shi, T. Lapidot, and S. Gronthos, Blood, 105, 3793 (2005).
29. K. L. Pricola, N. Z. Kuhn, H. Haleem-Smith, Y. Soㄴng, and R.
S. Tuan, J. Cell Biochem., 108, 577 (2009).
30. N. Golestaneh, E. Beauchamp, S. Fallen, M. Kokkinaki, A. Uren, and M. Dym, Reproduction, 138, 151 (2009).
31. E. Lee, D. Y. Kim, E. Chung, E. A. Lee, K. S. Park, and Y. Son, Cell Transplant, In press.
32. T. Vierbuchen and M. Wernig, Molecular Cell, 47, 827 (2012).
33. L. Anastasia, G. Pelissero, B. Venerando, and G. Tettamanti, Cell Death & Diff., 17, 1230 (2010).
34. T. Ma, M. Xie, T. Laurent, and S. Ding, Circ. Res., 112, 562 (2013).