새로이 분리된 Klebsiella pneumoniae 균주들의 글리세롤 기반 3-hydroxypropionic acid 및 1,3-propanediol 동시 생산성 평가
고연주, 설은희, 순달아 세칼 바라지, 권성진, 이재현, 박성훈*
Evaluation of Newly Isolated Klebsiella pneumoniae Strains for the Co- Production of 3-hydroxypropionic acid and 1,3-propanediol from Gly- cerol
Yeounjoo Ko, Eunhee Seol, Balaji Sundara Sekar, Seongjin Kwon, Jaehyeon Lee, and Sunghoon Park*
Received: 3 October 2016 / Revised: 21 November 2016 / Accepted: 25 November 2016
© 2016 The Korean Society for Biotechnology and Bioengineering
Abstract: Co-production of 3-hydroxypropionic acid (3-HP) and 1,3-propanediol (1,3-PDO) was suggested as an innova- tive strategy to overcome several limitations occurring in the single production of 3-HP from glycerol. In this study, two new isolates of Klebsiella pneumoniae, which produce less lipopolysaccharide (LPS) thus considered less pathogenic than K. pneumoniae DSM 2026, were compared and evalu- ated for their potential for the co-production of 3-HP and 1,3- PDO. The newly isolated strains showed significantly faster sedimentation rate than DSM, which should be beneficial for downstream processing. Analysis of genome sequences of the isolates confirmed the presence of all genes necessary for glycerol assimilation, 1,3-PDO production and biosynthesis of coenzyme B
12. Co-production yield was highest under anaerobic condition while cell growth was highest under aer- obic condition. Both strains showed similarly good perfor- mance for the co-production although J2B gave the slightly higher co-production yield of 0.80 mol/mol than GSC021 (0.75 mol/mol). The evaluation of the newly developed strains presented here should be useful in designing similar evaluation experiments for other microorganisms.
Keywords: Klebsiella pneumoniae, 3-hydroxypropionic acid, 1,3-propanediol, Co-production, Glycerol
1. INTRODUCTION
3-Hydroxypropionic acid (3-HP)는 재생 가능한 원료 기반 중 간체로써 US department of energy (DOE)에서 선정한 12개의 중요한 platform chemicals 중 3번째로 중요한 platform chem- ical로 알려져 있다. 3-HP는 acrylic acid, 1,3-propanediol (PDO), methyl acrylate, acrylamide, ethyl 3-HP, malonic acid, propio- lactone, acrylonitrile 등 다양한 화합물들의 유기합성을 위한 전구체로 사용할 수 있다. 또한 고분자 코팅, 금속 윤활유를 위한 가교제 및 정전기 방지제로 사용될 수 있다. 3-HP의 시 장규모는 계속적으로 확대되고 있는 추세이며, 그 가치는 3- HP 로부터 유래되는 화합물의 시장을 통해 추정할 수 있다. 3- HP를 이용해 전환할 수 있는 대표적 플랫폼 물질인 아크릴산 은 2015년 기준으로 전 세계 시장규모가 11조원 이상이며, 한 국 시장 규모는 약 2000억원 이상이다 [1]. 앞으로 글로벌 아 크릴산 시장 가치는 2014~2020년 190억 달러에 도달할 것으 로 예상하고 있다 [2].
이러한 가치를 가지는 3-HP의 생물학적 생산은 재조합 Escherichia coli와 Klebsiella pneumoniae 등의 다양한 미생물 을 이용하여 많은 연구가 되어 왔다 [3-10]. 그러나 여전히 상 업적으로 3-HP를 생산하기 위한 높은 농도, 높은 생산성, 높 은 수율 등의 요구조건을 충족시키지 못하고 있다. 따라서 3-
부산대학교 화공생명공학과Department of Chemical and Biomolecular Engineering, Pusan National University, Busan 46241, Korea.
Tel: +82-51-510-3386, Fax: +82-51-515-2716 e-mail: parksh@pusan.ac.kr
연구논문
HP 생산을 향상 시키기 위해서는 3-HP 생산 시 발생되는 문 제점들을 효과적으로 해결할 수 있는 연구가 필요하다. 3-HP 생산에서 가장 큰 문제점은 생성물 또는 중간생성물이 미생 물에 독성 물질로 작용하는 것이다. 생성물인 3-HP의 농도가 200~300 mM 를 초과하게 되면 세포 성장 및 글리세롤 소모 속도가 급격히 감소되면서 결국 3-HP 생산 속도에 영향을 미 친다. 또한 3-HP의 중간 생성물인 3-hydroxypropionaldehyde (3-HPA) 가 세포 내에 15~30 mM 정도로 축적되면 세포 성장 이 멈추면서 3-HP 생산이 중단되는 것으로 알려져 있다. 또 다른 주요 문제점은 3-HP 생산 시 필요한 NAD
+, coenzyme B
12등과 같은 조효소의 공급이 원활하지 못한 것이다. coen- zyme B
12는 글리세롤을 이용한 3-HP 생산에서 필요한 첫 번 째 효소인 glycerol dehydratase (GDHt)의 필수 조효소로, co- enzyme B
12가 부족할 경우 관련된 효소 활성이 저하되기 때 문에 계속적으로 공급해주어야 한다. 또한 두 번째 효소인 aldehyde dehydrogenase (AldH)는 조효소로 NAD
+를 요구하 며, NAD
+의 계속적인 공급을 위해서는 NADH의 산화와 이 를 위한 지속적인 산소 공급이 필요하다. 따라서 글리세롤 이 용능력이 우수하고 coenzyme B
12생산이 가능한 많은 미생물 들을 이용하여 3-HP 생산 연구가 이루어졌다. 그러나 많은 미생물들이 NAD
+가 계속적으로 재생되는 aerobic 조건에서 coenzyme B
12를 효과적으로 생산하는데 어려움이 있었다. 또 한 anaerobic 조건에서 NAD
+의 재생을 위해 nitrate를 이용하 여 3-HP 생산을 시도하였으나, nitrate가 환원되면서 발생되 는 nitrite의 축적이 세포에 독성을 가지는 것으로 확인되었다 [2,8].
글리세롤로부터 두 단계로 이루어지는 3-HP와 1,3-propa- nediol (1,3-PDO) 생산은 서로 밀접한 관계를 가지고 있을 뿐 만 아니라 두 물질 모두 다양한 화학물질과 원료 제조에 사용 되는 고부가 가치의 폴리머로 활용가치가 높은 것으로 평가 되고 있다 [11-13]. 따라서 3-HP와 1,3-PDO의 동시생산은 3- HP의 단독 생산에서 오는 여러 가지 한계점을 극복할 수 있 는 효과적인 전략이 될 수 있다. 먼저 GDHt로부터 생산되는 중간생성물인 3-HPA를 공통적으로 사용하고 있어 3-HPA 축 적으로 인한 세포 성장 저해 문제를 해결할 수 있다. 또한 3- HP 및 1,3-PDO 생산 과정에서 발생하는 조효소를 교차 사용 함에 따라 효과적으로 NAD(H) 재생을 충족시킬 수 있다. 즉, 3-HP 생산에 의해 생성되는 NADH를 1,3-PDO 생산에 필요 한 1,3-propanediol oxidoreductase (DhaT)의 조효소로 사용하 고, 1,3-PDO 생산에 의해 생성되는 NAD
+를 3-HP 생산에 필 요한 AldH의 조효소로 사용하게 되면 조효소 재생에 따른 문 제가 근본적으로 해결되며 따라서 효과적인 목적 생산물의 수율 향상을 기대할 수 있다. 또한 동시생산을 위해 aeration 이 아닌 microaerobic나 anaerobic 조건을 선택함으로써 coen- zyme B
12생산 문제를 해결할 수 있다.
여러 그룹에서 이와 같은 전략에 기반하여 재조합 K. pneu- moniae를 이용하여 성공적인 결과를 발표하였다 [14-18].
Ashok et al.이 K. pneumoniae DSM2026에 K. pneumoniae 유 래의 AldH인 PuuC를 과발현하고 DhaT를 제거하여 3-HP와
1,3-PDO를 24시간 동안 각각 16.0 g/L와 16.8 g/L씩 비슷한 수준으로 생산할 수 있음을 보여주었다 [14]. Huang et al.은 3-HP 와 1,3-PDO 동시생산에 있어 다양한 AldH의 효과를 조 사하였다 [17]. 그 결과 E. coli의 γ-glutamyl-γaminobutyral- dehyde dehydrogenase 를 K. pneumoniae에 과발현하였을 때 3-HP 및 1,3-PDO 생산 능력이 가장 우수한 것으로 확인되었 다. 즉, 24시간 동안 anaerobic condition에서 24.4 g/L의 3-HP 와 49.3 g/L의 1,3-PDO를 생산하는 것을 보여주었다. 또한 같 은 균주를 이용하여 aeration을 1.5 vvm으로 증가시켰을 때 48.9 g/L의 3-HP와 25.3 g/L의 1,3-PDO를 생산하는 것을 보여 주었다 [18]. Kumar et al.는 부산물 생산을 피하기 위해 rest- ing cell을 사용하였으며, 그 결과 11.3 g/L의 3-HP와 15.2 g/L 의 1,3-PDO를 생산할 수 있었다. 또한 lactate dehydrogenase (ldhA)를 제거한 균주를 이용하였을 때 3-HP 22.7 g/L, 1,3- PDO 23.5 g/L의 생산량과 함께 yield가 0.71에서 0.77로 향상 된 결과를 얻었다 [15,16].
이와 같이 선행 연구에서 다양한 AldH의 효과 및 aeration 조건에 의한 3-HP와 1,3-PDO의 생산성 변화에 대한 조사가 이루어졌다. 또한 resting cell을 이용하여 부산물 생산 감소를 통한 3-HP 및 1,3-PDO 동시생산성 향상 가능성을 알아보았 다. 비록 다양한 조건에서 3-HP 및 1,3-PDO 생산성 가능성을 알아보고 이를 향상 시키기 위한 연구가 이루어졌지만, 상업 적으로 의미있는 수준에 도달하지는 못하였다. 뿐만 아니라 대부분 실험에서 사용된 K. pneumoniae는 상업적 적용에 제 약이 따르는 병원성 균주라는 단점이 있었다. 따라서 3-HP 및 1,3-PDO의 효과적인 동시 생산을 위해서는 병원성 문제 가 적은 K. pneumoniae 균주를 선택하여 3-HP 및 1,3-PDO 동 시 생산의 가능성과 한계를 조사할 필요성이 있다.
본 연구의 목적은 병원성이 없다고 알려진 K. pneumoniae 를 이용해 3-HP와 1,3-PDO의 동시생산 가능성 및 한계를 조 사하는 것이다. Lipopolysaccharide (LPS) 생산성이 거의 없고, 글리세롤 이용 능력이 우수한 K. pneumoniae J2B (J2B)와 K.
pneumoniae GSC021 (GSC021)를 분리하였으며 [19], 분리된 균주들의 침강 양상과 동시생산 관련 유전자 조사를 통해 산 업 균주로써의 가능성 및 동시생산 가능성 등을 알아보았다.
또한 새로이 분리한 두 균주에 3-HP 및 1,3-PDO 동시생산을 위해 KGSADH 유전자를 과발현한 재조합 K. pneumoniae 균 주들을 개발하였으며, 개발된 재조합 균주들의 동시생산 배 양조건 영향을 알아보았다. 배양조건의 영향은 배양배지, 온 도, Aeration 등에 대해 조사하였으며, 최종적으로 가장 최적 화된 조건에서 배양된 세포들의 효소 활성 측정을 통해 두 균 주 사이의 동시생산 생산 능력 차이와 한계를 살펴보았다.
2. MATERIALS AND METHODS
2.1. 균주 및 재료
본 연구에 사용된 Klebsiella pneumoniae J2B는 혐기성 소화
조로부터 분리되었으며 [18], Klebsiella pneumoniae GSC021
은 GS Caltex research group에서 분리하였다. Miniprep과 DNA gel extraction kits는 Qiagen (Mannheim, Germany)로부 터 구입하였다. Primer는 Cosmotech Co. Ltd. (Seoul, Korea) 로부터 합성하였다. 3-HP는 Tokyo Kasei Kogyo Co. Ltd, To- kyo, Japan (TCI America) 로부터 구입하였다. LB broth (Cat.
244610), yeast extract (Cat. 212750), Bacto
TMtryptone (Cat.
211705)는 Difco (Becton Dickinson; Franklin Lakes, NJ, USA) 로부터 구입하였다. 글리세롤을 비롯한 모든 화학물질과 효 소는 따로 표기하지 않는 한 Sigma-Aldrich (St. Louis, MO, USA) 로부터 구입하였다.
2.2. AldH를 과발현한 재조합 K. pneumoniae 균주의 제작 Table 1 은 본 연구에 사용된 균주, 플라스미드를 나타내고 있 다. AldH를 과발현하기 위해 Azospirillum brasilense로부터 유래된 aldehyde dehydrogenase (KGSADH) 유전자를 pUC19 벡터에 클로닝한 pUC19/KGSADH 재조합 플라스미드가 사 용되었다 [7]. E. coli pUC19/KGSADH로부터 miniprep 방법 으로 재조합 pUC19/KGADH 플라스미드를 추출하였으며, 분리된 재조합 플라스미드 pUC19/KGSADH는 전기천공법 을 사용하여 K. pneumoniae J2B와 K. pneumoniae GSC021에 각각 도입하였다. pUC19/KGSADH 플라스미드가 도입된 재 조합 K. pneumoniae 두 균주는 각각 J2B KGSADH, GSC021 KGSADH 로 명명하였다.
2.3. 배양조건
균주의 개발 및 관리를 위해서는 Luria-Bertani (LB) medium 이 사용되었으며, 배양조건은 진탕배양기에서 온도 37°C, 교 반속도 200 rpm이 되도록 유지하였다. 3-HP 및 1,3-PDO 동시 생산을 위한 배지는 M9 최소 배지에 미량원소를 첨가한 배 지와 첨가하지 않는 배지가 사용되었다. M9 최소배지의 조 성은 증류수 1 L에 100 mM potassium phosphate buffer (pH 7.0), 220 mM glycerol, 1.0 g/L yeast extract, 1.0 g/L NaCl, 1.0 g/L NH
4Cl, 0.25 g/L MgSO
4·7H
2O로 구성된다. 또한 미량원소 로는 70 mg/L ZnCl
2, 100 mg/L MnCl
2·4H
2O, 60 mg/L H
3BO
3, 200 mg/L CoCl
2·4H
2O, 20 mg/L CuCl
2·2H
2O, 25 mg/L NiCl
2· 6H
2O, 35 mg/L Na
2MoO
4·2H
2O, 5.0 g/L FeSO
4·7H
2O 가 사용되 었다 [16]. 세포 내 재조합 플라스미드 유지를 위해 배지에 50 μg/mL의 kanamycin이 포함되도록 하였으며, 플라스미드의 과발현을 유도하기 위해 isopropyl-β-D-thiogalactopyranoside
(IPTG)가 0.2 mM 농도로 첨가되었다. 배양조건에서 aeration 을 조절하기 위해 250 mL 플라스크에 배양액의 부피를 50 mL, 100 mL 로 달리하였으며, 이 조건을 각각 aerobic, micro- aerobic으로 간주하였다. anaerobic 조건은 serum bottle을 부 틸고무마개와 알루미늄캡으로 밀봉하고 아르곤 가스를 주입 하여 형성하였다.
2.4. 효소 활성 측정
DhaB 효소 활성은 AldH의 효소 활성과의 커플링 반응에 의 해 분석되었으며, NAD
+의 환원 속도를 UV-spectrophotometer 340 nm에서 관찰하였다. 산소에 의한 DhaB 효소의 불활성화 를 피하기 위해서 효소 활성은 모두 혐기성 조건에서 수행하 였다. 간단하게 DhaB 효소 활성 측정 방법을 설명하면 다음 과 같다. 먼저 potassium phosphate buffer (20 mM, pH 8.0)에 3 mM MgCl
2와 40 mM 1,2-propanediol을 넣은 반응 혼합물을 anaerobic cuvette에 넣고 질소 가스를 주입하여 혐기성 상태 를 만든다. 상기 반응 혼합물에 crude cell extract와 12 U의 alcohol dehydrogenase (A3263, Sigma) 를 주사기로 넣은 뒤, 37°C로 설정된 항온수조에서 3분 동안 전배양시킨다. 효소반 응은 최종 부피가 2 mL이 되도록 하여 0.2 mM NAD
+, 1.5 mM ATP, 15 µM coenzyme B
12의 첨가로 개시한다 (Unpublished data). AldH의 활성은 340 nm에서 NAD
+가 NADH로 환원되 는 속도를 측정하여 결정하였다 [6]. DhaT의 활성은 효소의 역반응 (1,3-PDO에서 3-HPA)을 통해 측정하였으며, 구체적 인 효소 활성 측정은 Suman et al.에 의해 기술된 방법을 사용 하였다 [20].
2.5. 분석 방법
배양된 세포의 농도는 UV spectrophotometer (Lambda 20, Perkin Elmer, USA)를 이용하여 600 nm에서 optical density (OD
600) 로 측정하였다. 글리세롤, 3-HP, 1,3-PDO 및 여러 대사 물질들의 생산량은 2.5 mM H
2SO
4를 이동상으로 사용하여 high-performance liquid chromatography (Agilent Technologies, HP, 1200 series)로 분석하였다. 분석 샘플은 배양액을 채취하 여 13,000 rpm에서 10분간 원심분리한 후 상등액을 회수하여 0.2 μM nylon 필터로 여과하여 준비하였으며, 컬럼은 300 × 7.8 mm Aminex HPX-87H (Bio-Rad, USA)를 이용하였다. 효 소활성 분석에 사용된 단백질 농도는 Bradford assay를 사용 하여 정량하였다 [21].
Table 1. List of strains and plasmids used in this study
Strains and plasmids Description Source/reference
Strains
E. coli DH5 alpha Cloning host KCCM, Korea
J2B Expression host: Klebsiella pneumoniae J2B [19]
J2B KGSASDH Klebsiella pneumoniae J2B harboring KGSADH on the pUC19 plasmid This study
GSC021 Expression host: Klebsiella pneumoniae GSC021 GS caltex
GSC021 KGSADH Klebsiella pneumoniae GSC021 harboring KGSADH on the pUC19 plasmid This study Plasmid
pUC19/KGSADH pUC19-lac promoter; KGSADH; Kmr [7]
3. RESULTS AND DISCUSSION
3.1. 새로이 분리된 K. pneumoniae 균주들의 침강 양상 비교 균주들의 침강 특성은 분리정제 공정에 있어 필수적인 고려 사항인데 이는 생물공정의 상업화에 중요한 역할을 하기 때 문이다 [22]. LPS 생산량이 많을수록 세포 침전이 어려우며, 원심 분리 후에도 세포가 쉽게 배지에 분산되는 침강 특성을 가진다 [19]. 따라서 LPS 생산량이 많고 침강 능력이 떨어지 는 K. pneumoniae DSM2026 (DSM2026)을 대조군으로 사용 하여 새로이 분리된 J2B와 GSC021의 침강 양상을 비교하였 다 (Fig. 1). 침강 양상을 조사하기 위해 균주를 M9 배지에서 24시간 동안 37°C, 200 rpm으로 배양하였으며, 세포 성장 정 도를 측정하여 ~3 OD
600정도의 세포 양을 가지도록 2 mL tube에 수집하였다. 침강 양상은 원심분리 시간을 달리하여 비교하였으며, 원심분리를 시킨 뒤 한차례 뒤집었을 때의 변 화도 관찰하였다. 그 결과 원심분리를 5000 rpm에서 2분간 하였을 경우, DSM2026은 거의 침강이 되지 않았으며 GSC 021 는 DSM2026보다는 침강 정도가 높았으나, J2B보다는 낮 았다. 또한 5000 rpm에서 10분간 원심분리를 하였을 경우, DSM2026은 여전히 buffer에 분산되어 있었으나 GSC021과 J2B는 모두 안정적인 세포 침전이 얻어졌다. 5000 rpm에서 10분간 원심분리 후 한차례 뒤집었을 경우에 확실하게 DSM 2026 < GSC021 < J2B 순서로 침강 정도가 높은 것을 알 수 있 었다. 침강 특성 면에서 DSM2026에 비해 J2B와 GSC021이 우수한 균주임을 알 수 있다. 또한 이와 같은 침강 특성은 새 로 분리된 균주들의 LPS 생산량이 DSM2026에 비해 적다는 것을 의미한다.
3.2. J2B와 GSC021에서 글리세롤 assimilation 및 coenzyme B
12합성 관련 유전자들의 조사
J2B 와 GSC021에서 글리세롤 assimilation 및 coenzyme B
12에 관련된 주요 오페론들의 차이를 알아보기 위해 dha, glp, cob 오페론 등의 protein sequence 를 분석하였다 (Fig. 2(a)). J2B 의 genome 정보는 whole genome sequencing으로, GSC021 정 보는 contigs 형태로 획득하였다. K. pneumoniae는 글리세롤 assimilation 을 위한 대사경로가 잘 발달되어 있다. 특히 dha 오페론은 reductive assimilation pathway에 관련되어 있으며, glp 오페론은 oxidative assimilation pathway에 관련되어 있는 것으로 알려져 있다. J2B와 GSC021 모두 dhaK, dhaK2 (dhaL), dhaK3 (dhaM) 등 reductive pathway에 관련된 유전자들이 함 께 cluster되어 있는 것으로 확인되었으며, dha 오페론의 tran- scription regulator인 dhaR 또한 두 균주 모두에서 확인되었다.
이 오페론들의 protein sequence alignment를 수행한 결과, J2B 와 GSC021이 99% 상동성을 가지는 것으로 나타났다. oxida- tive assimilation pathway에서 주요 유전자로 알려진 glpK, glpD, glpABC 또한 J2B genome에서 확인된 유전자 배열이 GSC021에서도 동일한 것으로 확인되었다. glp 오페론들의 protein sequence alignment 역시 J2B와 GSC021이 99% 상동 성을 가지고 있는 것으로 분석되었다. J2B와 GSC021에서 1, 3-PDO 생산 경로에 속하는 유전자들은 다른 K. pneumoniae 와 마찬가지로 두 개의 오페론에 나눠져 존재하는 것으로 확 인되었다. 1,3-PDO 생산에서 첫 번째 단계를 촉매화하는 gly- cerol dehydratase (DhaB)는 dhaB1, dhaB2, dhaB3 유전자에 의 해 암호화되며, 이 유전자들은 glycerol dehydratase reactiva- tion factor의 subunit으로 알려진 gdrA와 함께 하나의 오페론
Fig. 1. Comparison of the sedimentation property of DSM, GSC021 and J2B strains. The cultures of three strains were examined without centrifugation (a), centrifuged at 5000 rpm for 2 min (b), centrifuged at 5000 rpm for 10 min (c) and inverted once after centrifuging at 5000 rpm for 10min (d).
에 배열되어있다. 반면 DhaT를 암호화하는 유전자인 dhaT는 dhaB와 반대편 오페론에서 전사되는 것으로 확인되었다. 또 한 glycerol dehydratase reactivation factor의 두 번째 subunit인 gdrB 는 dhaT 유전자와 같은 오페론에 있으며, dhaT 유전자 앞에 gdrB가 있는 것으로 확인되었다. J2B와 GSC021에서 1,3-PDO 생산관련된 유전자들의 배열뿐만 아니라 protein sequence alignment에서도 dhaB1, dhaB2, dhaB3, gdrA, gdrB, dhaT 유전자 모두 99% 이상의 상동성을 가지고 있는 것으로 분석되었다. 추가적으로 DhaB와 DhaT 사이에 존재하는 inter- genic region에 결합하는 다양한 전사제어인자 종류 및 자리 를 예측해보았다 (Fig. 2(c)). 그 결과 비록 prediction score는 낮지만, ArcA, CRP, ArgR, PurR 등과 같은 다양한 전사제어 인자들이 결합할 수 있는 것으로 나타났다.
DhaB의 조효소로 알려진 coenzyme B
12또한 3-HP와 1,3- PDO 생산성을 결정하는 중요한 요소이다. 따라서 J2B와 GSC 021에서 coenzyme B
12의 합성에 필요한 효소들을 암호화하 는 cob 오페론들에 대해서도 protein sequence alignment 분석 이 이루어졌다 (Fig. 2(b)). J2B와 GSC021에 존재하는 coen- zyme B
12생산 관련 유전자들은 산소 비의존성 coenzyme B
12합성 경로를 가지고 있으며, 이는 Pseudomonas denitrificans 에 존재하는 산소 의존성 경로와 확연히 차이가 있었다. co- enzyme B
12합성 관련된 20개의 유전자들이 하나의 오페론에 서 cluster 되어있으며, J2B와 GSC021 사이에 coenzyme B
12관련 유전자의 구성 및 배열은 모두 동일한 것으로 확인되었 다. coenzyme B
12합성에서 전사 또는 번역에 관여하는 것으 로 알려진 riboswitch도 J2B와 GSC021에서 99%의 상동성을 가지고 있는 것으로 분석되었다.
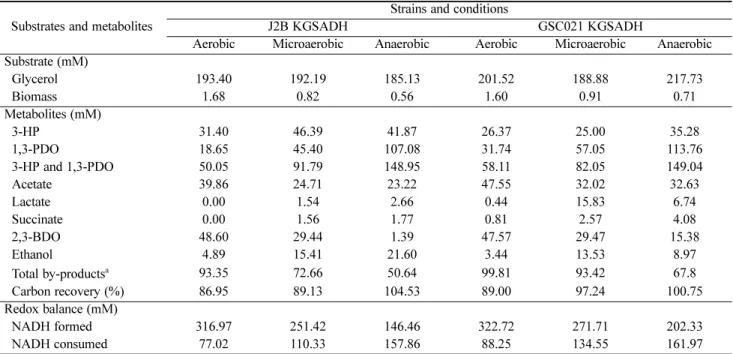
3.3. Aeration에 따른 세포 성장 및 동시생산 성능 조사 본 연구에서는 aeration 조건을 달리하였을 때 J2B와 GSC021 의 세포성장 및 동시생산 효율을 확인하고자 하였다. 세포는 aerobic, microaerobic, anaerobic 조건에서 배양되었으며, 여 러가지 aeration 조건에서 배양된 두 균주의 세포 성장과 3-
HP 및 1,3-PDO 생산에 대한 비교분석이 이루어졌다. 유전자 재조합 균주인 J2B KGSADH의 specific growth rate는 anaero- bic, microaerobic, aerobic에서 각각 0.40, 0.53, 0.60 h
-1로 aera- tion 이 증가함에 따라 specific growth rate도 동일하게 증가하 였다. Fig. 3(a)에서 보는 바와 같이, final cell density 역시 aerobic 조건에서 OD
600가 5.12로 가장 높았으며, 다음으로 높은 조건은 microaerobic로 OD
600가 2.48이었다. GSC021 KGSADH 또한 anaerobic, microaerobic, aerobic에서 0.62, 0.67, 0.72 h
-1순으로 specific growth rate가 계산되었다. final cell density도 aeration이 증가할수록 (2.15, 2.75, 4.84) 증가하는 경향을 보였다 (Fig. 3(b)). J2B와 GSC021을 비교하였을 때, 모든 aeration 조건에서 GSC021의 specific growth rate가 높았 으며, final cell density은 aerobic 조건에서는 J2B가 GSC021 보다 약간 높았으나, microaerobic 및 anaerobic 조건에서 GSC 021이 J2B보다 높은 것으로 확인되었다. Fig. 3(c)와 3(d)에서 는 세 가지 다른 aeration 조건에서 J2B와 GSC021의 3-HP 및 1,3-PDO 동시생산 결과를 보여주고 있다. J2B KGSADH의 경우, microaerobic과 anaerobic 조건에서 3-HP 생산 수율이 모두 ~0.25 mol/mol이었다. 반면, aerobic 조건에서는 3-HP 수 율이 0.18 mol/mol로 감소하였다. 그러나 1,3-PDO 생산 수율 은 aerobic, microaerobic, anaerobic에서 각각 0.10, 0.22, 0.60 mol/mol 로 aeration이 감소함에 따라 큰 폭으로 증가하였다.
따라서 전체 동시생산 수율은 aeration이 줄어듦에 따라서 점 점 증가하는 경향을 보였다. GSC021 KGSADH 균주의 경우 J2B KGSADH보다 모든 조건에서 3-HP 생산 수율이 비슷하 거나 낮았으며, 그 값은 대략 0.20 mol/mol로 나타났다. 반면 1,3-PDO 생산 수율은 J2B 균주와 동일하게 aeration이 감소함 에 따라 점차적으로 증가하는 경향을 보여주었다. GSC021 KGSADH에서 가장 높은 1,3-PDO 생산 수율은 0.52 mol/mol 로 anaerobic에서 관찰되었으며, microaerobic에서는 0.28 mol/
mol, aerobic에서는 0.16 mol/mol이었다. 1,3-PDO 수율 변화 와 마찬가지로 동시생산 수율은 aeration이 낮을수록 높았다.
이와 같이 두 균주 모두 aeration 조건에 따라서 세포 성장 및
Fig. 2. Genes of K. pneumoniae involved in assimilation of glycerol (through oxidative and reductive pathways) and biosynthesis of coen- zyme B12. dha/glp operons (a) pdu/cob operons (b), predicted transcription factors and promoters of dhaB and dhaT operons (c) are presen- ted. The genes coding for proteins involved in the reductive pathway of glycerol are shown in white arrows.동시생산 수율이 서로 연관되어 변화하는 것을 알 수 있었다.
글리세롤이 세포 성장 쪽으로 많이 사용되면 동시생산 수율 이 낮아지고, 글리세롤이 세포 성장 쪽으로 적게 사용되면 동 시생산 수율이 높아지는 경향을 보였다. 따라서 두 균주 모두 anaerobic 조건에서 3-HP 및 1,3-PDO 동시생산 수율이 높은 것으로 확인되었다. J2B KGSADH의 경우 동시생산 수율이 최대 0.80 mol/mol이었으며, GSC021의 경우 동시생산 수율 이 최대 0.72 mol/mol이었다. J2B KGSADH의 동시생산 수율 이 GSC021보다 약간 높은 이유는 J2B KGSADH의 세포 성 장이 GSC021 KGSADH보다 상대적으로 낮은 것과 관련이 있다. 또한 동시생산비 (3-HP/1,3-PDO)를 aerobic, microaero- bic, anaerobic 순으로 비교해 본 결과 J2B KGSADH의 경우 1.68, 1.02, 0.39였으며, GSC021의 경우 0.83, 0.44, 0.31로 나 왔다. aeration이 증가함에 따라 3-HP 생산 비율이 점차적으 로 증가되었다. 이는 Table 2의 redox balance 결과에서 볼 수 있듯이, aeration 조건에서 NADH에서 NAD
+로의 전환이 elec- tron transport chain (ETC) 에 의해 효과적으로 일어남으로써 NAD
+/NADH 비율이 향상되고 결국 3-HP 생산에 사용될 수 있는 NAD
+가 증가했기 때문으로 추정된다.
Aeration 조건에 따른 대사산물 분석에서 또한 동시생산에 대한 aeration 효과를 확인할 수 있다. Table 2에서 보는 바와 같이 glycolysis를 통해 소비된 글리세롤이 pyruvate나 phos- phoenolpyruvic acid (PEP)로부터 생성되는 부산물의 생성에
사용된 것을 알 수 있다. 두 균주 모두 높은 aeration 조건에서 는 최대 50% 정도의 글리세롤을 acetate, 2,3-butanediol (2,3- BDO) 등의 생산에 소비하였으며, anaerobic에서는 약 30% 정 도의 글리세롤을 acetate, ethanol 생산에 소비하였다. 다른 aeration 조건과는 달리 microaerobic에서 두 균주가 다른 경 향을 보였다. J2B KGSADH의 경우 약 40%의 글리세롤을 acetate, 2,3-BDO, Ethanol 생산에 소비한 반면, GSC021의 경 우 약 50%의 글리세롤을 acetate, lactate, 2,3-BDO, ethanol 등 에 사용하였다. 이 또한 동시생산 수율이 aeration의 증가에 따라 감소하는 원인이다. aeration 조건에 따라 생산되는 부산 물에 차이가 나는 이유는 aeration에 따라 활발하게 활동하는 효소의 종류가 다르기 때문이다. Aeration에 따른 두 균주의 세포 성장 및 동시생산 결과로부터 3-HP 및 1,3-PDO 동시 생 산 수율이 glycolysis로 사용되는 글리세롤의 양에 의해 결정 되는 것을 확인하였다. 또한 동시생산 수율이 3-HP에 의해 결정됨은 glycolysis pathway에서 필요한 조효소 NAD
+가 3- HP 생산에서 필요한 AldH의 조효소와 동일하여 조효소 경쟁 이 일어남을 보여주는 결과이다.
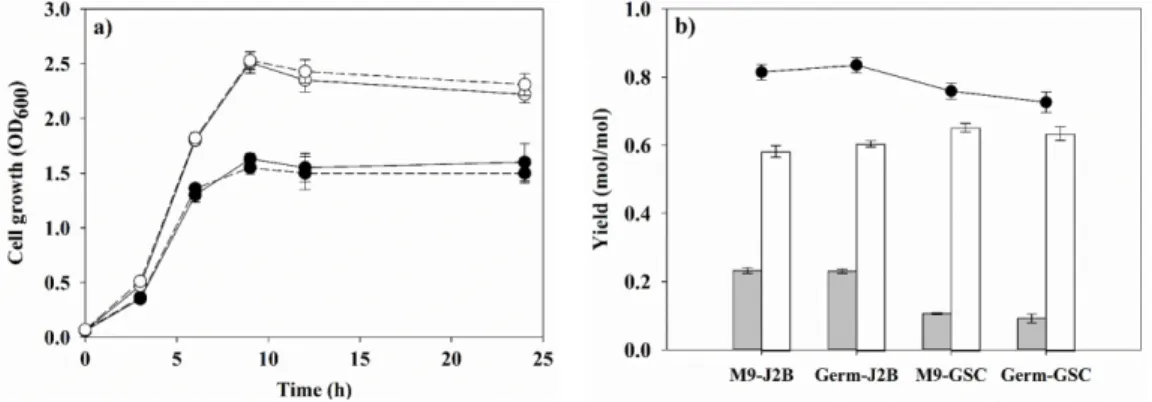
3.4. 온도 변화에 따른 세포 성장 및 동시생산 성능 조사 본 연구에서는 배양온도에 따른 두 K. pneumoniae의 세포 성 장 및 동시생산 성능을 비교하였다. 세포는 동시생산 수율이 가장 우수한 조건인 anaerobic에서 온도를 37도, 30도로 달리
Fig. 3. Effect of aeration on cell growth (a, b) and co-production (c, d) of 3-HP and 1,3-PDO by J2B KGSADH (a, c) and GSC021 KGSADH (b, d). Symbols: (a, b) closed circle: aerobic, semi-closed circle: microaerobic, open circle: anaerobic; (c, d) grey bar: 3-HP yield, white bar:1,3-PDO yield, closed circle: total co-production yield of 3-HP and 1,3-PDO.
하여 배양되었다. Fig. 4(a)에서 보는 바와 같이 J2B KGSADH 는 30도에서 final cell density가 2.0으로 37도에서의 final cell density보다 0.5 정도 높은 것으로 나타났다. 반면 GSC021 KGSADH 의 경우 두 온도에서 final cell density는 비슷하였으 나, 30도 (0.52 h
-1)보다 37도 (0.62 h
-1)에서 specific growth rate 가 약간 빠른 것을 알 수 있었다 (Fig. 4(b)). 온도에 따른 세포 성장결과에서 예상할 수 있듯이, J2B KGSADH는 37도에서 배양하였을 때 동시생산 수율이 0.80 mol/mol로 30도에서 배 양하였을 때의 동시생산 수율보다 0.05 정도 높은 결과를 보 였다 (Fig. 4(c)). 37도에서 활발한 세포 성장을 보였던 GSC 021 KGSADH는 30도에서 배양하였을 때 동시생산 수율이 0.75 mol/mol 로 37도에서 배양하였을 때보다 수율이 대략 0.10 mol/mol만큼 높은 것으로 나타났다 (Fig. 4(c)). 흥미롭게
도 두 균주 모두 1,3-PDO 수율은 온도에 따라 큰 차이가 없었 으나, 3-HP 수율이 온도에 따라 변하면서 전체 동시생산 수 율을 결정짓는 것으로 확인되었다. 이와 같이 온도변화에 따 른 세포성장 조절을 통해 동시 생산 수율을 변화시킬 수 있음 은 세포 성장과 동시 생산에서 글리세롤 이용 및 조효소 이용 이 서로 경쟁관계에 있음을 다시 한번 의미하는 결과이다.
3.5. 배양 배지에 따른 J2B와 GSC021의 세포 성장 및 동시 생산 성능 조사
3-HP 및 1,3-PDO 생산에 관련된 효소들이 특정 금속이온의 첨가에 의해 효소 활성이 향상된다는 보고가 있다 [23]. 이에 미량 원소를 배지에 첨가하여 동시생산에 관련된 효소들의 활성을 최대화시켰을 때 J2B KGSADH와 GSC021 KGSADH Table 2. Metabolites profile of J2B KGSADH and GSC021 KGSADH grown under different aeration condition
Substrates and metabolites
Strains and conditions
J2B KGSADH GSC021 KGSADH
Aerobic Microaerobic Anaerobic Aerobic Microaerobic Anaerobic
Substrate (mM)
Glycerol 193.40 192.19 185.13 201.52 188.88 217.73
Biomass 1.68 0.82 0.56 1.60 0.91 0.71
Metabolites (mM)
3-HP 31.40 46.39 41.87 26.37 25.00 35.28
1,3-PDO 18.65 45.40 107.08 31.74 57.05 113.76
3-HP and 1,3-PDO 50.05 91.79 148.95 58.11 82.05 149.04
Acetate 39.86 24.71 23.22 47.55 32.02 32.63
Lactate 0.00 1.54 2.66 0.44 15.83 6.74
Succinate 0.00 1.56 1.77 0.81 2.57 4.08
2,3-BDO 48.60 29.44 1.39 47.57 29.47 15.38
Ethanol 4.89 15.41 21.60 3.44 13.53 8.97
Total by-productsa 93.35 72.66 50.64 99.81 93.42 67.8
Carbon recovery (%) 86.95 89.13 104.53 89.00 97.24 100.75
Redox balance (mM)
NADH formed 316.97 251.42 146.46 322.72 271.71 202.33
NADH consumed 77.02 110.33 157.86 88.25 134.55 161.97
a
Acetate, Lactate, Succinate, 2,3-BDO and Ethanol.
Fig. 4. Effect of culture temperature on cell growth and co-production of 3-HP and 1,3-PDO by J2B KGSADH and GSC021 KGSADH.
Cell growth of J2B KGSADH (a) and GSC021 KGSADH (b) and co-production yield of 3-HP and 1,3-PDO of J2B KGSADH and GSC021 KGSADH (c) are shown. Symbols: (a, b) solid line: 30°C, dotted line: 37°C; (c) grey bar: 3-HP yield, white bar: 1,3-PDO yield and closed circle, total co-production yield of 3-HP and 1,3-PDO.
의 세포 성장 및 동시생산 변화를 조사하였다. 세포는 M9 배 지 또는 M9 배지에 미량원소를 추가적으로 넣은 Germ 배지 에서 배양되었다. 또한 M9 배지를 사용하였을 때 동시생산 수율이 최대로 나왔던 조건에서 실험이 진행되었다. J2B KGSADH 의 경우 anaerobic, 37도에서 GSC021 KGSADH의 경우 anaerobic, 30도에서 배양되었다. Fig. 5(a)에서 보는 바와 같이 J2B KGSADH와 GSC021 KGSADH의 세포 성장이 M9 배지와 Germ 배지 사이에 큰 차이가 없는 것을 알 수 있다. 배 지 종류에 상관없이 GSC021 KGSADH의 specific growth rate 가 0.52 h
-1로 J2B KGSADH보다 빨랐고, final cell density도 GSC021 KGSADH가 2.5 OD
600으로 J2B KGSADH보다 0.5 OD
600정도 높은 것을 알 수 있었다. 동시생산 수율에서 또한 Germ 배지에서 J2B KGSADH는 0.80 mol/mol, GSC021은 0.75 mol/mol로 M9 배지에서의 결과와 비교하였을 때 차이 가 없는 것으로 확인되었다 (Fig. 5(b)). 뿐만 아니라 두 배지 사이에서 3-HP 및 1,3-PDO 생산비에도 변화가 없었다. 부산 물 또한 M9 배지에서 배양되었을 때와 마찬가지로 두 균주 모두 acetate와 ethanol이 주요 부산물로 생산되었으며, 그 양 또한 차이가 없었다. 따라서 플라스크 배양에서는 M9 배지 에 사용되는 배지 조성만으로도 미량원소가 충분히 공급될 수 있음을 알 수 있었다.
3.6. 3-HP와 1,3-PDO 동시생산에 관련된 주요 효소활성 평가
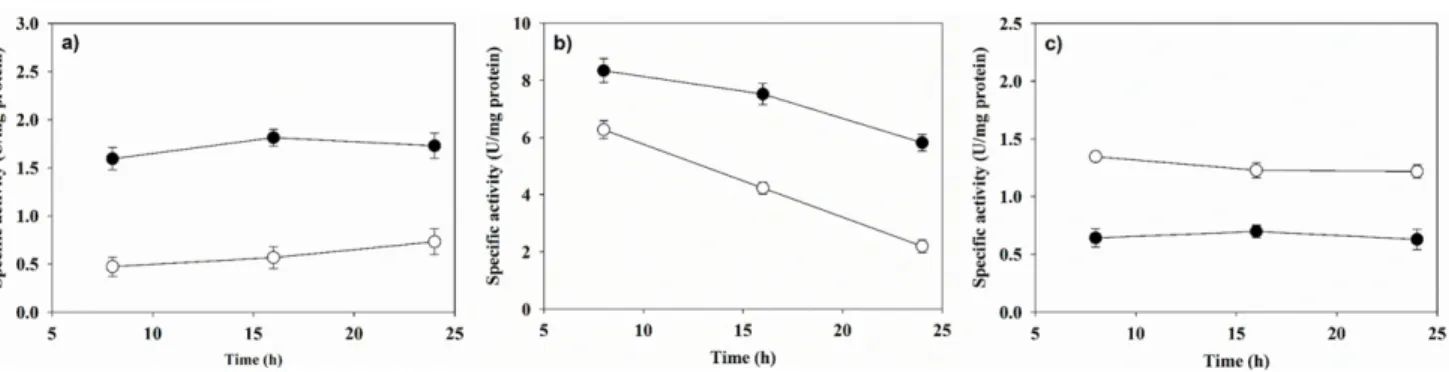
J2B와 GSC021이 비슷한 genome sequence를 가졌음에도 불 구하고 서로 다른 동시생산 수율 및 동시생산비를 보인 이유 를 알아보기 위해, 동시생산에 관련된 세 가지 주요 효소들에 대한 효소 활성을 조사하였다. 효소활성 측정을 위해 J2B와 GSC021은 각각 가장 높은 동시생산 수율을 보인 조건에서 배양되었다. J2B의 경우 37도 200 rpm anaerobic 조건에서 배 양되었으며, GSC021의 경우 30도 200 rpm anaerobic 조건에 서 배양되었다. 8 h, 16 h, 24 h에서 DhaB, KGSADH, DhaT에 대한 효소 활성을 측정하였다. DhaB 효소 활성은 J2B의 경우 모든 시간에서 ~1.7±0.1 U/mg로 비슷하였으며, GSC021의 경
우 모든 시간에서 ~0.6±0.1 U/mg로 비슷한 값을 가졌다 (Fig.
6(a)). J2B 균주의 DhaB 활성이 GSC021의 DhaB 활성보다 3 배 정도 높은 것으로 나타났다. 이러한 DhaB의 활성 차이가 같은 조건에서 J2B가 GSC021에 비해 좀 더 높은 수율을 보 여주는데 도움을 준 것으로 판단되었다. 흥미롭게도 KGSADH 효소 활성 측정 결과에서는 J2B 균주가 GSC021 균주에 비하 여 모든 시간에서 약간 높은 활성을 보였다 (Fig. 6(b)). 또한 DhaT 활성 측정 결과에서는 GSC021 균주가 J2B 균주보다 모든 시간에서 2배 가량 높은 효소 활성 (~1.3±0.05 U/mg)을 보였다 (Fig. 6(c)). KGSADH 효소 활성을 통해 J2B 균주가 모든 조건에서 GSC021에 비해 높은 3-HP 생산 비율을 보인 이유를 알 수 있으며, 반대로 DhaT 활성을 통해 GSC021이 J2B 에 비해 높은 1,3-PDO 생산 비율을 보인 이유를 설명할 수 있다. 이와 같이 두 균주가 DhaB 및 1,3-PDOR 활성에 차 이를 보이는 것은 다양한 전사조절인자로 인해 단백질 발현 수준이 다를 수 있기 때문이다. 또한 KGSADH의 경우 3-HP 및 1,3-PDO의 농도가 증가함에 따라 효소 활성이 크게 저해 되는 것으로 알려져 있다 [15]. 따라서 두 균주의 KGSADH 효소 활성이 시간에 따라 큰 폭으로 감소되는 원인으로 간주 된다.
4. CONCLUSION
본 연구에서는 LPS 생산이 적은 두 K. pneumoniae 균주들을 이용하여 3-HP 및 1,3-PDO의 동시 생산 및 산업 균주로써의 개발 가능성을 조사하였다. 균주들의 동시생산 성능 평가를 위해 침강 양상, genome sequence, 동시생산 생산성 및 효소 활성 등이 조사되었다. 두 균주 모두 DSM 균주보다 월등히 높은 침강 양상을 보였다. 또한 두 균주가 genome level에서 도 큰 차이를 보이지 않았으며, 배양조건에 따른 동시생산성 에도 괄목할 만한 차이가 없는 것으로 확인되었다. 다시 말해 두 균주 모두 최소배지에서 높은 수율로 3-HP 및 1,3-PDO의 동시 생산이 가능하며, 산업적으로 유용한 균주가 될 수 있음
Fig. 5. Effect of culture media (M9 minimal medium, M9 or germ medium, Germ) on cell growth (a) and co-production of 3-HP and 1,3- PDO (b). Symbols: (a) closed circle: J2B KGSADH, opened circle: GSC021 KGSADH, solid line: M9, dotted line: Germ; (b) grey bar: 3- HP, white bar: 1,3-PDO, closed circle: total co-production yield of 3-HP and 1,3-PDO.
을 의미한다. 그러나 동시 생산 수율 및 효소 활성 측면에서 는 비록 그 차이가 크지는 않지만 J2B가 조금 더 우수한 것으 로 확인되었다. 이러한 차이는 균주 성장과 목적 대사산물 생 산에 분배되는 탄소원의 비율, 대사산물 생성과 균주 성장에 이용되는 효소 활성 등의 차이로 설명이 가능하였다. 본 연구 는 새롭게 분리되는 균주에 대해 가능성과 우수성을 어떻게 조사하는지 보여주는 예로써 다른 연구에도 도움이 될 것으 로 기대된다. 향후 J2B 균주를 대상으로 세포 성장으로의 글 리세롤 흐름 조절 및 불필요한 대사 경로의 제거와 같은 metabolic engineering을 통해 동시 생산 수율을 향상 시킬 수 있을 것으로 기대된다.
Acknowledgements
본 연구는 부산대학교 기본연구지원사업 (2년)과 부산대학 교 BK 21 플러스 사업단 (동남권 화학신기술 창의인재양성 사업단)의 지원으로 이루어졌으며, 이에 감사드립니다.
REFERENCES
1. Future chemical industry, Cover story (Catalyst). http://www.cis- chem.com/chemical_report/chem_re_content.asp?data_part1=chem _rep&docnum=cr_99/cr99cover.asp (2016).
2. Bozell, J. J. and G. R. Petersen (2010) Technology development for the production of biobased products from biorefinery carbohy- drates - the US Department of Energy’s “top 10” revisited. Green Chem. 12: 539-554.
3. Kumar, V., S. Ashok, and S. Park (2013) Recent advances in biolo- gical production of 3-hydroxypropionic acid. Biotechnol. Adv. 31:
945-961.
4. Raj, S. M., C. Rathnasingh, J. E. Jo, and S. Park (2008) Produc- tion of 3-hydroxypropionic acid from glycerol by a novel recombi- nant Escherichia coli BL21 strain. Process Biochem. 43: 1440- 1446.
5. Rathnasingh, C., S. M. Raj, J. E. Jo, and S. Park (2009) Develop- ment and evaluation of efficient recombinant Escherichia coli strains for the production of 3-hydroxypropionic acid from glyc- erol. Biotechnol. Bioeng. 104: 729-739.
6. Raj, S. M., C. Rathnasingh, W. C. Jung, and S. Park (2009) Effect of process parameters on 3-hydroxypropionic acid production from glycerol using a recombinant Escherichia coli. Appl. Microbiol.
Biotechnol. 84: 649-657.
7. Ko, Y., S. Ashok, S. Zhou, V. Kumar, and S. Park (2012) Alde- hyde dehydrogenase activity is important to the production of 3- hydroxypropionic acid from glycerol by recombinant Klebsiella pneumoniae. Process Biochem. 47: 1135-1143.
8. Ashok, S., S.M. Raj, Y. Ko, M. Sankaranarayanan, S. Zhou, V. Ku- mar, and S. Park (2013) Effect of puuC overexpression and nitrate addition on glycerol metabolism and anaerobic 3-hydroxypropi- onic acid production in recombinant Klebsiella pneumoniae Δglp- KΔdhaT. Metab. Eng. 15: 10-24.
9. Ashok, S., M. Sankaranarayanan, Y. Ko, K. E. Jae, S. K. Ainala, V.
Kumar, and S. Park (2013) Production of 3-hydroxypropionic acid from glycerol by recombinant Klebsiella pneumoniae ΔdhaTΔy- qhD which can produce vitamin B12 naturally. Biotechnol. Bio- eng. 110: 511-524.
10. Zhou, S., C. Catherine, C. Rathnasingh, A. Somasundar, and S. Park (2013) Production of 3-hydroxypropionic acid from glycerol by recombinant Pseudomonas denitrificans. Biotechnol. Bioeng. 110:
3177-3187.
11. Maervoet, V. E., M. De Mey, J. Beauprez, S. De Maeseneire, and W. K. Soetaert (2010) Enhancing the microbial conversion of gly- cerol to 1,3-propanediol using metabolic engineering. Org. Process Res. Dev. 15: 189-202.
12. Kumar, V., M. Durgapal, M. Sankaranarayanan, A. Somasundar, C.
Rathnasingh, H. Song, D. Seung, and S. Park (2016) Effects of mu- tation of 2, 3-butanediol formation pathway on glycerol metabolism and 1, 3-propanediol production by Klebsiella pneumoniae J2B.
Bioresour. Technol. 214: 432-440.
13. Durgapal, M., V. Kumar, T. H. Yang, H. J. Lee, D. Seung, and S.
Park. (2014) Production of 1, 3-propanediol from glycerol using the newly isolated Klebsiella pneumoniae J2B. Bioresour. Technol. 159:
223-231.
Fig. 6. Enzyme activities of DhaB (a), KGSADH (b) and DhaT (c) in the crude cell extracts of J2B KGSADH and GSC021 KGSADH.
Symbols: closed circle - J2B KGSADH, opened circle - GSC021 KGSADH.
14. Ashok, S., S. M. Raj, C. Rathnasingh, and S. Park (2011) Develop- ment of recombinant Klebsiella pneumoniae ∆dhaT strain for the co-production of 3-hydroxypropionic acid and 1,3-propanediol from glycerol. Appl. Microbiol. Biotechnol. 90: 1253-1265.
15. Kumar, V., M. Sankaranarayanan, K. E. Jae, M. Durgapal, S. Ashok, Y. Ko, R. Sarkar, and S. Park (2012) Co-production of 3-hydroxy- propionic acid and 1, 3-propanediol from glycerol using resting cells of recombinant Klebsiella pneumoniae J2B strain overexpressing aldehyde dehydrogenase. Appl. Microbiol. Biotechnol. 96: 373-383.
16. Kumar, V., M. Sankaranarayanan, M. Durgapal, S. Zhou, Y. Ko, S.
Ashok, R. Sarkar and S. Park (2013) Simultaneous production of 3-hydroxypropionic acid and 1, 3-propanediol from glycerol using resting cells of the lactate dehydrogenase-deficient recombinant Klebsiella pneumoniae overexpressing an aldehyde dehydroge- nase. Bioresour. Technol. 135: 555-563.
17. Huang, Y., Z. Li, K. Shimizu, and Q. Ye (2012) Simultaneous pro- duction of 3-hydroxypropionic acid and 1,3-propanediol from gly- cerol by a recombinant strain of Klebsiella pneumoniae. Bioresour.
Technol. 103: 351-359.
18. Huang, Y., Z. Li, K. Shimizu, and Q. Ye (2013) Co-production of
3-hydroxypropionic acid and 1,3-propanediol by Klebseilla pneum- oniae expressing aldH under microaerobic conditions. Bioresour.
Technol. 128: 505-512.
19. Arasu, M. V., V. Kumar, S. Ashok, H. Song, C. Rathnasingh, H. J.
Lee, D. Seung, and S. Park (2011) Isolation and characterization of the new Klebsiella pneumoniae J2B strain showing improved growth characteristics with reduced lipopolysaccharide formation.
Biotechnol. Bioprocess Eng. 16: 1134-1143.
20. Lama, S., S. M. Ro, E. Seol, B. S. Sekar, S. K. Ainala, J. Thangap- pan, H. Song, and S. Park (2015) Characterization of 1,3-propane- diol oxidoreductase (DhaT) from Klebsiella pneumoniae J2B. Bio- technol. Bioprocess Eng. 20: 971-979.
21. Bradford, M. M. (1976) A rapid and sensitive method for the quan- titation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72: 248-254.
22. Chmielowski, R. A., H. S. Wu, and S. S. Wang (2007) Scale-up of upstream and downstream operations for the production of glucos- amine using microbial fermentation. Biotechnol. J. 2: 996-1006.
23. Jiang, W., S. Wang, Y. Wang, and B. Fang (2016) Key enzymes catalyzing glycerol to 1, 3-propanediol. Biotechnol. Biofuels. 9: 1.