혈액학검사 신빙도조사 결과보고(2006)
권계철(집필대표)․김선희․김용구․박연보․박종우․박찬정․박효순․서장수․양동욱 이웅수․임춘화․임환섭․조한익․조현찬
대한임상검사정도관리협회 진단혈액분과 위원회
Annual Report on External Quality Assessment in Hematology in Korea (2006)
Gye Cheol Kwon, Sun Hee Kim, Yong Goo Kim, Youn Bo Park, Jong Woo Park, Chan Jeoung Park, Hyo Soon Park, Jang Soo Suh, Dong Wook Ryang, Woong Soo Lee, Chun Hwa Ihm, Hwan Sub Lim, Han Ik Cho, and Hyoun Chan Cho
Diagnostic Hematology Subcommittee,
The Korean Association of Quality Assurance for Clinical Laboratory, Seoul, Korea
Four trials of external quality assessment in diagnostic hematology were performed in 2006 with average 623 participating laboratories in Korea. We performed quality assessment for white blood cell count, hemoglobin, hematocrit, red blood cell count, platelet count, blood cell morphology, prothrombin time and activated partial thromboplastin time. The response rate was more than 94.6%. The coefficients of variation in hemoglobin, hematocrit and RBC count was stable but variable in platelet count and WBC count according to measuring cell counters. Test results of blood cell morphology showed variation among cell morphologies.
Key Words:External quality assessment, Hematology
교신저자:권계철
우) 301-040 대전광역시 중구 대사동 640 충남대학교병원 진단검사의학과
전화:042)220-7799, FAX:042)257-5365 E-mail:kckwon@cnu.ac.kr
서 론
2006년도 진단혈액 분과위원회의 외부정도관리 사업은 평균 623기관을 대상으로 백혈구수, 혈색소치, 적혈구용적 백분율, 적혈구수, 혈소판수, 세포형태판독 등 6종목에 대 하여 4회 실시하였으며, 프로트롬빈시간, 활성화부분트롬보 플라스틴시간은 1회 실시하였다.
워크샵은 ‘말초혈액 혈구세포 감별법’, ‘참가자 질문 및 토의’, ‘말초혈액 혈구세포 감별 실습’, ‘진단혈액 정도관리 운영’에 대하여 충남대학교병원에서 1회 시행하였다.
재료 및 방법
일반혈액검사 정도관리 사업은 백혈구수, 혈색소치, 적혈
구용적백분율, 적혈구수, 혈소판수를 대상으로 5월, 6월, 9 월, 11월에 4회 실시하였으며, 정도관리 물질은 1차, 3차, 4차에는 동일 혈액형을 가지고 있는 정상인으로부터 채혈한 혈액을 영국의 Reardon DM[1]이 개발한 방법을 이용하 여 제조하였고, 2차에는 BIO-RAD사의 Lyphochek
TMHe- matology-16 Control H를 이용하였으며, 각 차수마다 vial 간의 균질성을 보기 위하여 20 vial마다 1 vial씩 총 25개 vial을 선택하여 표준편차와 변이계수를 구하였다.
혈액응고시간검사 정도관리 사업은 프로트롬빈시간, 활 성화부분트롬보플라스틴시간 검사를 대상으로 11월에 1회 실시하였으며, 정도관리 물질은 BIO-RAD사의 Lyphochek
ⓇCoagulation control Levels 2를 이용하였고, vial간의 균질 성을 보기 위하여 20 vial마다 1 vial씩 총 15개 vial을 선택 하여 표준편차와 변이계수를 구하였다.
세포형태 판독을 위한 정도관리 사업은 매회 10개씩 총 40개의 이미지를 홈페이지에 게시하고 참가기관에서 조회하 여 판독할 수 있게 하였다.
정도관리검체의 정확하고 신속한 운송을 위하여 계약택
배를 이용하였으며, 2차 일반혈액 정도관리 물질은 1차 때
함께 발송하여 1개월간 보관하였다가 검사하게 하였다.
정도관리검사 결과의 입력은 참여기관에서 대한임상검 사정도관리협회 홈페이지 결과입력화면을 조회하여 입력하 게 하였으며, 위원회에서 결과를 다운받아 결과를 분석하였 다.
결과 분석은 대한임상검사정도관리협회 홈페이지를 통한 결과 입력 및 조회 실시 계획에 맞추어 2006년에 구현한
‘진단혈액외부신빙도조사 통계분석 및 출력 프로그램(윤종 현, 박연보, 권계철, 김진규; 2006년; Visual FoxPro 5;
Microsoft, USA)’ 을 이용하였다.
백혈구수, 혈색소치, 적혈구용적백분율, 적혈구수, 혈소 판수 검사 결과의 분석은 왜곡 결과를 제외하기 위하여
±3SD 이내 기관들로 측정기기그룹별과 측정방법그룹별로 평균, 표준편차, 변이계수를 구하였으며, 결과그룹별로 도 수분포를 구하여 보고하였다.
프로트롬빈시간, 활성화부분트롬보플라스틴시간 검사 결 과의 분석은 왜곡 결과를 제외하기 위하여 ±3SD 이내 기 관들로 측정기기그룹별과 측정시약그룹별, 측정방법그룹별 로 평균, 표준편차, 변이계수를 구하였으며, 결과그룹별로 도수분포를 구하여 보고하였다. 결과 분석시 프로트롬빈시 간은 INR 값을 적용하였고, 활성화부분트롬보플라스틴시간 은 각 기관의 측정결과를 각 기관의 참고치 중간 값으로 나 누어 산출된 값을 적용하였다.
세포형태 판독에 대한 분석은 각 세포별로 결과 도수별 기관수와 백분율을 보고하였다.
분석한 결과는 검체 발송 약 1 개월 정도에 각 참여기관 으로 발송하였다.
결 과
1. 신빙도조사 참여기관
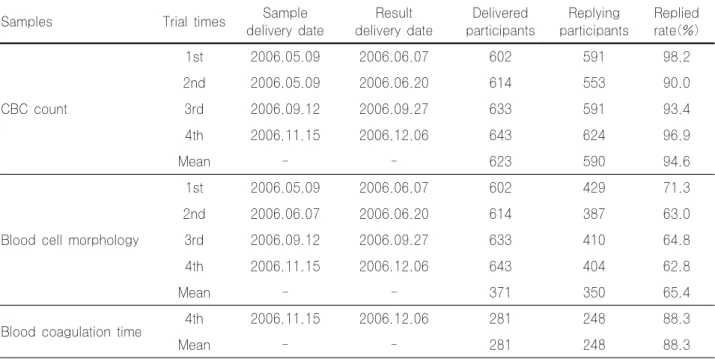
일반혈액검사 신빙도조사 참여기관수는 1~4차까지 각각 602기관, 614기관, 633기관, 643기관에 검체를 발송하여 591 기관(98.2%), 553기관(90.0%), 591기관(93.4%), 624기관 (96.9%)의 회신율을 보여 평균 623기관에 검체를 발송하여 590기관(94.6%)의 회신율을 보였으며, 세포형태 신빙도조사 참여기관수는 1~4차까지 각각 10개씩의 혈액세포형태 이미 지를 홈페이지에 게시하여 일반혈액검사 발송기관 기준으로 429기관(71.3%), 387기관(63.0%), 410기관(64.8%), 404기관 (62.8%)의 회신율을 보여 평균 350기관(65.4%)의 회신율을 보였으며, 혈액응고시간검사 신빙도조사 참여기관수는 4차 에 281기관에 검체를 발송하여 248기관(88.3%)의 회신율을 보였다(Table 1).
2. 정도관리 물질의 균질성
일반혈액검사 정도관리물질의 변이계수는 1차~4차까지 각각 백혈구수 3.24%, 2.53%, 2.00%, 1.52% 혈색소치 0.80%,
0.75%, 0.74%, 0.71% 적혈구용적백분율 0.56%, 0.85%, 0.53%, 0.84% 적혈구수 0.74%, 0.94%, 0.55%, 0.78% 혈소판수 2.33%, 1.43%, 2.05%, 1.86%을 보였으며, 4차에 실시한 혈액응고검사 정도관리물질의 변이계수는 프로트롬빈시간 0.70%, 활성화 부분트롬보플라스틴시간 1.53%를 보였다(Table 2).
3. 기기 및 시약 이용 현황
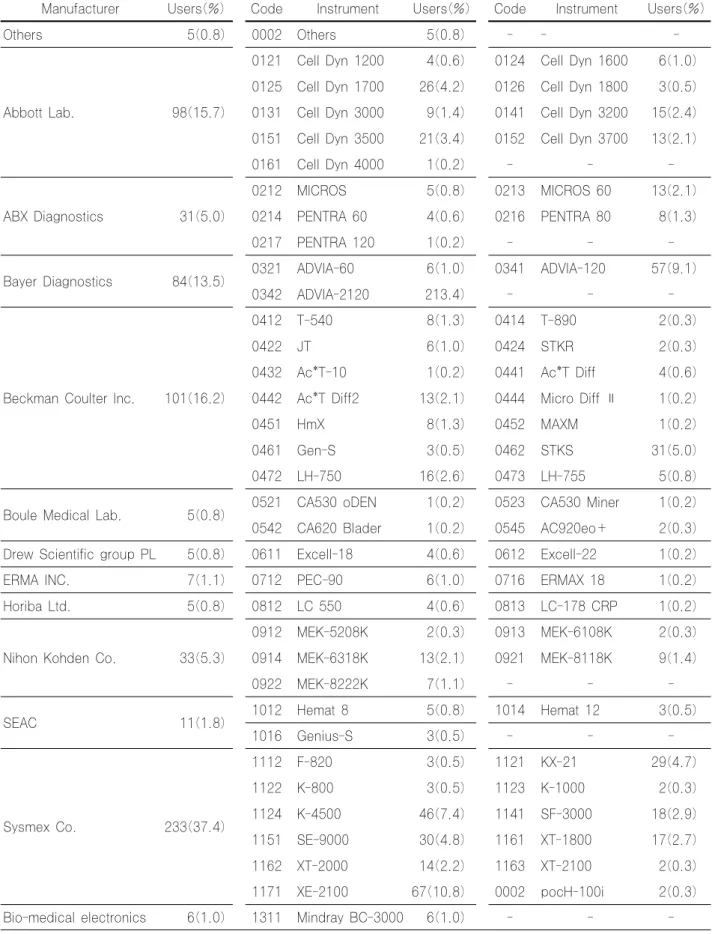
일반혈액검사 자동분석기기는 제조회사별로 Sysmex Co. 233기관(37.4%), Beckman Coulter Inc. 101기관(16.2%), Abbott Lab. 98기관(15.7), Bayer diagnostics 84기관(13.5%), Nihon Kohden Co. 33기관(5.3%), ABX diagnostics 31기관 (5.0%) 등의 순으로 사용하고 있었고, 기종별로는 XE-2100 67기관(10.8%), ADVIA-120 57기관(9.1%), K-4500 46기관 (7.4%), STKS 31기관(5.0%), SE-9000 30기관(4.8%), KX-21 29기관(4.7%), Cell Dyn 1700 26기관(4.2%), Cell Dyn 3500 21기관(3.4%) 등의 순으로 사용하고 있었다 (Table 3).
혈액응고시간 자동분석기기는 제조사별로 Sysmex Co. 78기 관(31.6%), Instrumentation Lab. 62기관(25.1%), Diagnostica Stago 42기관(17.0%), Behnk Elektronik 22기관(8.9%), SEAC 11기관(4.5%) 등의 순으로 사용하고 있었고, 기종별로는 CA 1500 28기관(11.3%), CA 500 series 28기관(11.3%), ACL 9000 23기관(9.3%), STA Compact 22기관(8.9%), ACL 100 17기관(6.9%) 등의 순으로 사용하고 있었다(Table 4).
프로트롬빈시간 검사시약은 제조사별로 Dade Behring 99 기관(40.1%), Instrumentation Lab. 61기관(24.7%), Diagnostica Stago 43기관(17.4%), Pacific Homeostasis 38기관(15.4%) 등 의 순으로 사용하고 있었으며, 시약종별로는 Thromborel-S 75기관(30.4%), PT-fibrinogen HS 57기관(23.1%), STA Neoplastin-C Plus 43기관(17.4%), Thromboplastin-D 38기 관(15.4%), Thromboplastin-C Plus 24기관(9.7%) 등의 순으 로 사용하고 있었다(Table 5).
활성화부분트롬보플라스틴시간 검사시약은 제조사별로 Dade Behring 97기관(39.4%), Instrumentation Lab. 59기관 (24.0%), Diagnostica Stago 43기관(17.5%), Pacific Homeostasis 35기관(14.2%) 등의 순으로 사용하고 있었으며, 시약종별로는 Actin 74기관(30.1%), PTT A 5 43기관(17.5%), APTT lyophilized silica 36기관(14.6%), Kontact APTT reagent 35 기관(14.2%), Synthasil 23기관(9.3%) 등의 순으로 사용하고 있었다(Table 5).
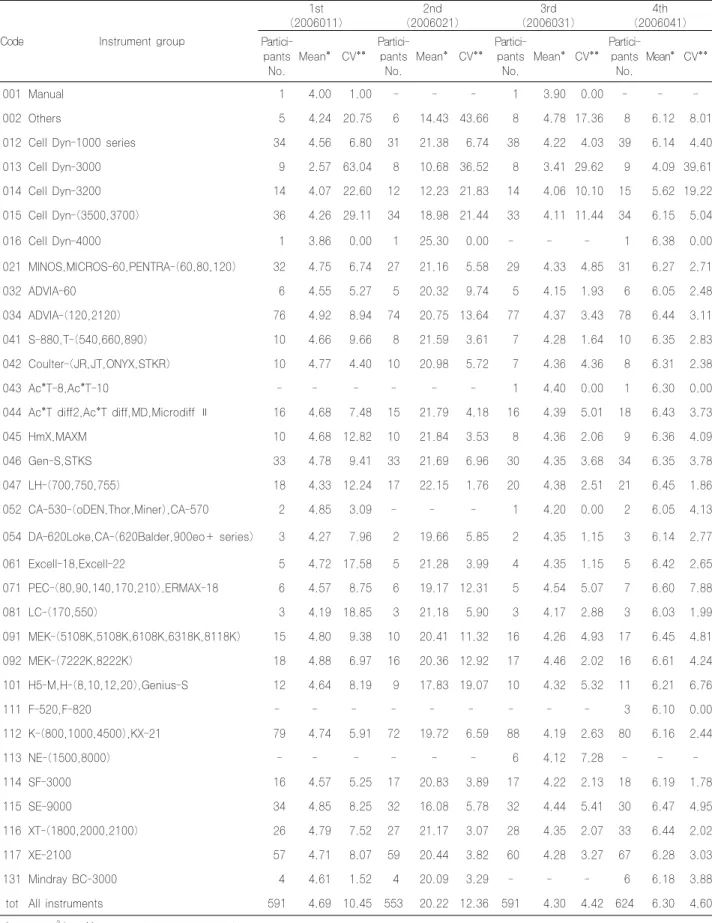
4. 백혈구수 검사 결과
백혈구수의 전체기관 변이계수는 1차 10.45% 2차 12.36%
3차 4.42% 4차 4.60%를 보였고, 기기그룹별 변이계수는 대
부분 비슷하였으나 몇 그룹에서 변이계수의 차이가 있었다
(Table 6).
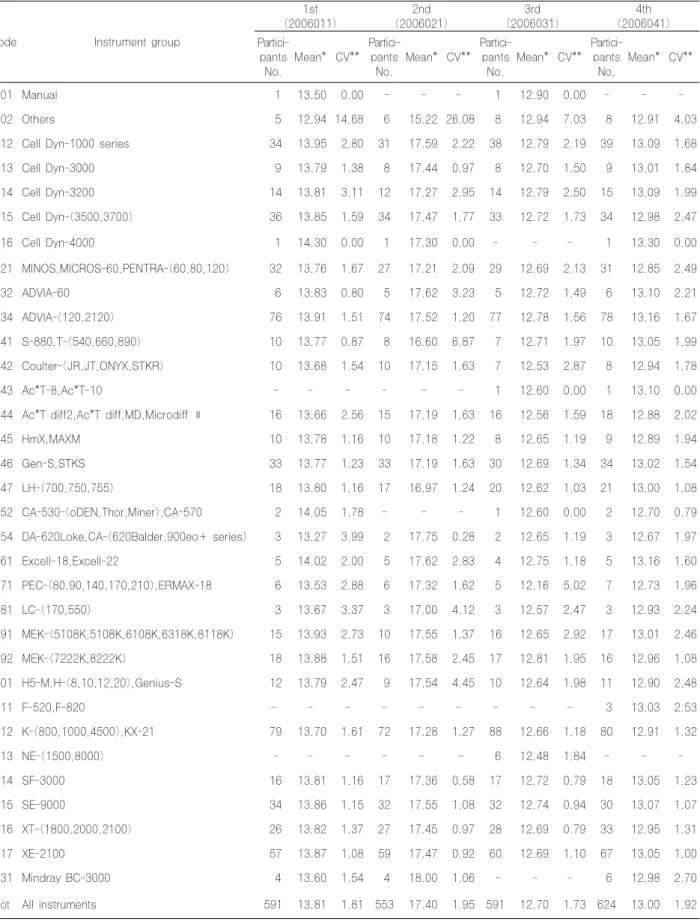
5. 혈색소치 검사 결과
혈색소치의 전체기관 변이계수는 1차 1.81% 2차 1.95% 3 차 1.73% 4차 1.92%를 보였고, 기기그룹별 변이계수는 모든 그룹에서 안정된 결과를 보였다(Table 7).
6. 적혈구용적백분율 검사 결과
적혈구용적백분율의 전체기관 변이계수는 1차 4.89% 2차 6.01% 3차 3.40% 4차 3.74%를 보였고, 기기그룹별 변이계 수는 모든 그룹에서 안정된 결과를 보였다(Table 8).
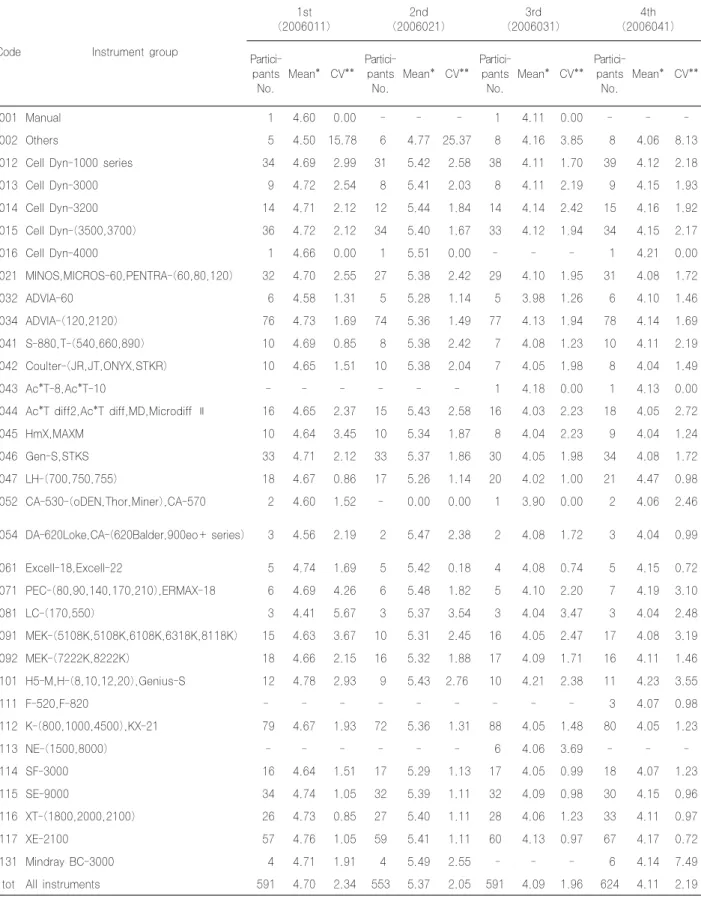
7. 적혈구수 검사 결과
적혈구수의 전체기관 변이계수는 1차 2.34% 2차 2.05% 3 차 1.96% 4차 2.19%를 보였고, 기기그룹별 변이계수는 모든 그룹에서 안정된 결과를 보였다(Table 9).
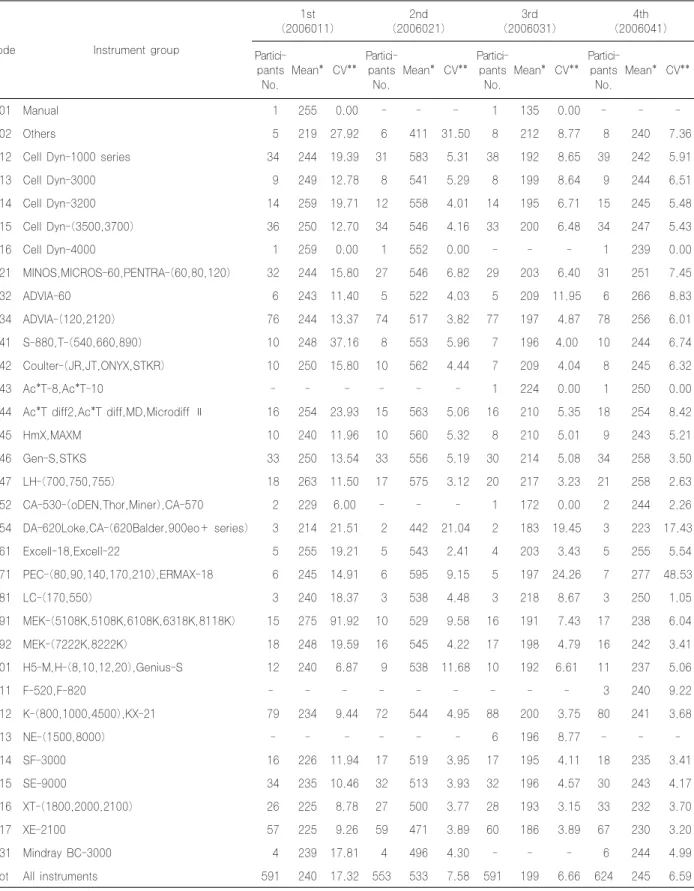
8. 혈소판수 검사 결과
혈소판수의 전체기관 변이계수는 1차 17.32% 2차 7.58%
3차 6.66% 4차 6.59%를 보였고, 기기그룹별 변이계수는 대 부분 비슷하였으나 몇 그룹에서 변이계수의 차이가 있었다 (Table 10).
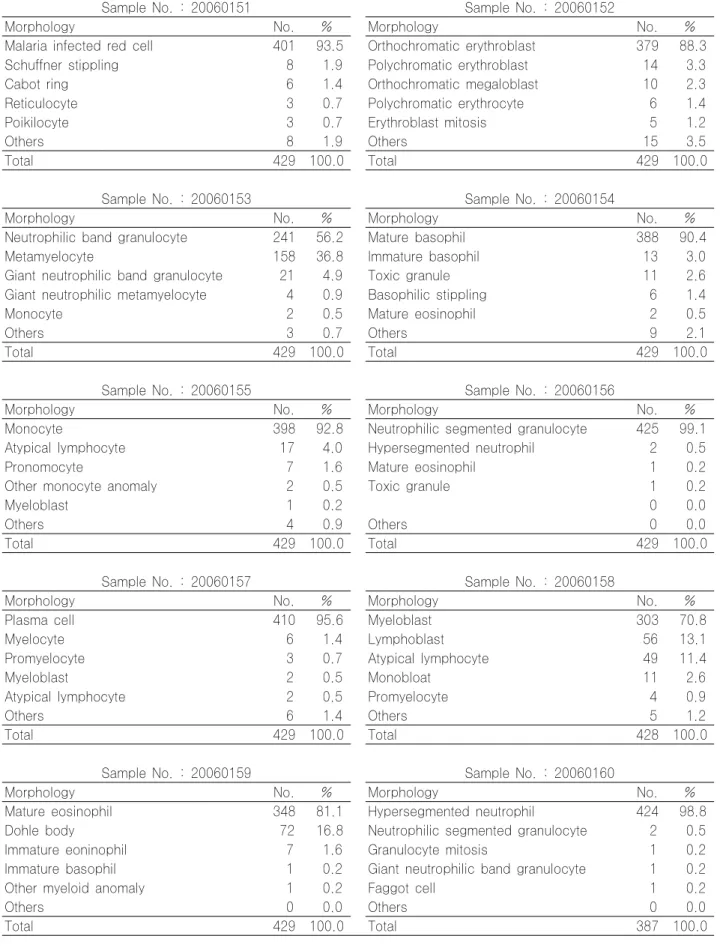
9. 혈액세포형태 판독 결과
혈액세포형태 판독 결과 중 가장 많은 비율과 의미가 있 는 세포별 분포비율은 1차 20060151 malaria infected red cell 93.5%, 20060152 orthochromatic erythro- blast 88.3%, 20060153 neutrophilic band granulo- cyte 56.2%, metamyelocyte 36.8%, 20060154 mature basophil 90.4%, 20060155 monocyte 92.
8%, 20060156 neutrophilic segmented granulocyte 99.1%, 20060157 plasma cell 95.6%, 20060158 myeloblast 70.8%, lymphoblast 13.1%, atypical lymphocyte 11.4%, 20060159 mature eosionphil 81.1%, Dőhle body 16.8%, 20060160 hyperseg- mented neutrophil 98.8%를 보였으며(Table 11), 2차 20060251 stomatocyte (mouth cell) 97.7%, 20060 252 Howell-Jolly body 98.4%, 20060253 basophilic stippling 87.1%, reticulocyte 9.8%, 20060254 neutrophilic segmented granulocyte 92.2%, 20060 255 toxic granule 83.5%, mature eosinophil 10.9%, 20060256 Dohle body 91.5%, 20060257 plasmacytoid lymphocyte 59.5%, atypical lympho- cyte 27.3%, 20060258 giant platelet 90.7%, 20060259 myelocyte 56.2%, promyelocyte 40.7%, 20060260 metamyelocyte 89.4%를 보였고(Table 12), 3차 20060351 neutrophilic band metamyelocyte 96.1%, 20060352 neutrophilic segmented granu- locyte 99.5%, 20060353 platelet 98.3%, 20060354
mature eosinophil 98.5%, 20060355 monocyte 85.8%, 20060356 metamyelocyte 95.6%, 20060357 mature basophil 87.1%, 20060358 rouleaux formation 98.8%, 20060359 Auer body 48.5%, faggot cell 41.9%, 20060360 malaria infected red cell 93.4%를 보였으며(Table 13), 20060451 burr cell 90.6%, 20060452 target cell 99.5%, 20060453 reticulocyte 95.8%, 20060454 spherocyte 95.0%, 20060455 Pelger-Huet anomaly 86.9%, neutro- philic segmented granulocyte 9.2%, 20060456 atypical lymphocyte 87.6%, 20060457 ovalocyte 99.0%, 20060458 plasma cell 76.7%, plasmacytoid lymphocyte 8.7%, 20060459 stomatocyte (mouth cell) 99.0%, 20060460 tear drop cell (dacrocyte) 98.8%를 보였다(Table 14).
10. 혈액응고시간 검사 결과
혈액응고시간 검사는 4차에 1회 실시하였으며, 전체기관 변이계수는 프로트롬빈 19.85%, 활성화부분트롬보플라스틴 15.09%를 보였고 기종별로 변이계수의 차이가 있었다(Table 15). 측정시약별 변이계수의 차이도 보였다(Table 16, Table 17).
고 찰
2006년도에 혈액학신빙도조사는 총 4회 실시하였으며 그 중 일반혈액검사와 혈액세포형태판독은 4회, 혈액응고시 간검사는 1회 실시하였다. 일반혈액검사는 백혈구수, 혈색 소치, 적혈구용적백분율, 적혈구수, 혈소판수를, 혈액응고시 간검사는 프로트롬빈시간, 활성화부분트롬보플라스틴시간을 각각 검사하였다.
혈액학신빙도조사 참여기관수는 년 평균 2005년 518기 관, 2006년 623기관을 보여 108기관이 증가하였다.
일반혈액검사는 평균 623기관에 검체를 발송하여 590기 관(94.6%)의 회신율을 보였으며, 혈액세포형태판독은 평 균 350기관에서 결과를 입력하여 65.4%의 회신율을 보였 고, 혈액응고시간 검사는 281기관에 검체를 발송하여 248 기관(88.3%)의 회신율을 보였다(Table 1).
결과회신율은 2006년 1차 98.2%, 2차 90.0%, 3차 93.4%, 4차 96.9%를 보였는데 1차에는 결과 미 발송 기관에 대하여 우편 및 전화로 결과 미 접수 사실을 통보하고 추가 결과입 력 기회를 주었으나 2차부터 참여기관의 능동적인 참여의식 을 고취시키기 위하여 추가 결과입력 기회를 주지않은 때문 이라 사료되며, 차수가 거듭될수록 결과회신율이 상승하고 있음을 알 수 있었다.
일반혈액 검사용 정도관리 물질은 1차, 3차, 4차에는 동
일 혈액형을 가지고 있는 정상인으로부터 채혈한 혈액을 영
국의 Reardon DM[1]이 개발한 방법을 이용하여 자가제 조하였고, 2차에는 BIO-RAD사의 Lyphochek
TMHema- tology-16 Control H를 구매하여 이용하였다. 정도관리물 질을 자가제조할 때 높은 변이계수의 원인 중 하나인 관리 물질의 분주에 의한 오차를 배제하기 위하여 제조시 20 vial마다 하나씩 추출하여 균질성을 조사하였다. 일반혈액 검사 정도관리물질의 변이계수는 1차~4차까지 각각 백혈 구 3.24%, 2.53%, 2.00%, 1.52% 혈색소 0.80%, 0.75%, 0.74%, 0.71% 적혈구용적백분율 0.56%, 0.85%, 0.53%, 0.84% 적혈구 0.74%, 0.94%, 0.55%, 0.78% 혈소판 2.33%, 1.43%, 2.05%, 1.86%
을 보여 비교적 각 vial 간의 균질성이 잘 유지됨을 알 수 있었다(Table 2).
일반혈액검사 자동분석기기는 제조회사별로 Sysmex Co. 233기관(37.4%), Beckman Coulter Inc. 101기관(16.2%), Abbott Lab. 98기관(15.7), Bayer diagnostics 84기관(13.5%), Nihon Kohden Co. 33기관(5.3%), ABX diagnostics 31기관 (5.0%) 등의 순으로 사용하고 있어 2005년도에 비하여 사용 순위의 큰 변동은 없었으며, 기종별로는 XE-2100 67기관 (10.8%), ADVIA-120 57기관(9.1%), K-4500 46기관(7.4%), STKS 31기관(5.0%), SE-9000 30기관(4.8%), KX-21 29기 관(4.7%), Cell Dyn 1700 26기관(4.2%), Cell Dyn 3500 21기 관(3.4%) 등의 순으로 사용하고 있어(Table 3) 2004년의 ADVIA-120 62기관, XE-2100 46기관, SE-9000 37기관, STKS 31기관, K-4500 30기관, Cell Dyn 1700 22기관, KX-21 21기관 등의 사용순서와 비교하여 다소 변동이 있었 다.
백혈구수의 전체기관 변이계수는 1차 10.45% 2차 12.36% 3차 4.42% 4차 4.60%를 보여(Table 6) 2005 년의 1~4차 각각 9.21%, 6.01%, 5.98%, 4.29% 보다 약간 높았고, 기기그룹별 변이계수는 몇 그룹에서 변이계수 의 차이가 있었는데 2005년에도 비슷한 결과였다.
혈색소치의 전체기관 변이계수는 1차 1.81% 2차 1.95% 3 차 1.73% 4차 1.92%를 보여(Table 7) 2005년의 1~4차 각각 2.08%, 1.83%, 1.88%, 1.61% 과 비슷하였고 기기그룹별 변 이계수는 2005년과 같이 모든 그룹에서 안정된 결과를 보였 다.
적혈구용적백분율의 전체기관 변이계수는 1차 4.89% 2 차 6.01% 3차 3.40% 4차 3.74%를 보여 비교적 안정된 결과였고, 기기그룹별 변이계수는 모든 그룹에서 안정된 결 과를 보였다(Table 8).
적혈구수의 전체기관 변이계수는 1차 2.34% 2차 2.05% 3차 1.96% 4차 2.19%를 보여(Table 9) 2005 년도의 1~4차 각각 2.15%, 1.93%, 2.09%, 1.91%와 비슷한 결과였으며, 기기그룹별 변이계수는 모든 그룹에서 안정된 결과를 보였다.
혈소판수의 전체기관 변이계수는 1차 17.32% 2차
7.58% 3차 6.66% 4차 6.59%를 보여(Table 10) 1~4 차 각각 9.46%, 7.12%, 7.24%, 6.56%과 비슷한 결과 를 보였고 기기그룹별 변이계수도 2005년과 같이 몇 그룹 에서 높은 변이계수를 보였다.
혈액응고시간 검사용 정도관리 물질은 BIO-RAD사의 Lyphochek
ⓇCoagulation control Levels 2를 구매하여 이용하였으며, vial간의 균질성을 보기 위하여 20 vial마다 1 vial씩 총 15개 vial을 선택하여 표준편차와 변이계수를 구하였다. 4차에 실시한 혈액응고검사 정도관리물질의 변이 계수는 프로트롬빈시간 0.70%, 활성화부분트롬보플라스틴 시간 1.53%를 보여 각 vial 간의 균질성이 잘 유지됨을 알 수 있었다(Table 2).
혈액응고시간 검사는 예산관계로 4차에 1회 실시하였다.
혈액응고시간 자동분석기기는 제조사별로 Sysmex Co.
78기관(31.6%), Instrumentation Lab. 62기관(25.1%), Diag- nostica Stago 42기관(17.0%), Behnk Elektronik 22기관 (8.9%), SEAC 11기관(4.5%) 등의 순으로 사용하고 있었고, 기종별로는 CA 1500 28기관(11.3%), CA 500 series 28기관 (11.3%), ACL 9000 23기관(9.3%), STA Compact 22기관 (8.9%), ACL 100 17기관(6.9%) 등의 순으로 사용하고 있었 다(Table 4).
프로트롬빈시간 검사시약은 제조사별로 Dade Behring 99기관(40.1%), Instrumentation Lab. 61기관(24.7%), Diag- nostica Stago 43기관(17.4%), Pacific Homeostasis 38기관 (15.4%) 등의 순으로 사용하고 있었으며, 시약종별로는 Thromborel-S 75기관(30.4%), PT-fibrinogen HS 57기관 (23.1%), STA Neoplastin-C Plus 43기관(17.4%), Throm- boplastin-D 38기관(15.4%), Thromboplastin-C Plus 24기관 (9.7%) 등의 순으로 사용하고 있었다(Table 5).
활성화부분트롬보플라스틴시간 검사시약은 제조사별로 Dade Behring 97기관(39.4%), Instrumentation Lab. 59기관 (24.0%), Diagnostica Stago 43기관(17.5%), Pacific Homo- stasis 35기관(14.2%) 등의 순으로 사용하고 있었으며, 시약 종별로는 Actin 74기관(30.1%), PTT A 5 43기관(17.5%), APTT lyophilized silica 36기관(14.6%), Kontact APTT reagent 35기관(14.2%), Synthasil 23기관(9.3%) 등의 순으 로 사용하고 있었다(Table 5).
혈액응고시간 전체기관 변이계수는 프로트롬빈 19.85%, 활성화부분트롬보플라스틴 15.09%를 보여 다소 높은 수치 를 보였고(Table 15). 측정시약별 변이계수도 많은 차이를 보였다(Table 16, Table 17).
2005년까지 실시하던 백혈구감별계산은 검체제작 비용 과 인력이 많이 소요되며 결과 판독의 표준화가 어려운 관 계로 2006년부터 홈페이지에 게시한 혈액세포 사진을 조회 하여 판독하는 ‘세포형태판독’으로 대체 시행하였다.
2006년도에 처음 시도한 혈액세포형태 판독은 홈페이지
에 10개 혈액세포그림을 게시한 후 조회하여 판독하게 했
는데, 대부분 90%이상 잘 판독하였으나 1차의 20060153 neutrophilic band granulocyte 56.2%, metamyelo- cyte 36.8%, 20060158 myeloblast 70.8%, lympho- blast 13.1%, atypical lymphocyte 11.4%, 20060159 mature eosionphil 81.1%, Dohle body 16.8%를 보였 으며(Table 11), 2차 20060253 basophilic stippling 87.1%, reticulocyte 9.8%, 20060255 toxic granule 83.5%, mature eosinophil 10.9%, 20060257 plasmacytoid lymphocyte 59.5%, atypical lympho- cyte 27.3%, 20060259 myelocyte 56.2%, promyelo- cyte 40.7%를 보였고(Table 12), 3차 20060359 Auer body 48.5%, faggot cell 41.9%를 보였으며(Table 13), 20060455 Pelger-Huet anomaly 86.9%, neutro- philic segmented granulocyte 9.2%, 20060458 plasma cell 76.7%, plasmacytoid lymphocyte 8.7%
를 보여(Table 14) 미 성숙세포, 비특이세포, 이상세포의 판독이 다소 혼란스러운 것으로 나타났다.
10월에 실시한 workshop은 19명이 참가하였으며, ‘말 초혈액 혈구세포 감별법’, ‘참가자 질문 및 토의’, ‘말초혈액 혈구세포 감별 실습’, ‘진단혈액정도관리 운영’에 대하여 시 행하였다. 실습은 현미경으로 관찰한 슬라이드의 세포를 beam projector로 영사하여 참가자 전원이 동일한 세포를 동시에 판독하게 하여 세포판독의 표준화를 시도하였으나 현미경의 해상도 문제로 다소 아쉬움은 있었으나 시도는 좋 았다는 평을 받았다. 실무에서 경험한 문제들을 사전에 조 사 취합하거나 당일 질문한 내용을 토론형식으로 진행한
‘참가자 질문 및 토의’ 강의는 참가자들로부터 좋은 반응을 보였다.
검체발송에 소요되는 택배비용을 줄이는 대신 공인된 정 도관리검체를 이용하고자 2차 검체를 구매하여 1차검체와 동시에 발송하였으나 운영이 다소 미흡하여 만족할만한 결 과를 얻지 못하였다.
그동안 우편으로 결과를 접수한 후 결과를 입력하여 통 계를 분석하였으나 2006년부터 대한임상검사정도관리협회 홈페이지의 결과입력화면을 조회하여 참여기관에서 직접 결 과를 입력하게 하였고 위원회에서는 홈페이지에서 결과를 다운받아 분석함으로서 참여기관의 결과지 발송 비용과 위 원회의 결과입력 비용을 줄일 수 있었으며, 결과 입력 오류 와 운송시 분실사고도 방지할 수 있었고, 결과지 접수 기간 도 줄일 수 있었다.
결과 분석은 향후 참여기관에서 대한임상검사정도관리협 회 홈페이지 결과조회화면을 통하여 정도관리결과를 직접 조회 및 출력하게 하게 할 계획에 따라 그 전단 계로 홈페 이지에서 다운받은 결과를 import시켜서 통계를 분석하고 홈페이지에 분석결과를 올릴 자료를 export할 수 있는 ‘진단 혈액외부신빙도조사 통계분석 및 출력 프로그램(윤종현, 박 연보, 권계철, 김진규; 2006년; Visual FoxPro 5; Microsoft,
USA)’ 을 구현하여 이용하였다.
2006년은 충남대학교병원이 진단혈액분과 정도관리 사 업을 주관한지 여섯 번 째 해로서 두 번째 주관기관을 마무 리하는 해이다. 그동안 진단혈액분과사업을 주관하는데 행 정적인 도움을 주신 충남대학교병원 관계자 여러분, 검체제 조 및 발송업무에 노고가 많았던 진단검사의학과 직원들에 게 감사드리며, 진단혈액 정도관리 사업의 발전을 위하여 지원을 아끼지 않으신 본 회 관계자 여러분 특히 통계분석 프로그램 구현에 노고가 많았던 윤종현 총무이사께도 감사 드린다. 2007년은 충남대학교병원이 세 번째 주관기관으로 서 새롭게 출발하게 되었으며 위원회에서는 그동안의 문제 점을 파악하고 개선하여 참여기관에 보다 나은 서비스를 제 공하기 위하여 노력하겠다.
요 약
2006년도에 623여 기관을 대상으로 4회 실시한 혈액학 검사 신빙도조사는 다음과 같다. 검사종목은 백혈구수, 혈 색소치, 적혈구용적백분율, 적혈구수, 혈소판수, 혈액세포형 태판독, 프로트롬빈시간, 활성화부분트롬보플라스틴시간 등 8종목을 실시하였고, 방법은 전 년도와 비슷하였으며 회신 율은 약 94.6%이었다.
혈색소, 적혈구용적백분율 및 적혈구수의 변이계수는 안 정적이었으나 혈소판수와 백혈구수의 변이계수는 각 회사의 기기마다 차이가 있었다. 혈액세포형태판독은 세포에 따라 차이가 있었다.
참 고 문 헌
1. Reardon DM, Mark D, Warner B, hutchinson D. A whole blood control for blood count analysers, and source material for an external quality assessment scheme. Med Lab Scien 1991;48:19-26.
2. 김백수, 이삼열, 김재룡, 도화섭, 박종우, 송경순, 양동욱, 조한익, 조현찬. 혈액학적 검사 외부정도관리 결과보고 (1990). 임상병리와 정도관리 1991;13:27-34.
3. 김백수, 김재룡, 도화섭, 박종우, 송경순, 양동욱, 조한익, 조현찬, 윤홍섭, 이삼열. 혈액학검사 신빙도검사 결과보고 (1991). 임상병리와 정도관리 1992;14:21-34.
4. 조한익, 김백수, 김재룡, 도화섭, 박종우, 송경순, 송운홍, 박효순, 양동욱, 윤종현, 윤홍섭, 정화순, 조현찬, 함천경.
혈액학검사 신빙도조사 결과보고(1992). 임상병리와 정도 관리 1993;14:23-36.
5. 조한익, 김백수, 김재룡, 도화섭, 박종우, 송경순, 송운홍, 박효순, 양동욱, 윤종현, 윤홍섭, 정화순, 조현찬, 함천경.
혈액학검사 신빙도조사 결과보고(1993). 임상병리와 정도
관리 1994;16:23-32.
6. 조한익, 김백수, 김재룡, 도화섭, 박종우, 송경순, 송운홍, 박효순, 양동욱, 윤종현, 윤홍섭, 정화순, 조현찬, 함천경.
혈액학검사 신빙도조사 결과보고(1994). 임상병리와 정도 관리 1995;17:23-33.
7. 정화순, 나동진, 도화섭, 송경순, 양동욱, 윤형두, 윤홍섭, 이웅수, 조한익, 지현숙, 한경자. 혈액학검사 신빙도조사 결과보고(1995). 임상병리와 정도관리 1996;18:25-34.
8. 정화순, 나동진, 도화섭, 송경순, 양동욱, 윤형두, 윤홍섭, 이웅수, 조한익, 지현숙, 한경자. 혈액학검사 신빙도조사 결과보고(1996). 임상병리와 정도관리 1997;19:33-48.
9. 정화순, 나동진, 도화섭, 송경순, 양동욱, 윤형두, 윤홍섭, 이웅수, 조한익, 지현숙, 한경자. 혈액학검사 신빙도조사 결과보고(1997). 임상병리와 정도관리 1998;20:31-41.
10. 이웅수, 노명희, 도화섭, 박찬정, 송경순, 양동욱, 윤형두, 윤홍섭, 이귀순, 정화순, 조한익, 지현숙, 최종태, 한경자.
혈액학검사 신빙도조사 결과보고(1998). 임상병리와 정도 관리 1999;21:23-36.
11. 이웅수, 노명희, 도화섭, 박찬정, 송경순, 양동욱, 윤형두, 윤홍섭, 이귀순, 정화순, 조한익, 지현숙, 최종태, 한경자.
혈액학검사 신빙도조사 결과보고(1999). 임상병리와 정도 관리 2000;22:19-37.
12. 이웅수, 노명희, 도화섭, 박찬정, 송경순, 양동욱, 윤형두, 윤홍섭, 이귀순, 정화순, 조한익, 지현숙, 최종태, 한경자.
혈액학검사 신빙도조사 결과보고(2000). 임상병리와 정도 관리 2001;23:15-32.
13. 박종우, 권계철, 박효순, 이웅수, 도화섭, 박찬정, 송경순, 양동욱, 이복자, 이도훈, 정화순, 조한익, 지현숙, 최종태, 한경자. 혈액학검사 신빙도조사 결과보고(2001). 임상병리 와 정도관리 2002;24:13-25.
14. 박종우, 권계철, 박효순, 이웅수, 박찬정, 송경순, 양동욱, 박연보, 이도훈, 정화순, 조한익, 지현숙, 최종태, 한경자.
혈액학검사 신빙도조사 결과보고(2002). 임상검사와 정도 관리 2003;25:35-49.
15. 박종우, 권계철, 박연보, 박찬정, 박효순, 송경순, 양동욱, 이도훈, 이웅수, 정화순, 조한익, 조현찬, 지현숙, 최종태, 한경자. 혈액학검사 신빙도조사 결과보고(2003). 임상검사 와 정도관리 2004;26:29-45.
16. 박종우, 권계철, 박연보, 박찬정, 박효순, 송경순, 양동욱, 이도훈, 이웅수, 정화순, 조한익, 조현찬, 지현숙, 최종태, 한경자. 혈액학검사 신빙도조사 결과보고(2004). 임상검사 와 정도관리 2005;27:21-36.
17. 권계철, 김선희, 김용구, 박연보, 박종우, 박찬정, 박효순, 서장수, 양동욱, 이웅수, 임춘화, 임환섭, 조한익, 조현찬.
혈액학검사 신빙도조사 결과보고(2005). 임상검사와 정도
관리 2006;28:27-40.
Table 1. Status of participants in the reliability research
Samples Trial times Sample
delivery date
Result delivery date
Delivered participants
Replying participants
Replied rate(%)
CBC count
1st 2006.05.09 2006.06.07 602 591 98.2
2nd 2006.05.09 2006.06.20 614 553 90.0
3rd 2006.09.12 2006.09.27 633 591 93.4
4th 2006.11.15 2006.12.06 643 624 96.9
Mean - - 623 590 94.6
Blood cell morphology
1st 2006.05.09 2006.06.07 602 429 71.3
2nd 2006.06.07 2006.06.20 614 387 63.0
3rd 2006.09.12 2006.09.27 633 410 64.8
4th 2006.11.15 2006.12.06 643 404 62.8
Mean - - 371 350 65.4
Blood coagulation time 4th 2006.11.15 2006.12.06 281 248 88.3
Mean - - 281 248 88.3
CBC:Complete Blood Cell
Table 2. Homogeneity degree for quality assessment material
Trial times
WBC* HGB* HCT* RBC* PLT* PT* INR aPTT* ratio
SD CV SD CV SD CV SD CV SD CV SD CV SD CV
1st 0.19 3.24 0.11 0.80 0.22 0.56 0.03 0.74 4.61 2.33 - - - -
2nd 0.36 2.53 0.13 0.75 0.44 0.85 0.05 0.94 6.59 1.43 - - - -
3rd 0.09 2.00 0.10 0.74 0.19 0.53 0.02 0.55 3.31 2.05 - - - - -
4th 0.09 1.52 0.09 0.71 0.32 0.84 0.03 0.78 3.90 1.86 0.02 0.70 0.03 1.53
* unit:%, SD:Standard Deviation, CV:Coefficient of Variation, CBC:Complete Blood Cell count, HGB:Hemoglobin,
HCT:Hematocrit, PLT:Platelet, RBC:Red Blood Cell, PT:Prothrombin Time, aPTT:Activated Partial Thromboplastin
Time
Table 3. Current status of Auto-Analyzer for CBC test
Manufacturer Users(%) Code Instrument Users(%) Code Instrument Users(%)
Others 5(0.8) 0002 Others 5(0.8) - - -
Abbott Lab. 98(15.7)
0121 Cell Dyn 1200 4(0.6) 0124 Cell Dyn 1600 6(1.0) 0125 Cell Dyn 1700 26(4.2) 0126 Cell Dyn 1800 3(0.5) 0131 Cell Dyn 3000 9(1.4) 0141 Cell Dyn 3200 15(2.4) 0151 Cell Dyn 3500 21(3.4) 0152 Cell Dyn 3700 13(2.1)
0161 Cell Dyn 4000 1(0.2) - - -
ABX Diagnostics 31(5.0)
0212 MICROS 5(0.8) 0213 MICROS 60 13(2.1) 0214 PENTRA 60 4(0.6) 0216 PENTRA 80 8(1.3)
0217 PENTRA 120 1(0.2) - - -
Bayer Diagnostics 84(13.5) 0321 ADVIA-60 6(1.0) 0341 ADVIA-120 57(9.1)
0342 ADVIA-2120 213.4) - - -
Beckman Coulter Inc. 101(16.2)
0412 T-540 8(1.3) 0414 T-890 2(0.3)
0422 JT 6(1.0) 0424 STKR 2(0.3)
0432 Ac*T-10 1(0.2) 0441 Ac*T Diff 4(0.6) 0442 Ac*T Diff2 13(2.1) 0444 Micro Diff Ⅱ 1(0.2)
0451 HmX 8(1.3) 0452 MAXM 1(0.2)
0461 Gen-S 3(0.5) 0462 STKS 31(5.0)
0472 LH-750 16(2.6) 0473 LH-755 5(0.8)
Boule Medical Lab. 5(0.8) 0521 CA530 oDEN 1(0.2) 0523 CA530 Miner 1(0.2) 0542 CA620 Blader 1(0.2) 0545 AC920eo+ 2(0.3) Drew Scientific group PL 5(0.8) 0611 Excell-18 4(0.6) 0612 Excell-22 1(0.2)
ERMA INC. 7(1.1) 0712 PEC-90 6(1.0) 0716 ERMAX 18 1(0.2)
Horiba Ltd. 5(0.8) 0812 LC 550 4(0.6) 0813 LC-178 CRP 1(0.2)
Nihon Kohden Co. 33(5.3)
0912 MEK-5208K 2(0.3) 0913 MEK-6108K 2(0.3) 0914 MEK-6318K 13(2.1) 0921 MEK-8118K 9(1.4)
0922 MEK-8222K 7(1.1) - - -
SEAC 11(1.8) 1012 Hemat 8 5(0.8) 1014 Hemat 12 3(0.5)
1016 Genius-S 3(0.5) - - -
Sysmex Co. 233(37.4)
1112 F-820 3(0.5) 1121 KX-21 29(4.7)
1122 K-800 3(0.5) 1123 K-1000 2(0.3)
1124 K-4500 46(7.4) 1141 SF-3000 18(2.9)
1151 SE-9000 30(4.8) 1161 XT-1800 17(2.7)
1162 XT-2000 14(2.2) 1163 XT-2100 2(0.3)
1171 XE-2100 67(10.8) 0002 pocH-100i 2(0.3)
Bio-medical electronics 6(1.0) 1311 Mindray BC-3000 6(1.0) - - -
Table 4. Current status of Auto-Analyzer for Blood Coagulation test
Manufacturer Users(%) Code Instrument Users(%) Code Instrument Users(%)
Others 12(4.9) 0002 Others 12(4.9) - - -
Behnk Elektronik 22(8.9) 0101 CL 4 12(4.9) 0102 Coagulator 10(4.0)
Behring Diagnostics 2(0.8) 0201 Fibrin Timer II 2(0.8) - - -
bioMerieux Co. 6(2.4) 0301 Option 2 4(1.6) 0303 Coag-A-Mate XM 2(0.8) Diagnostica Stago 42(17.0) 0401 STA-Compact 22(8.9) 0402 STA-Compact-CT 8(3.2)
0403 STA-R 12(4.9) - - -
Fisher Scientific Co. 6(2.4) 0501 Thrombo Screen 200 4(1.6) 0502 Thrombo Screen 400C 2(0.8)
HUMAN 2(0.8) 0601 Humaclot duo 2(0.8) - - -
Instrumentation Lab. 62(25.1)
0701 ACL 100 17(6.9) 0702 ACL 200 12(4.9)
0703 ACL 300 1(0.4) 0704 ACL 1000 9(3.6)
0706 ACL 3000 3(1.2) 0708 ACL 7000 3(1.2)
0709 ACL 9000 23(9.3) 0710 ACL Advance 5(2.0)
IRC 1(0.4) 0801 Coag Stat Super 1(0.4) - - -
MLA 1(0.4) 0902 Electra 800 1(0.4) - - -
SEAC 11(4.5) 1001 CLOT 2S 11(4.5) - - -
Sysmex Co. 78(31.6)
1101 CA 50 9(3.6) 1102 CA 500 series 28(11.3)
1103 CA 1000 1(0.4) 1104 CA 1500 28(11.3)
1105 CA 6000 1(0.4) 1106 CA 7000 11(4.5)
Trinity Biotech 2(0.8) 1203 KC 4A Micro 2(0.8) - - -
Table 5. Current status of Reagent for Blood Coagulation test
Manufacturer Users(%) PT aPTT
PT aPTT Code Reagent Users(%) Code Reagent Users(%)
Others 1(0.4) 5(2.0) 0002 Others 1(0.4) 0002 Others 5(2.0)
bioMerieux Co. 1(0.4) 2(0.8) 0102 Thromboplastin 1(0.4) 0101 Platelin LS 2(0.8)
Dade Behring Inc. 99(40.1) 97(39.4)
0201 Thromboplastin-C Plus 24(9.7) 0201 Actin 74(30.1) 0202 Thromborel-S 75(30.4) 0202 Actin FS 12(4.9)
- - - 0203 Pathrombin SL 11(4.5)
Diagnostica Stago 43(17.4) 43(17.5) 0301 STA Neoplastin-CI Plus 43(17.4) 0301 STA PTT A5 43(17.5) DiaMed Inc. 2(0.8) 2(0.8) 0401 Diaplastin 2(0.8) 0401 Diacelin 2(0.8)
Gernon 1(0.4) 1(0.4) 0501 Hemoplastin 1(0.4) 0501 Hemos PTT 1(0.4)
HUMAN - 2(0.8) - - - 0601 Hemostat APTT-EL 2(0.8)
Instrumentation Lab. 61(24.7) 59(24.0) 0701 PT-Fibrinogen HS 57(23.1) 0701 APTT lyophilized
silica 36(9.3)
0702 PT-Fibrinogen 4(1.6) 0702 Synchasil 23(14.6) Pacific Hemostasis 38(15.4) 35(14.2) 0901 Thromboplastin-D 38(15.4) 0901 Kontact APTT
reagent 35(14.2)
Trinity Biotech 1(0.4) - 1201 Thromboplastin-S 1(0.4) - - -
Table 6. Results of white blood cell counts classified by instrument groups
Code Instrument group
1st (2006011)
2nd (2006021)
3rd (2006031)
4th (2006041) Partici-
pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
001 Manual 1 4.00 1.00 - - - 1 3.90 0.00 - - -
002 Others 5 4.24 20.75 6 14.43 43.66 8 4.78 17.36 8 6.12 8.01
012 Cell Dyn-1000 series 34 4.56 6.80 31 21.38 6.74 38 4.22 4.03 39 6.14 4.40
013 Cell Dyn-3000 9 2.57 63.04 8 10.68 36.52 8 3.41 29.62 9 4.09 39.61
014 Cell Dyn-3200 14 4.07 22.60 12 12.23 21.83 14 4.06 10.10 15 5.62 19.22
015 Cell Dyn-(3500,3700) 36 4.26 29.11 34 18.98 21.44 33 4.11 11.44 34 6.15 5.04
016 Cell Dyn-4000 1 3.86 0.00 1 25.30 0.00 - - - 1 6.38 0.00
021 MINOS,MICROS-60,PENTRA-(60,80,120) 32 4.75 6.74 27 21.16 5.58 29 4.33 4.85 31 6.27 2.71
032 ADVIA-60 6 4.55 5.27 5 20.32 9.74 5 4.15 1.93 6 6.05 2.48
034 ADVIA-(120,2120) 76 4.92 8.94 74 20.75 13.64 77 4.37 3.43 78 6.44 3.11 041 S-880,T-(540,660,890) 10 4.66 9.66 8 21.59 3.61 7 4.28 1.64 10 6.35 2.83 042 Coulter-(JR,JT,ONYX,STKR) 10 4.77 4.40 10 20.98 5.72 7 4.36 4.36 8 6.31 2.38
043 Ac*T-8,Ac*T-10 - - - - - - 1 4.40 0.00 1 6.30 0.00
044 Ac*T diff2,Ac*T diff,MD,Microdiff Ⅱ 16 4.68 7.48 15 21.79 4.18 16 4.39 5.01 18 6.43 3.73
045 HmX,MAXM 10 4.68 12.82 10 21.84 3.53 8 4.36 2.06 9 6.36 4.09
046 Gen-S,STKS 33 4.78 9.41 33 21.69 6.96 30 4.35 3.68 34 6.35 3.78
047 LH-(700,750,755) 18 4.33 12.24 17 22.15 1.76 20 4.38 2.51 21 6.45 1.86 052 CA-530-(oDEN,Thor,Miner),CA-570 2 4.85 3.09 - - - 1 4.20 0.00 2 6.05 4.13 054 DA-620Loke,CA-(620Balder,900eo+ series) 3 4.27 7.96 2 19.66 5.85 2 4.35 1.15 3 6.14 2.77 061 Excell-18,Excell-22 5 4.72 17.58 5 21.28 3.99 4 4.35 1.15 5 6.42 2.65 071 PEC-(80,90,140,170,210),ERMAX-18 6 4.57 8.75 6 19.17 12.31 5 4.54 5.07 7 6.60 7.88
081 LC-(170,550) 3 4.19 18.85 3 21.18 5.90 3 4.17 2.88 3 6.03 1.99
091 MEK-(5108K,5108K,6108K,6318K,8118K) 15 4.80 9.38 10 20.41 11.32 16 4.26 4.93 17 6.45 4.81 092 MEK-(7222K,8222K) 18 4.88 6.97 16 20.36 12.92 17 4.46 2.02 16 6.61 4.24 101 H5-M,H-(8,10,12,20),Genius-S 12 4.64 8.19 9 17.83 19.07 10 4.32 5.32 11 6.21 6.76
111 F-520,F-820 - - - - - - - - - 3 6.10 0.00
112 K-(800,1000,4500),KX-21 79 4.74 5.91 72 19.72 6.59 88 4.19 2.63 80 6.16 2.44
113 NE-(1500,8000) - - - - - - 6 4.12 7.28 - - -
114 SF-3000 16 4.57 5.25 17 20.83 3.89 17 4.22 2.13 18 6.19 1.78
115 SE-9000 34 4.85 8.25 32 16.08 5.78 32 4.44 5.41 30 6.47 4.95
116 XT-(1800,2000,2100) 26 4.79 7.52 27 21.17 3.07 28 4.35 2.07 33 6.44 2.02
117 XE-2100 57 4.71 8.07 59 20.44 3.82 60 4.28 3.27 67 6.28 3.03
131 Mindray BC-3000 4 4.61 1.52 4 20.09 3.29 - - - 6 6.18 3.88
tot All instruments 591 4.69 10.45 553 20.22 12.36 591 4.30 4.42 624 6.30 4.60 * unit:×103/μL, ** unit:%, CV:Coefficient of Variation
Table 7. Results of Hemoglobin classified by instrument groups
Code Instrument group
1st (2006011)
2nd (2006021)
3rd (2006031)
4th (2006041) Partici-
pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
001 Manual 1 13.50 0.00 - - - 1 12.90 0.00 - - -
002 Others 5 12.94 14.68 6 15.22 26.08 8 12.94 7.03 8 12.91 4.03
012 Cell Dyn-1000 series 34 13.95 2.80 31 17.59 2.22 38 12.79 2.19 39 13.09 1.68
013 Cell Dyn-3000 9 13.79 1.38 8 17.44 0.97 8 12.70 1.50 9 13.01 1.84
014 Cell Dyn-3200 14 13.81 3.11 12 17.27 2.95 14 12.79 2.50 15 13.09 1.99
015 Cell Dyn-(3500,3700) 36 13.85 1.59 34 17.47 1.77 33 12.72 1.73 34 12.98 2.47
016 Cell Dyn-4000 1 14.30 0.00 1 17.30 0.00 - - - 1 13.30 0.00
021 MINOS,MICROS-60,PENTRA-(60,80,120) 32 13.76 1.67 27 17.21 2.09 29 12.69 2.13 31 12.85 2.49
032 ADVIA-60 6 13.83 0.80 5 17.62 3.23 5 12.72 1.49 6 13.10 2.21
034 ADVIA-(120,2120) 76 13.91 1.51 74 17.52 1.20 77 12.78 1.56 78 13.16 1.67 041 S-880,T-(540,660,890) 10 13.77 0.87 8 16.60 6.87 7 12.71 1.97 10 13.05 1.99 042 Coulter-(JR,JT,ONYX,STKR) 10 13.68 1.54 10 17.15 1.63 7 12.53 2.87 8 12.94 1.78
043 Ac*T-8,Ac*T-10 - - - - - - 1 12.60 0.00 1 13.10 0.00
044 Ac*T diff2,Ac*T diff,MD,Microdiff Ⅱ 16 13.66 2.56 15 17.19 1.63 16 12.56 1.59 18 12.88 2.02
045 HmX,MAXM 10 13.78 1.16 10 17.18 1.22 8 12.65 1.19 9 12.89 1.94
046 Gen-S,STKS 33 13.77 1.23 33 17.19 1.63 30 12.69 1.34 34 13.02 1.54
047 LH-(700,750,755) 18 13.80 1.16 17 16.97 1.24 20 12.62 1.03 21 13.00 1.08 052 CA-530-(oDEN,Thor,Miner),CA-570 2 14.05 1.78 - - - 1 12.60 0.00 2 12.70 0.79 054 DA-620Loke,CA-(620Balder,900eo+ series) 3 13.27 3.99 2 17.75 0.28 2 12.65 1.19 3 12.67 1.97 061 Excell-18,Excell-22 5 14.02 2.00 5 17.62 2.83 4 12.75 1.18 5 13.16 1.60 071 PEC-(80,90,140,170,210),ERMAX-18 6 13.53 2.88 6 17.32 1.62 5 12.16 5.02 7 12.73 1.96
081 LC-(170,550) 3 13.67 3.37 3 17.00 4.12 3 12.57 2.47 3 12.93 2.24
091 MEK-(5108K,5108K,6108K,6318K,8118K) 15 13.93 2.73 10 17.55 1.37 16 12.65 2.92 17 13.01 2.46 092 MEK-(7222K,8222K) 18 13.88 1.51 16 17.58 2.45 17 12.81 1.95 16 12.96 1.08 101 H5-M,H-(8,10,12,20),Genius-S 12 13.79 2.47 9 17.54 4.45 10 12.64 1.98 11 12.90 2.48
111 F-520,F-820 - - - - - - - - - 3 13.03 2.53
112 K-(800,1000,4500),KX-21 79 13.70 1.61 72 17.28 1.27 88 12.66 1.18 80 12.91 1.32
113 NE-(1500,8000) - - - - - - 6 12.48 1.84 - - -
114 SF-3000 16 13.81 1.16 17 17.36 0.58 17 12.72 0.79 18 13.05 1.23
115 SE-9000 34 13.86 1.15 32 17.55 1.08 32 12.74 0.94 30 13.07 1.07
116 XT-(1800,2000,2100) 26 13.82 1.37 27 17.45 0.97 28 12.69 0.79 33 12.95 1.31
117 XE-2100 57 13.87 1.08 59 17.47 0.92 60 12.69 1.10 67 13.05 1.00
131 Mindray BC-3000 4 13.60 1.54 4 18.00 1.06 - - - 6 12.98 2.70
tot All instruments 591 13.81 1.81 553 17.40 1.95 591 12.70 1.73 624 13.00 1.92 * unit:g/dL, ** unit:%, CV:Coefficient of Variation
Table 8. Results of hematocrit classified by instrument groups
Code Instrument group
1st (2006011)
2nd (2006021)
3rd (2006031)
4th (2006041) Partici-
pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
001 Manual 1 36.00 0.00 - - - 1 31.00 0.00 - - -
002 Others 5 40.94 16.73 6 45.72 28.13 8 37.73 5.01 8 37.90 10.16
012 Cell Dyn-1000 series 34 42.98 5.05 31 52.11 3.65 38 37.93 3.72 39 39.38 3.91 013 Cell Dyn-3000 9 42.99 2.91 8 52.71 1.82 8 38.43 3.10 9 40.06 3.59 014 Cell Dyn-3200 14 38.21 5.10 12 43.98 5.25 14 35.42 4.38 15 36.21 3.37 015 Cell Dyn-(3500,3700) 36 42.77 2.71 34 52.06 1.94 33 38.13 2.10 34 39.12 2.43
016 Cell Dyn-4000 1 42.70 0.00 1 49.40 0.00 - - - 1 39.50 0.00
021 MINOS,MICROS-60,PENTRA-(60,80,120) 32 41.29 5.47 27 49.46 4.77 29 37.71 3.74 31 38.64 3.67
032 ADVIA-60 6 41.23 2.28 5 48.86 1.49 5 37.16 1.29 6 38.70 2.71
034 ADVIA-(120,2120) 76 39.80 2.66 74 46.05 2.89 77 37.19 2.53 78 37.34 2.57 041 S-880,T-(540,660,890) 10 42.18 1.21 8 50.45 3.01 7 38.90 2.90 10 39.29 3.11 042 Coulter-(JR,JT,ONYX,STKR) 10 41.36 2.06 10 50.70 2.11 7 37.43 1.28 8 38.16 1.39
043 Ac*T-8,Ac*T-10 - - - - - - 1 39.30 0.00 1 39.70 0.00
044 Ac*T diff2,Ac*T diff,MD,Microdiff Ⅱ 16 42.22 3.32 15 51.90 3.68 16 37.66 3.32 18 38.53 4.20
045 HmX,MAXM 10 41.34 2.95 10 50.65 2.03 8 37.50 2.80 9 38.69 2.53
046 Gen-S,STKS 33 42.19 3.06 33 51.16 2.70 30 37.63 3.11 34 38.84 2.19
047 LH-(700,750,755) 18 41.39 0.97 17 50.65 1.22 20 37.52 1.39 21 38.59 1.45 052 CA-530-(oDEN,Thor,Miner),CA-570 2 41.55 4.45 - - - 1 37.10 0.00 2 36.40 0.82 054 DA-620Loke,CA-(620Balder,900eo+ series) 3 40.50 8.15 2 50.50 3.96 2 35.85 0.70 3 38.00 2.05 061 Excell-18,Excell-22 5 42.92 1.75 5 51.56 4.33 4 37.50 1.12 5 39.48 1.87 071 PEC-(80,90,140,170,210),ERMAX-18 6 42.75 5.73 6 51.85 5.73 5 38.94 5.24 7 38.81 2.99
081 LC-(170,550) 3 40.97 5.83 3 50.50 5.56 3 38.13 6.08 3 38.97 3.21
091 MEK-(5108K,5108K,6108K,6318K,8118K) 15 43.65 5.80 10 54.11 4.12 16 37.44 5.58 17 39.84 5.40 092 MEK-(7222K,8222K) 18 42.50 3.44 16 52.88 3.59 17 37.89 2.22 16 39.40 1.90 101 H5-M,H-(8,10,12,20),Genius-S 12 43.88 5.26 9 52.27 2.91 10 38.43 2.63 11 38.93 2.67
111 F-520,F-820 - - - - - - - - - 3 37.37 3.67
112 K-(800,1000,4500),KX-21 79 40.63 2.36 72 48.80 2.87 88 35.97 2.36 80 37.54 2.13
113 NE-(1500,8000) - - - - - - 6 37.55 6.44 - - -
114 SF-3000 16 41.01 2.46 17 48.72 1.85 17 36.09 1.30 18 38.12 2.81
115 SE-9000 34 43.69 3.09 32 53.67 1.62 32 36.83 2.42 30 38.20 3.52
116 XT-(1800,2000,2100) 26 43.65 3.73 27 53.00 1.57 28 36.05 2.33 33 38.60 2.90
117 XE-2100 57 43.67 2.31 59 53.67 1.42 60 36.67 1.53 67 38.78 2.68
131 Mindray BC-3000 4 42.73 4.66 4 53.10 3.94 - - - 6 38.80 2.73
tot All instruments 591 41.91 4.89 553 50.59 6.01 591 37.05 3.40 624 38.46 3.74 * unit:g/dL, ** unit:%, CV:Coefficient of Variation
Table 9. Results of red blood cell counts classified by instrument groups
Code Instrument group
1st (2006011)
2nd (2006021)
3rd (2006031)
4th (2006041)
Partici- pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
Partici- pants No.
Mean* CV**
001 Manual 1 4.60 0.00 - - - 1 4.11 0.00 - - -
002 Others 5 4.50 15.78 6 4.77 25.37 8 4.16 3.85 8 4.06 8.13
012 Cell Dyn-1000 series 34 4.69 2.99 31 5.42 2.58 38 4.11 1.70 39 4.12 2.18
013 Cell Dyn-3000 9 4.72 2.54 8 5.41 2.03 8 4.11 2.19 9 4.15 1.93
014 Cell Dyn-3200 14 4.71 2.12 12 5.44 1.84 14 4.14 2.42 15 4.16 1.92
015 Cell Dyn-(3500,3700) 36 4.72 2.12 34 5.40 1.67 33 4.12 1.94 34 4.15 2.17
016 Cell Dyn-4000 1 4.66 0.00 1 5.51 0.00 - - - 1 4.21 0.00
021 MINOS,MICROS-60,PENTRA-(60,80,120) 32 4.70 2.55 27 5.38 2.42 29 4.10 1.95 31 4.08 1.72
032 ADVIA-60 6 4.58 1.31 5 5.28 1.14 5 3.98 1.26 6 4.10 1.46
034 ADVIA-(120,2120) 76 4.73 1.69 74 5.36 1.49 77 4.13 1.94 78 4.14 1.69
041 S-880,T-(540,660,890) 10 4.69 0.85 8 5.38 2.42 7 4.08 1.23 10 4.11 2.19 042 Coulter-(JR,JT,ONYX,STKR) 10 4.65 1.51 10 5.38 2.04 7 4.05 1.98 8 4.04 1.49
043 Ac*T-8,Ac*T-10 - - - - - - 1 4.18 0.00 1 4.13 0.00
044 Ac*T diff2,Ac*T diff,MD,Microdiff Ⅱ 16 4.65 2.37 15 5.43 2.58 16 4.03 2.23 18 4.05 2.72
045 HmX,MAXM 10 4.64 3.45 10 5.34 1.87 8 4.04 2.23 9 4.04 1.24
046 Gen-S,STKS 33 4.71 2.12 33 5.37 1.86 30 4.05 1.98 34 4.08 1.72
047 LH-(700,750,755) 18 4.67 0.86 17 5.26 1.14 20 4.02 1.00 21 4.47 0.98
052 CA-530-(oDEN,Thor,Miner),CA-570 2 4.60 1.52 - 0.00 0.00 1 3.90 0.00 2 4.06 2.46
054 DA-620Loke,CA-(620Balder,900eo+ series) 3 4.56 2.19 2 5.47 2.38 2 4.08 1.72 3 4.04 0.99
061 Excell-18,Excell-22 5 4.74 1.69 5 5.42 0.18 4 4.08 0.74 5 4.15 0.72 071 PEC-(80,90,140,170,210),ERMAX-18 6 4.69 4.26 6 5.48 1.82 5 4.10 2.20 7 4.19 3.10
081 LC-(170,550) 3 4.41 5.67 3 5.37 3.54 3 4.04 3.47 3 4.04 2.48
091 MEK-(5108K,5108K,6108K,6318K,8118K) 15 4.63 3.67 10 5.31 2.45 16 4.05 2.47 17 4.08 3.19 092 MEK-(7222K,8222K) 18 4.66 2.15 16 5.32 1.88 17 4.09 1.71 16 4.11 1.46 101 H5-M,H-(8,10,12,20),Genius-S 12 4.78 2.93 9 5.43 2.76 10 4.21 2.38 11 4.23 3.55
111 F-520,F-820 - - - - - - - - - 3 4.07 0.98
112 K-(800,1000,4500),KX-21 79 4.67 1.93 72 5.36 1.31 88 4.05 1.48 80 4.05 1.23
113 NE-(1500,8000) - - - - - - 6 4.06 3.69 - - -
114 SF-3000 16 4.64 1.51 17 5.29 1.13 17 4.05 0.99 18 4.07 1.23
115 SE-9000 34 4.74 1.05 32 5.39 1.11 32 4.09 0.98 30 4.15 0.96
116 XT-(1800,2000,2100) 26 4.73 0.85 27 5.40 1.11 28 4.06 1.23 33 4.11 0.97
117 XE-2100 57 4.76 1.05 59 5.41 1.11 60 4.13 0.97 67 4.17 0.72
131 Mindray BC-3000 4 4.71 1.91 4 5.49 2.55 - - - 6 4.14 7.49
tot All instruments 591 4.70 2.34 553 5.37 2.05 591 4.09 1.96 624 4.11 2.19 * unit:×106/μL, ** unit:%, CV:Coefficient of Variation