309 책임저자:전해명, 서울특별시 영등포구 여의도동 62번지
150-713, 가톨릭대학교 의과대학 성모병원 외과 Tel: 02-3779-1175, Fax: 02-786-0802
E-mail: hmjeon@catholic.ac.kr
접수일:2007년 2월 19일, 게재승인일:2007년 7월 4일
재발한 위장관 간질성 종양(GISTs) 환자들의 임상양상 분석
가톨릭대학교 의과대학 성모병원 외과학교실
나건형ㆍ김영균ㆍ이한홍ㆍ지성배ㆍ채병주ㆍ허 훈ㆍ김 욱ㆍ전해명
Clinical Analysis of Recurrent Gastrointestinal Stromal Tumor (GIST) Patients
Gun Hyung Na, M.D., Young Kyun Kim, M.D., Han Hong Lee, M.D., Sung Bae Ji, M.D., Byung Joo Chae, M.D., Hoon Hur, M.D., Wook Kim, M.D. and Hae Myung Jeon, M.D.
Purpose: Gastrointestinal stromal tumors (GISTs) are of a mes- enchymal origin, and they arise predominantly from the gastro- intestinal tract. This study aims to aid the post operative man- agement of GIST patients by analyzing the clinical and im- munopathological features of recurrent GISTs.
Methods: We enrolled 98 GIST patients who had been oper- ated on for their primary tumor from 1987 to 2001 at the Catholic Medical Center. Among them, 28 patients had clinical and radiological features that were proved to be recurrence, and the patients’ survival rates were compared according to the treatment modalities.
Results: When the maximum length of tumor was shorter and the mitotic index lower, then these patients had higher disease free survival rates and lower recurrence rates. The Ki-67 neg- ative group had lower recurrence rates than their Ki-67 positive counterparts. Recurrence was mostly observed as liver metas- tasis. The mean length of time to recur was 22.96 months.
Fifteen patients received additional treatments such as surgery, chemotherapy and radiation therapy, but there was no significant difference in survival rates when they were compared to the 13 patients who did not receive further treatments.
Conclusion: Of the patients diagnosed with GIST after surgery, those with worse prognostic factors, i.e. a bigger tumor size and higher mitotic index, require more meticulous surveillance for tu- mor recurrence, and especially for liver recurrence, which was the most common recurrence site, during the follow up exams.
In addition, although there have not been any remarkably effec- tive treatments for the recurrent GIST patients, further re- searches for new therapy such as STI-571 is mandated. (J Korean Surg Soc 2007;73:309-314)
Key Words: Recurrence, GISTs, Prognostic factor 중심단어: 재발, 위장관 간질성 종양, 예후 인자 Department of Surgery, St. Mary's Hospital, College of Medicine, The Catholic University of Korea, Korea
서 론
GISTs (위장관 간질성 종양: Gastrointestinal Stromal Tumors) 는 위장관에서 발생하는 비상피성 종양으로서 전체 위암의 2.2%, 소장암의 13.9%, 대장직장암의 0.1%를 차지한다.(1) 2001 NIH, National Institutes of Health), 2004 ESMO, Euro- pean Society for Medical Oncology)년 GISTs consensus를 통 해 GISTs의 진단 및 등급의 분류, 일차치료 전략 등을 명확 히 하였으나,(2,3) 현재까지 재발한 GISTs의 치료전략은 확 립되어 있지 못한 실정이다. 또한 최근까지 국내외에서 발 표된 GISTs에 대한 연구는 대부분 원발성 GISTs의 임상 양 상 및 치료에 관한 것이며 재발성 GISTs에 대한 연구는 거 의 없었다. 저자들은 15년간 성모병원 외과에서 경험한 GISTs 환자들 중 진단 시 수술로 완전 절제된 후 추적 검사 기간 중 재발이 확인된 환자들의 임상양상과 면역 조직학적 특징을 분석하여 재발 시기나 임상양상, 재발에 따른 치료의 효과유무, 재발에 영향을 미치는 위험인자들에 관해 조사하 였다.
방 법 1) 대상
1987년에서 2001년까지 15년간 가톨릭대학교 의과대학 교 부속병원에서 복강 내 간엽성 종양(Mesenchymal tumors) 으로 수술 받은 122예 중 c-Kit (CD117)나 CD34에 양성을 보여 GISTs로 분류된 환자는 114예였다. 이들 중 원발암 발 견 시 종양이 완전 적출된 후 추적 검사를 시행한 98예(재 발: 28예)의 환자들을 대상으로 하였다. 원발암 발견 시의 수술기록과 병리 조직 및 면역화학염색 결과, 그리고 수술 후 재발까지의 기간과 재발 후의 임상 양상 및 추적 검사 결과를 후향적으로 분석하였다.
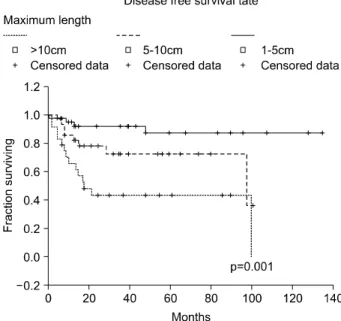
Fig. 1. Disease free survival of GISTs according to tumor size.
Fig. 2. Disease free survival of GISTS according to mitotic counts in 50 high power field.
2) 재발한 환자의 무병 생존기간 및 임상적 특징의 분 석 방법
원발 종양이 완전히 적출된 98명의 평균 추적검사 기간은 45개월(Range; 3∼128개월)이었으며 수술 후 보조적 치료 는 시행하지 않고 외래 경과 관찰하였다. 이들 중 28예 (28.6%)가 추적검사 기간 중 재발하였으며, 재발에 대한 진 단은 원발암의 장소와 상관없이 정기적인 추적 검사 과정 이나 추적 검사를 받지 않았을 경우 복부 팽만, 복부 종괴 촉지, 비특이적 소화기 증상 등으로 내원 후 이학적 검사나 방사선학적 소견으로 재발을 확인하였다. 간전이 및 복막 전이의 경우 복부전산화단층촬영 또는 복부 초음파 등을 시행하여 확인하였으며, 국소 전이의 경우 종양 부위의 종 괴 촉지 및 복부전산화단층촬영으로 진단하였고, 재발 수 술이 시행된 경우 병리적으로 재발을 증명하였다. 이들을 대상으로 NIH 분류법에서 고위험군의 기준이 되는 원발 종 양의 크기(10 cm), 유사분열 수(5/10 HPF, high-power field) 등에 따라 분류하고,(2) 또한 원발 부위, p53, Ki-67 면역조 직화학염색 여부와 c-kit mutation 여부에 따른 각각의 무병 생존기간의 차이를 Kaplan-Meier 생존분석과 Log rank test 를 이용하여 분석하였다.
3) 재발한 28예의 환자의 조기재발과 예후인자와의 관 련성 유무
재발한 28예의 환자 중에 12개월(1년) 이내에 재발한 군 을 조기 재발로 보았을 때 이를 원발 종양의 장소와 종양의 최장 길이, 유사 분열수, p53과 Ki-67 염색여부, c-kit mutation 유무 등으로 나누어 조기 재발에 의미가 있는 위험 요소를 χ2 test를 통하여 분석하였다.
4) 재발환자들의 임상양상 및 재발 후 생존율 분석 재발 환자들 전체의 수술 후 치료 과정과 생존 여부 그리 고 재발 후 생존율을 정리하였고 이를 가지고 치료 여부와 방법에 따른 생존율의 차이를 Kaplan-Meier 생존분석, Log rank test를 이용하여 분석하였다.
결 과
1) GISTs 환자의 예후인자와 무병 생존율 분석 전체 환자의 평균 무병 생존기간은 100개월이었으며 이와 비교하여 10 cm 이상인 군의 평균 무병 생존기간은 18개월 로 큰 차이를 보였고, 종양의 최장 길이에 따른 무병 생존율 또한 유의하게 차이를 보이고 있었다(5 cm 미만 vs 5∼10 cm; P=0.0478, 5∼10 cm vs 10 cm 이상; P=0.0296)(Fig. 1). 전 체 98예의 환자 중 66예의 환자에서 유사분열이 측정되었고 이들을 5/50 HPF 이하인 군과 5/50 HPF 이상인 군으로 분류 했을 때 각각 31명(47%), 35명(52%)이었고, 5/50 HPF 이상인
군의 무병 생존율이 유의하게 낮았다(P=0.0048)(Fig. 2).
면역조직화학염색에 따라 Ki-67 염색이 10% 이상 되는 것을 양성으로 정의하였을 경우,(4,5) Ki-67 양성 환자가 무 병 생존율이 유의하게 짧았으나(P=0.0001) p53의 염색 여부 (P =0.2676)와 c-kit mutation 유무(P=0.2584)는 통계적으로 유의하지 않았다. 원발 장소에 따라 재발환자의 생존율 분 석 시 소장이 원발 장소인 경우의 무병 생존율이 짧았으나 유의하지는 않았다(P=0.0763). 따라서 GISTs의 무병 생존율 에 영향을 주는 변수는 종양의 최장 길이와 유사분열 수, Ki-67 양성 여부였다(Table 1).
Table 1. Comparative analysis of disease free survival rate according to clinicopathologic features
Clinicopathologic factors (group) P value Size (<5 cm vs >5 cm, <10 cm vs >10 cm) 0.001**
Mitotic index (<5/50 HPF vs > 5/50 HPF) 0.0048**
Ki-67 (negative vs positive) 0.0001**
p53 (positive vs negative) 0.2676
c-kit mutation (positive vs negative) 0.2584 Primary site (stomach vs small bowel 0.0763
**Significant P value (<0.05).
Fig. 3. Recurrence rate according to recurrence sites.
Table 2. Comparative analysis of recurrence interval (before 12 months) according to clinicopathologic features Clinicopathologic factors (group) P value
Size (<10 cm vs >10 cm) 0.716
Mitosis (>5/50 HPF vs <5/50 HPF) 0.84 Primary site (stomach vs small bowel) 0.408
Ki-67 (negative vs positive) 0.65
c-kit mutation (negative vs positive) 0.128
p53 (negative vs positive) 0.03**
**Significant P value (<0.05).
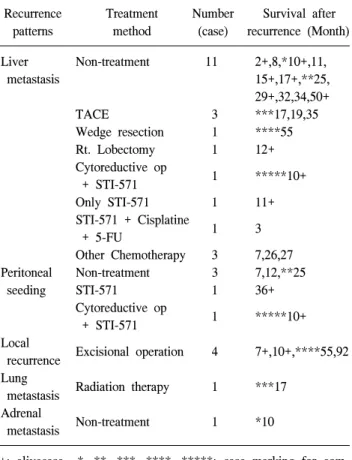
Table 3. Treatment modality for recurred cases Recurrence Treatment Number Survival after
patterns method (case) recurrence (Month)
Liver Non-treatment 11 2+,8,*10+,11,
metastasis 15+,17+,**25,
29+,32,34,50+
TACE 3 ***17,19,35
Wedge resection 1 ****55
Rt. Lobectomy 1 12+
Cytoreductive op
1 *****10+
+ STI-571
Only STI-571 1 11+
STI-571 + Cisplatine
1 3
+ 5-FU
Other Chemotherapy 3 7,26,27
Peritoneal Non-treatment 3 7,12,**25
seeding STI-571 1 36+
Cytoreductive op
1 *****10+
+ STI-571 Local
Excisional operation 4 7+,10+,****55,92 recurrence
Lung Radiation therapy 1 ***17
metastasis Adrenal
Non-treatment 1 *10
metastasis
+: alivecase *, **, ***, ****, *****: case marking for com- bined case.
2) 재발로 진단된 GISTs 환자들의 임상양상
추적 검사 기간 동안 전체 98예 중 28예(29%)가 재발하였 으며, 위와 소장에서 원발하였던 경우가 대부분이었고(24 예; 86%) 그 밖에 대망(2예)과 대장(2예), 그리고 복벽(1예) 에서 원발하였었다. 재발이 발견된 장소는 간이 가장 빈번하 여 전체의 79% (22예)가 간에서 재발하였고, 17.9% (5예)는 복막 재발, 14.4% (4예)는 국소 재발을 보였다. 이밖에도 폐 전이와 부신으로의 전이가 각각 한 예씩 있었고, 동시에 2군 데에서 재발이 발견된 경우 5예(17.9%)있었다(Fig. 3).
재발 환자들의 원발 종양 최장 길이는 평균 10.56 cm이었 으며 유사분열 수는 평균 22/50 HPF였다. 또한 재발까지의 평균기간은 22.96개월이었으며 28예 중 22예(79%)가 2년 (24개월)안에 재발하였다. 간에서 재발한 경우는 평균 18.77 개월(2∼98개월)만에 재발하였으며 복막에 재발한 경우는 25.2개월(2∼84개월), 그리고 국소 재발한 경우는 46.5개월 (1∼100개월)에 재발을 보였다.
3) 재발 환자들의 조기 재발 여부와의 다변량 분석 12개월 이내의 재발을 조기재발로 보았을 때, 전체 28예 중 13예(46%)가 12개월 내에 재발하였으며 대부분의 예후 인자는 조기재발과 상관관계를 갖지 못하였다. p53 면역화
학염색에서는 p53 음성반응 시 조기재발이 많았으나(P=
0.03), 통계적 분석에 의미를 두기에는 예가 너무 적었다.
4) 재발한 환자들의 임상과정 및 치료
재발한 환자 28예 중 13예는 치료를 받지 못하거나 거부 하였고 나머지 15명에게 치료가 이루어졌다. 간전이는 간 동맥색전술(TACE)을 받은 경우가 3예로 가장 많았으며 2 명의 환자에서는 쐐기 절제술과 우엽 절제술 등이 시행되 었다. 국소 전이의 경우에는 4예 모두 국소적 절제가 시행
Fig. 4. Survival analysis of recurrence GISTS according to treat- ment modalities.
되었다. 그 외의 환자들에서는 다양한 항암 화학 치료제와 방사선 치료가 시행되었고, 4예의 환자에게는 STI-571을 사 용하였다(Table 3).
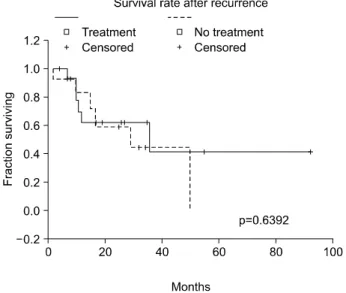
5) 재발환자들의 치료 후 생존율 분석
각각의 재발 형태에 따라 외과적 절제, 항암제제 투여, STI-571 등 여러 방법들이 시도되었으나, 재발 후 치료를 받은 15예와 치료를 받지 않은 13예의 생존율을 분석해 보 았을 때 통계적으로 유의한 차이를 보이지 않았다(P=
0.6392)(Fig. 4).
고 찰
GISTs는 위장관에서 발생하는 드문 간질성 종양으로 완 전 절제 후 5년 생존율이 10∼78%로 다양한 임상경과를 가 진다.(7-13) 현재까지 밝혀진 가장 중요한 예후 인자는 ‘유 사분열 수’와 ‘종양의 크기’이며,(2,3) 면역화학염색상 Ki-67 양성 여부, c-kit 유전자 돌연변이 유무나 위치 등도 GISTs 의 예후와 관련 있다는 사실이 밝혀지고 있다.(5,14) 그러나 GISTs의 재발은 13∼60%로(10,11,13,15) 재발이 흔한 질환 임에도 불구하고 그동안 재발에 영향을 주는 인자들과 재 발 양상, 그리고 재발한 GISTs 환자들의 임상과정 및 치료 에 대한 연구는 드물었다.
1992년 Ng 등(8,16)이 당시 위장관 악성 평활근종으로 진 단된 환자들을 대상으로 추적 검사한 결과 전체 122명 중 60%가 2년 내에 재발하였으며 장기 추적 검사 결과 10%만 이 무질병 상태로 유지되었다. 또한 원발 GISTs가 완전 절 제된 80예의 환자를 평균 24개월 추적 검사한 결과 27명이 재발하였고, 무질병 생존율에 대한 분석에서 고위험군의
기준이 되는 종양의 최장 길이가 10 cm 이상인 경우에 무질 병 생존율이 의미 있게 낮았다. Langer 등(13)도 39예의 환 자를 대상으로 종양의 크기와 유사분열 수에 대하여 무병 생존율을 분석하였는데 크기가 5 cm 이하이면서 10 HPF 당 2개 미만의 유사분열을 보이는 군에서 무병 생존율이 유의하게 높았다. 또한 Emory 등(18)은 간질성 종양에서 5/50 HPF 유사분열 수가 종양의 양성적 경과를 나타내는 경계가 된다고 하였다.
저자들의 연구에서 수술로 원발종양이 완전히 절제된 98 예를 대상으로 무질병 생존율을 분석한 결과 Fletcher 등(2) 이 제시한 GISTs의 악성도 예측의 기준이 되는 종양의 크 기(P=0.001)와 유사분열 수(P=0.0048)에서 통계적 유의성을 보이고 있었다. 또한 Ki-67이 10% 이상 양성을 보이는 경우 무질병 기간이 유의하게 짧아서(P=0.0001) 기존에 알려진 GISTs의 예후인자와 완전절제 후 재발까지의 무질병 생존 율이 밀접한 관련이 있음을 알 수 있었다.
GISTs의 경우 수술로 원발종양이 완전히 절제된 후 전이 성 재발을 잘하며 보통 18∼24개월에 재발을 잘한다고 보 고되고 있다.(10-13) 혈행성 확산(hematogenous spread)과 수 술 전 또는 수술 중 종양파열에 의한 복강내 파종(intra- peritoneal dissemination)에 의해 대부분의 전이가 간이나 복 막에 발생하며, 림프절 및 폐전이, 뼈전이 등은 드물다.
Ronald 등(9)은 간으로의 재발이 전체 재발의 63%를 차지하 여 가장 많았다고 보고하였으며, Yoshinari 등(10)은 위에서 발생한 60예의 GISTs 환자 중에서 8예(13%)가 재발하였는 데 그 중 5예(62.5%)는 간, 3예(37.5%)는 복막에 있었다고 보고하였다.
본 연구에서의 재발률은 29%로 대부분이 간(79%) 또는 복막(14.4%)에 발생하였으며, 평균 재발기간은 22.96개월로 79%가 2년(24개월) 안에 재발하였다. 따라서 일차적으로 수술을 받은 환자들에 대한 추적 검사 시 무질병 생존율과 밀접한 관련이 있는 종양의 크기(10 cm 이상) 및 유사분열 수(5/50 HPF 이상), Ki-67 10% 이상 양성 유무에 따라 특히 간 및 복막 전이에 대한 보다 철저한 감시가 필요하겠다.
GISTs는 원발 종양의 경우 근치적 절제술이 유일한 완치 법으로 여겨지고 있다.(17) 하지만 전체 환자 중 85%만이 완전 절제가 가능하며 완전 절제 후 재발이 흔해, 진단 당시 완전 절제가 불가능한 환자 및 완전 절제 후 재발한 환자에 대한 치료방법은 최근까지 정립된 바가 없다. Mudans 등 (19)은 재발한 GISTs 환자의 재발부위에 대한 절제술을 시 도해 보았지만 그 평균 생존 기간은 15개월로 대조군과 차 이가 없었다. 또한 doxorubin, mitomycin C, dacarbazine, cis- platin 등에 기초한 전신적인 항암치료가 다양하게 시도되 었으나 대체적으로 매우 낮은 반응률(10% 이하)을 보였 다.(20) 복막 재발에 있어서는 외과적 절제와 복강내 항암 요법의 병합요법이 시도되었으며,(20,21) 재발이 복막에 국 한된 경우 제한적인 효과가 있었으나 간 전이가 동시에 있
는 경우 생존율을 향상시키지 못했다. 국소 간 전이의 경우 간절제술 및 간동맥 항암 색전술이 시도돼 전신적 항암요 법보다 나은 효과를 보였으나,(20,22) 대부분의 간전이 환자 에서 간전이가 다발성으로 발견되거나 타 장기 전이가 동 시에 발견되는 경우가 많아 간절제술 및 간동맥 항암 색전 술은 제한적이다.(19,20) 본 연구에서도 재발 후 치료를 받 은 15명과 치료를 받지 않은 13명의 생존율을 분석해 보았 을 때 통계적으로 유의한 차이를 보이지 않아 현재까지 알 려진 치료방법이 재발한 GISTs 환자의 생존율을 크게 향상 시키지 못함을 알 수 있었지만, 이는 전체 재발 환자군의 숫자가 적었을 뿐만 아니라 최근 개발된 STI-571에 대한 연 구 기간이 짧아 추가적인 연구가 요구된다.
STI-571의 GIST에서의 사용은 2000년 2월 Joensuu 등(23) 에 의해서 여러 차례의 수술적 종양적출과 항암요법에도 계속적인 진행을 보이던 GIST 환자가 STI-571 투여 후 4주 만에 종양조직이 섬유화되는 효과를 확인한 것이 처음으로 보고되었다. 이후 STI-571이 전이성 악성 GIST의 치료에 효 과가 있다고 알려졌으며, 치료 후 반응에 대한 여러 연구에 서 54∼69%의 부분 관해(partial response)를 보였다.(24-26) 따라서 그동안 별다른 여러 방법으로 치료효과를 보지 못 했던 재발한 GISTs 환자에 있어서도 그 효과가 있을 것으 로 예상되며, 앞으로 임상적용을 통한 치료 효과뿐만 아니 라 c-kit 유전자의 돌연변이 유무나 돌연변이 위치에 따른 STI-571의 반응정도와 생존율에 대한 분석이 필요할 것으 로 보인다.
결 론
본 연구에서 GISTs 환자의 무병 생존율에 영향을 주는 변수는 종양의 최장 길이와 유사분열 수 그리고 Ki-67 양성 여부였으며, 재발한 GISTs 환자의 치료방법에 따른 생존율 을 분석한 결과, 치료유무 및 치료방법이 환자의 생존율에 영향을 미치지 못하였다.
따라서 일차적으로 수술을 받은 환자들에 대한 추적 검 사 시 재발에 영향을 미치는 원발 병변의 병리 조직학적 특성에 대한 인지가 필요하며 추적 검사 중 간전이 등에 대한 보다 철저한 감시가 필요하겠다. 또한 현재 GISTs의 선행보조요법, 완전절제 후 고위험군에 대한 보조요법 및 재발의 치료방법으로 STI-571에 대한 연구가 지속적으로 시행되고 있으며, 향후 분자생물학적 접근에 의한 새로운 치료방법이 지속적으로 연구되어야 할 것이다.
REFERENCES
1) Thomas RM, Sobin LH. Gastrointestinal cancer; incidence and prognosis by histologic type, SEER population-based data 1973-1987. Cancer 1995;75:154-70.
2) Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, et al. Diagnosis of gastrointestinal stromal tu- mors: A consensus approach. Hum Pathol 2002;33:459-65.
3) Blay JY, Bonvalot S, Casali P, Choi H, Debiec-Richter M, Dei Tos AP, et al. GIST consensus meeting panelists. Consensus meeting for the management of gastrointestinal stromal tumors. Report of the GIST Consensus Conference of 20-21 March 2004, under the auspices of ESMO. Ann Oncol 2005;
16:566-78.
4) Rudolph P, Gloeckner K, Parwaresch R, Harms D, Schmidt D. Immunophenotype, proliferation, DNA-ploidy, and bio- logical behavior of gastrointestinal stromal tumors: a multi- variate clinicopathologic study. Hum Pathol 1998;29:791-800.
5) Panizo-Santos A, Sola I, Vega F, de Alava E, Lozano MD, Idoate MA, et al. Predicting metastatic risk of gastrointestinal stromal tumors: Role of cell proliferation and cell cycle regu- latory proteins. Int J Surg Pathol 2000;8:133-44.
6) Suster S. Gastrointestinal stromal tumors. Semin Diagn Pathol 1996;13:297-313.
7) Miettinen M, El-Rifai W, H L Sobin L, Lasota J. Evaluation of malignancy and prognosis of gastrointestinal stromal tumor:
a review. Hum Pathol 2002;33:478-83.
8) Ng EH, Pollock RE, Munsell MF, Atkinson EN, Romsdahl MM. Prognostic factors influencing survival in gastrointestinal leiomyosarcomas. Implications for surgical management and staging. Ann Surg 1992;215:68-77.
9) DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors: re- currence patterns and prognostic factors for survival. Ann Surg 2000;231:51-8.
10) Mochizuki Y, Kodera Y, Ito S, Yamamura Y, Kanemitsu Y, Shimizu Y, et al. Treatment and risk factors for recurrence af- ter curative resection of gastrointestinal stromal tumors of the stomach. World J Surg 2004;28:870-5.
11) Samiian L, Weaver M, Velanovich V. Evaluation of gastro- intestinal stromal tumors for recurrence rates and patterns of long-term follow-up. Am Surg 2004;70:187-91.
12) Eilber FC, Rosen G, Forscher C, Nelson SD, Dorey F, Eilber FR. et al. Recurrent gastrointestinal stromal sarcomas. Surg Oncol 2000;9:71-5.
13) Langer C, Gunawan B, Schuler P, Huber W, Fuzesi L, Becker H. Prognostic factors influencing surgical management and outcome of gastrointestinal stromal tumors. Br J Surg 2003;
90:332-9.
14) Rudolph P, Gloeckner K, Parwaresch R, Harms D, Schmidt D. Immunophenotype, proliferation, DNA-ploidy, and bio- logical behavior of gastrointestinal stromal tumors: a multi- variate clinicopathologic study. Hum Pathol 1998;29:791-800.
15) van der Zwan SM, DeMatteo RP. Gastrointestinal stromal tu- mor: 5 years later. Cancer 2005;104(9):1781-8.
16) Ng EH, Pollock RE, Romsdahl MM: Prognostic implications of patterns of failure for gastrointestinal leiomyosarcomas.
Cancer 1992;69:1334-41.
17) Pierie JP, Choudry U, Muzikansky A, Yeap BY, Souba WW, Ott MJ. The effect of surgery and grade on outcome of gastro- intestinal stromal tumors. Arch Surg 2001;136:383-9.
18) Emory TS, Sobin LH, Lukes L, Lee DH, O'Leary TJ.
Prognosis of gastrointestinal smooth-muscle(stromal) tumors:
dependence on anatomic site. Am J Surg Pathol 1999; 23:82-7.
19) Mudan SS, Conlon KC, Woodruff JM, Lewis JJ, Brennan MF.
Salvage surgery for patients with recurrent gastrointestinal sar- coma: prognostic factors to guide patient selection. Cancer 2000;88:66-74.
20) Dematteo RP, Heinrich MC, El-Rifai WM, Demetri G. Clinical management of gastrointestinal stromal tumors: Before and af- ter STI-571. Hum Pathol 2002;33:466-77.
21) Eilber FC, Rosen G, Forscher C, Nelson SD, Dorey FJ, Eilber FR. Surgical resection and intraperitoneal chemotherapy for re- current abdominal sarcomas. Ann Surg Oncol 1999;6:645-50.
22) Rajan DK, Soulen MC, Clark TW, Baum RA, Haskal ZJ, Shlansky-Goldberg RD, et al. Sarcomas metastatic to the liver:
response and survival after cisplatin, doxorubicin, mitomy-
cin-C, ethiodol, and polyvinyl alcohol chemoembolization. J Vasc Interv Radiol 2001;12:187-93.
23) Joenssu H, Roberts PJ, Sarlomo-Rikala M, Andersson LC, Tervahartiala P, Tuveson D, et al. Effect of the tyrosine kinase inhibitor STI571 in a patient with a metastatic gastrointestinal stromal tumor. N Engl J Med 2001;344:1052-6.
24) Demetri GD, von Mehren M, Blanke CD, Van den Abbeele AD, Eisenberg B, Roberts PJ, et al. Efficacy and safety of im- atinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002;347:472-80.
25) Scaife CL, Hunt KK, Patel SR, Benjamin RS, Burgess MA, Chen LL, et al. Is there a role for surgery in patients with
“unresectable” cKIT+ gastrointestinal stromal tumors treated with imatinib mesylate? Am J Surg 2003;186:665-9.
26) Verweij J, Casali PG, Zalcberg J, LeCesne A, Reichardt P, Blay JY, et al. Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial.
Lancet 2004;364:1127-34.