HT-29 spheroid 세포에 대한
taxol 및 arsenic trioxide의 효과
연세대학교 대학원
임상병리학과
이 인 수
HT-29 spheroid 세포에 대한
taxol 및 arsenic trioxide의 효과
지도 김 태 우 교수
이 논문을 석사 학위논문으로 제출함
2004년 7 월 일
연세대학교 대학원
임상병리학과
이 인 수
이 인 수 의 석사 학위논문을 인준함
심사위원 인
심사위원 인
심사위원 인
연세대학교 대학원
2004년 7 월 일
감 사 의 글
너무나도 부족한 모습으로 대학원에 입학하게 되어 걱정이었지만 항상 곁에서 함께 해주신 분들이 있어서 이런 결실을 얻게 되었습니다. 저의 부족한점을 채울 수 있도록 도와주신 지도교수님과 학과의 여러 교수님께 진심으로 감사드립니다. 그리고 지금까지 바르게 키워주신 부모님께도 감사드립니다. 또한 힘들고 어려울 때 가족이란 이름으로 옆에서 힘이 되어준 가족들에게도 감사드립니다. 그리고 매 지리에서 가족들과 떨어져서 생활하는 동안에 또 다른 가족이 되어준 선배, 동기, 후배들에게도 감사드립니다. 저는 인생에서 사람관계가 가장 큰 재산이라고 생각합니다. 여러분들이 저의 재산이기에 전 행복합니다. 제가 항상 어디에 있든지 함께 해주신 분들을 기억하 고 그리워할 것입니다. 다시 한번 저에게 도움주신 많은 분들께 감사드립니다. 마 지막으로 저도 여러분들의 기억 속에 오래도록 기억되길 희망합니다 2004년 7월목 차
표 및 그림 목차 ··· ⅲ 약 기 호 표 ··· ⅴ 국문 요약 ··· ⅵ 제 1 장 서 론 ··· 1 제 2 장 재료 및 방법 ··· 5 1. HT-29 세포에서의 spheroid의 형성 ··· 5 2. 투사전자현미경을 이용한 HT-29 spheroid 세포의 관찰 ··· 5 3. 주사현미경을 이용한 HT-29 spheroid 세포의 관찰 ··· 6 4. DNA 분리 및 전기영동 ··· 65. Taxol과 arsenic trioxide의 세포독성능 측정 ··· 7
6. 동결박절 및 DAPI stain ··· 8
7. 세포질 분리 ··· 8
8. 단백질 정량 ··· 9
9. SDS-PAGE 및 western blotting ··· 9
제 3 장 결 과 ··· 11
1. 전자현미경을 이용한 HT-29 spheroid 세포의 관찰 ··· 11
2. DNA fragmentation analysis ··· 13
3. HT-29 monolayer cells과 HT-29 spheroid cells에서의 taxol과 arsenic trioxide의 세포독성능시험 ··· 17
4. DAPI stain을 통한 HT-29 spheroid 세포의 핵염색 ··· 21
제 4 장 고 찰 ··· 27
제 5 장 결 론 ··· 30
참 고 문 헌 ··· 32
그 림 목 차
Figure 1. Scanning electron micrographs(A,B) and transmission electron micrographs(C,D) of HT-29 spheroid cells. ··· 12
Figure 2. Analysis of DNA fragmentation on HT-29 monolayer cells(A) and HT-29 spheroid cells(B) treated with arsenic trioxide for 48h. ··· 14
Figure 3. Analysis of DNA fragmentation on HT-29 monolayer cells(A) and HT-29 spheroid cells(B) treated with taxol for 48h. ··· 15
Figure 4. Analysis of DNA fragmentation on HT-29 monolayer cells(A) and HT-29 spheroid cells(B) treated with the combination of arsenic trioxide and taxol for 48h. ··· 16
Figure 5. Cytotoxic effects of taxol on the monolayer and the spheroid of HT-29 cells. ··· 18
Figure 6. Cytotoxic effects of arsenic trioxide on the monolayer and spheroid of HT-29 cells. ··· 19
Figure 7. Cytotoxic effects of 20 μM arsenic trioxide with various concentration of taxol on HT-29 monolayer cells and the spheroid cells. ··· 20
Figure 8. DAPI(4',6-Diamidino-2-phenylindole) staining of HT-29 spheroid cells. ··· 22
Figure 9. Immunoblotting analysis of ERK1/2 activation by taxol on the monolayer and spheroid HT-29 cells. ··· 24
Figure 10. Immunoblotting analysis of ERK1/2 activation by arsenic trioxide on the monolayer and spheroid HT-29 cells. ··· 25
Figure 11. Immunoblotting analysis of ERK1/2 activation by arsenic trioxide and taxol on the monolayer and the spheroid HT-29 cells. ··· 26
약 기 호 표
BSA : bovine serum albumin
DAPI : 4',6-Diamidino-2-phenylindole DNA : deoxyribonucleic acid
DTT : dithiothreitol
EDTA : ethlenediamine tetraacetic acid
ELISA : enzyme-linked immunosorbent assay
ERK : extracellular signal-regulated kinase FBS : fetal bovine serum
HRP : Horseredish peroxide
JNK : c-Jun N-terminal kinase
MAP Kinase : mitogen-activated protein kinase PBS : phosphate-buffered saline
PMSF : phenylmethylsulfonyl fluoride
SEM : Scanning electron microscopy
SDS-PAGE : sodium dodecyl sulfate-polyacrylamide gel electrophoresis
TAE : tris-acetate EDTA
TBST : tris-buffered saline tween 20
국문요약
HT-29 spheroid 세포에 대한
taxol 및 arsenic trioxide의 효과
대장암은 미국에서 암에 의한 사망률중 두 번째를 차지하는 치명적인 암이며, 한국에서도 최근 발생률이 증가되고 있다. 최근 다양한 항암제의 복합처방의 효과 에 대해서 연구가 진행중이다. 그러나 고형암에 대해서 실시한 이러한 연구의 결 과들은 생체내에서 항상성을 나타내지 않았다. 본 연구에서는 대장암의 세포주중의 하나인 HT-29 세포주에 대하여 arsenic trioxide와 taxol을 각각 처리했을때 두약제가 나타내는 항암작용과 두약제를 조합 하여 처리하였을때 두약제의 상호작용에 의해 나타내는 항암작용을 비교하였다. 그리고 고형암과 유사한 특징은 나타내는 HT-29 세포의 spheroid에 대해서도 동 일한 실험을 하여 그 결과를 비교하고자 하였다.
먼저 지지체를 사용하지 않는 multicellular spheroid culture system을 사용하 여 HT-29 spheroid 세포를 형성하고 그 결과를 전자현미경으로 관찰하였다. 또 단층세포에서 각각의 약제에 대한 세포독성능을 본 결과, IC50값이 taxol은 18 nM
로 나타났고 arsenic trioxide는 33 μM로 나타났다. 그리고 두 약제를 복합처리할 경우에는 세포독성능이 감소하는 것으로 나타났다. 또한 spheroid 세포에서는 단 층세포에 비해서 세포독성이 감소하는 것으로 나타났다. 또한 HT-29 단층세포에 서 taxol은 100 nM 이상의 농도에서 DNA ladder가 형성됨을 확인하였고 arsenic trioxide는 20 μM 이상의 농도에서 DNA ladder가 형성됨을 확인하였다. 그러나 taxol과 arsenic trioxide를 복합처리한 HT-29 단층세포에서는 약제를 처리하지
않은 대조 세포에서의 결과와 유사하게 나타났다. 그리고 spheroid 세포에서는 taxol을 처리한 경우 단층세포에 비해서 DNA ladder가 현저하게 감소하는 것을 확인하였고 arsenic trioxide와 두 약제를 복합처리한 경우에는 DNA ladder를 관 찰할 수 없었다. 또한 DAPI stain을 통한 형광현미경관찰을 통해서 sphreoid 세포 내로의 약제의 침투가 어려움을 추측할 수 있었다. 위의 실험결과를 통해서 단층세포에서 각각 세포독성능을 갖는 약제가 동시에 처리하였을때는 서로 길항작용을 함을 알 수 있었다. 또한 조직세포와 가까운 spheroid 세포에서는 단층세포보다 더 높은 약제에 대한 저항성을 나타냄을 관찰 할 수 있었다. ---핵심어 : 대장암, taxol, arsenic trioxide, apoptosis, HT-29 세포주, monolayer, spheroid, 길항작용
제 1 장 서 론
최근 우리나라가 선진국화 되어감에 따라 육류와 동물성 지방의 섭취가 많아 지면서 우리나라 국민의 대장암 발생률이 급격히 증가하고 있다. 2000년 국가 암 통계를 보면 대장암은 남자와 여자에게 발생하는 암 가운데 각각 4위, 전체 암환 자의 10.3%로 매년 꾸준히 증가하고 있으며, 사망률은 10만명당 8.9명정도가 됨을 알 수 있다. 대장암의 발생분포를 보면 결장 47%, 직장 45.7%, S상결장 접합부 5.7%, 항문 1.6%라는 결과를 알 수 있게 되며. 남자 56.5% 여자 43.5%의 비율로 발생하였음을 알 수 있다. 또한 연령별로는 60대, 50대, 70대, 40대 순으로 많이 발 생하였다. 암의 치료를 위해서 오랫동안 합성 유도체 또는 천연 물질들의 선발을 통해 유용한 항암제를 발견해왔다. 요즈음은 진전된 상태의 종양들의 대부분이 화 학적 치료요법에 의한 치료가 불가능하기 때문에 새로운 항암제의 개발이 암의 치료에 중요한 역할을 하게 되었다. 실험실적 항암제 감수성 실험은 무작위 선별 방법과 알려진 항암제의 적절한 병용 실험의 두 가지 측면으로 실시되고 있다. 1985년까지 미국 국립 암연구소(NCI:National Cancer Institute)에서 일차적 항암 제 선별에 L1210 과 P388 murine leukemia 모델을 이용한 체내 실험을 적용해왔 다(1,2). 이들 실험과정의 가장 중요한 결점은 선택된 약제들이 백혈병(leukemia) 과 림프종(lymphoma)에는 탁월한 임상적 활성을 나타냈지만, 폐암, 대장암, 유선 종과 같은 아주 흔한 종류의 고형암에서는 아주 미미하거나 거의 활성을 나타내 지 않는다는 점이다. 이러한 단점을 극복하기 위해 NCI에서는 질환의 유형에 맞 춘 새로운 체외 검사 방법을 초기암 선별에 적용하기 시작하였다. 그리하여 폐암, 대장암, 유방암, 전립선암, 난소암, 신장암, 뇌종양 등에서 유래한 60가지 세포주 pannel 이 새로운 항암제의 발견에 사용되고 있으며 항암제 효과를 알아보고자 하 는 실험에 이용되고 있다(1). 그러나 고형암에 대해 실시한 이러한 실험과정의 결과들은 항상 일치하지 않았다. 실제적으로 이러한 단층세포 배양방법은 in vivo 조직과 완전하게 유사하지 는 않다. 단층세포 배양방법에서 세포의 성장 생리와 세포간의 연결이 유사하게 나타났더라도, 배양세포는 이차원적 구조이고 결코 고형암의 3차원적 구조가 아니 다. 더 나아가 단층세포 배양은 종양특유의 구조와 이질적인 성질을 흉내 낼 수 없다. 따라서 이러한 점들은 화학요법과 방사선치료의 효과에 영향을 줄 수 있는 산소분압, 세포밖의 산도, 영양물질, 대사물질 등 몇 가지 인자들이 고려되는 허혈 상태의 고형암과 같은 특수한 경우에는 항암제들을 체내에서 실험 할 때에 나타 나는 효과에 대한 올바른 예측을 기대 할 수 없다(3-8). 이러한 단점을 극복하기 위하여 콜라젠 겔 배양, mesh-supported organoid 배 양(histoculture), 다세포 구상체(multicellular spheroid)배양 등과 같은 종양의 삼 차원적 특성을 나타내는 몇 가지 실험적 모델이 개발되었다. 이러한 모델들은 공 모양의 세포중첩에 의한 조직배양의 형태로 종양의 조건과 유사하고 고형 종양을 치료하기 위한 약제의 동정에 중요한 기초를 형성 할 것으로 기대된다. 이 중 구 상체 세포 배양법이 있는데 이것은 콜라젠 겔에 세포부유액을 포매시키는 콜라젠 겔 배양법(9,10)과 셀루로오즈 또는 콜라젠이 포함된 스폰지지지체에 포매시켜 배 양하는 조직배양법(11,12)과는 다르다. 구상체 배양법은 별다른 지지체없이 일정한 회전운동을 유지시켜 주어 세포가 단층형성이 안되고 공 형태로 뭉쳐져서 자라게 하는 배양법을 말한다(13,14). 그러나 이러한 방법들이 훌륭한 방법이지만 이러한 방법들은 배양에 있어 많은 기술과 시간이 소모되는 결정적 단점을 가지고 있다. 이런 이유로 이 방법들이 일반적인 선별방법으로는 사용되어질 수 없었다(15-17). 그러나 특이한 연구의 목적을 위해서 또는 이차적 선별의 모델로서는 제한적으로 사용되고 있으며, 특히 구상체 세포는 약제의 선별과 배양조건을 검색하기 위한 모델로써 널리 사용되고 있다.
Taxol은 주목과의 나무인 Taxus brevifolia에서 분리된 천연물질로 난소암과 유방암에 탁월한 항암효과를 보이며 다른 암세포에 대해서도 그 효능을 보이는 것으로 알려져 있다 (18). Taxol은 세포의 분화를 억제하고 세포를 죽음으로 유도 하는 것으로 알려져 있는데 (19-23), 이는 미세소관에 직접 결합하여 미세소관의 분해를 억제, 안정화시킴으로써 세포주기 중 G2/M 시기에 세포분열을 억제시켜
그 효능을 나타낸다 (19, 20, 22, 24, 25). 또한 미세소관을 안정화시키는 작용 외에 도 혈관형성을 억제하는 작용이 있는 것으로 밝혀졌으며 (26), taxol이 세포내 미 세소관에 결합하여 세포를 방사선에 대한 감수성이 높은 G2/M 시기에 머물게 함 으로써 radiosensitizer로도 작용하므로 방사선 치료와 병행하여 taxol을 투여한 경 우 치료효과가 증대되는 것으로 보고되었다 (27-30). 또한 taxol은 미토콘드리아의 pathway에도 관여하는데, 이전의 보고에 의하면 대장암의 경우에 caspase-8과 caspase-3가 활성화됨에 따라 membrane potential이 감소하는 것으로 나타났다 (31).
Arsenic trioxide(As2O3)의 유해성은 오랜 동안 알려져 있어서 과량의 arsenic
trioxide가 체내에 흡입되면 매우 치명적인 결과를 나타내는 것으로 알려져 있는 데, arsenic trioxide에 지속적으로 노출되면 신경계장애와 간질환, 말초혈관질환등 을 유발하며, 종양발생의 위험을 현저히 증가시킨다(32). 그러나 미량의 arsenic trioxide는 동양의학에서 전통적인 치료제로도 사용되어 왔으며(33), 혈중내 저농도 의 arsenic trioxide(As2O3)는 acute promyelocytic leukemia(APL)의 치료에 효과
적인 것으로 밝혀졌다(34). 또한 arsenic trioxide는 chronic myelogenous leukemia(CML)뿐 아니라 acute myelogenous leukemia(AML)의 치료에 있어서도 좋은 효과를 보인다고 알려져 있는데 이러한 leukemia 이외에도 다양한 기전을 통해 고형암 세포에서 apoptosis를 일으킨다고 한다(35). 최근에 arsenic trioxide (As2O3)가 SW480, DLD-1, COLO201 등의 대장암 세포주에서도 농도에 따라서
세포의 성장을 억제한다는 보고가 있다(36).
Apoptosis(programmed cell death)는 특히 외부 자극에 대한 세포 내부에 이미 존재하는 일련의 프로그램에 의해 세포가 사멸하는 과정을 의미하는데 apoptosis 시 관찰할 수 있는 것은 DNA 분절, 세포의 형태학적인 변화와 세포 주기의 변화 등이다. 특히 DNA 분절은 internucleosomal DNA cleavage가 일어나서 180-200 bp 정도의 multiple ladder 형태의 DNA가 관찰되는 것으로, 이러한 DNA 분절은 주로 세포내에서 Ca2+나 cAMP의 농도 증가에 의해 핵 내에 존재하는 endogeneous endonuclease의 활성화를 통해 나타나는 것으로 알려져 있다(37,38). 또한 DNA 합성에 중요한 역할을 하는 topoisomeraseⅠ의 작용이 억제되거나
(39,40), histone H1과 같은 핵 내 단백질이 poly(ADP-ribosyl)ation되어 분해되면 서 DNA 분절이 유도된다(41). Apoptosis의 중요한 mediator로서 degradative enzyme인 caspase가 작용한다는 사실도 잘 알려져 있다(42). Apoptosis시의 형태 학적인 변화는 전자현미경을 통해서 관찰할 수 있는데, 핵막 주위로 핵 염색질이 농축되기 시작하면서 핵막과 세포막이 수포를 형성하고 마지막에는 남아있는 핵 이 분절되어 막으로 둘러싸인 특이적인 apoptotic body를 형성하면서 떨어져 나가 게 된다 (43-45). 최근 항암제에 내성을 나타내는 종양에 대하여 효과적인 항암작용을 나타낼 수 있도록 다양한 항암제를 적절하게 조합하여 복합처방하는 연구가 진행중이다 (46,47). 서로 다른 target을 갖는 여러 종류의 항암제를 병행 사용함으로써 부가적 또는 상승 작용을 기대하는 연구들과 비슷한 작용기전을 갖는 약제들의 복합처방 에 의한 치료효과에 대해서도 연구중이다(48-50).
이 연구는 arsenic trioxide와 taxol이 고형암의 한 종류인 대장암에 대하여 각 각이 항암작용을 나타내는지와 병행처리시에 그 항암효과의 변화를 알아보고 in
vivo 상의 고형암과 유사한 spheroid cell을 만들어 in vitro 상에서 단층세포로 배
양된 HT-29 human colorectal cancer cell에서 나타난 결과와의 비교를 통해서 단 층세포배양을 통해 얻어진 결과가 in vivo 상에 적용이 가능한가를 알아보고자 하 였다. 따라서 본 연구에서는 대장암 세포주인 HT-29 세포를 spheroid cell로 배양 을 하여 taxol과 arsenic trioxide를 단층세포배양시와 동일한 조건으로 처리하여 그 결과의 차이를 비교하였다.
제 2 장 재료 및 방법
1. HT-29 세포에서의 spheroid의 형성
Seaplaque(BMA)를 PBS에 1%의 농도로 녹여 고압멸균을 하여 48 well microplate(Nunc,Denmark)에 200 ㎕씩 분주하여 하루정도 실온에서 굳힌다. 여기 에 지수증식기의 세포를 well당 열처리 비활성 fetal bovine serum(Gibco BRL, Grand Island, USA) 5%가 첨가된 RPMI 1640 배지(Gibco BRL, Grand Island, USA) 300 ㎕에 1.5 × 105 개씩을 분주하여 Dancing shaker(Biomedlab)에 40 prm 으로 30분간 돌려준후에 37℃, 5% CO2 항온 항습 조건의 배양기(NAPCO
6001,USA)에서 증식시켰다.
2. 투사전자현미경을 이용한 HT-29 spheroid 세포의 관찰
정상적으로 72시간 배양한 spheroid 세포를 1 ㎖ 파이펫으로 조심스럽게 분리 해서 PBS로 2회 세척을 한후 PBS에 녹인 2.5% glutaldehyde로 2시간 동안 고정 하였다. 0.1 M Caocodylate buffer(pH 7.4)로 20분씩 2회 세척 후, 2% osmium tetroxide로 후고정을 1시간 30분 동안 하였다. 고정이 끝나면 위의 완충액으로 15 분씩 2회 세척을 하고, 50% ethanol에서부터 100%까지 10%간격으로 차례로 탈수 과정을 거친 후 치환을 하고, Polybed 812를 이용하여 포매를 하였다. 포매 과정 이 끝나면 열중합 과정을 거친 후, 박절을 하고 uranyl acetate와 lead citrate를 이 용하여 이중 전자 염색을 하였다. 그리고나서 JEM 1200 EX-Ⅱ 전자현미경 (JEOL, Japan)을 사용하여 관찰하였다.
3. 주사현미경을 이용한 HT-29 spheroid 세포의 관찰
정상적으로 72시간 배양한 spheroid 세포를 1 ㎖ 파이펫으로 조심스럽게 분리 해내어 PBS로 2회 세척을 한후 0.1 M phosphate buffer pH 7.4로 희석한 2% glutaldehyde와 2% osmium tetroxide로 고정하고, 에탄올에서 탈수한 후에 공기중 에서 건조하였다. 건조된 시료에 10 nm 두께로 금을 뿌려 입힌후에 SEM(JEOL Co. Tokyo, Japan)으로 관찰하였다.
4. DNA 분리 및 전기영동
형성된 spheroid 세포에 taxol과 arsenic trioxide를 각각 처리한 군과 둘을 같 이 처리한 군을 농도별로 처리한 후 48시간 동안 반응시킨 다음 DNA를 분리하였 다. 먼저 350 × g로 10분간 원심분리하여 세포를 모은 후 500 ㎕의 lysisⅠ buffer(1% Triton X-100, 50 mM Tris-HCl pH 7.4, 20 mM EDTA)를 첨가하고 얼음에 1시간 방치한 후 1,000 × g로 10분간 4℃에서 원심분리하여 세포 파쇄 상 층액을 모았다. 그 상층액에 1% SDS 100 ㎕, TE/RNase(RNase 10 ㎎/㎖, Sigma, USA in 10 mM Tris-HCl pH 7.5, 15 mM NaCl) 10 ㎕, Proteinase K(1 ㎎/㎖, Sigma, USA)를 50 ㎕ 첨가해 37℃에서 4시간 이상 반응시켰다. 그리고나서 phenol/chloroform/isoamylalcohol(25:24:1, Sigma, USA)을 동량 처리하여 현탁액 이 되도록 혼합 후 10,000 × g로 5분간 원심분리 하여 상층액을 모으고 100% cold ethanol로 -70℃에서 DNA를 침전시켰다. 이것을 10,000 × g로 20분간 원심 분리하여 상층액을 모두 제거하고 말린 다음 TE buffer(10 mM Tris-HCl, 1 mM EDTA, pH 8.0) 20 ㎕로 녹였다. 1.8% agarose gel(TAE buffer 35 ㎖, 0.63 g SeaKem gold agarose)에 DNA sample 20 ㎕와 type Ⅱ 6 × loading buffer(0.25% bromphenol blue, 0.25% xylene cyanol FF, 15% Ficoll Type
400(Sigma, USA) in water) 4 ㎕를 섞어 loading하고, 100 bp ladder(Bio-Rad, USA)를 marker로 이용하여 50 V로 1시간 동안 전기영동을 실시하였다. 영동이 끝난 gel은 자외선 광원(Vilber-Lourmat, USA)위에 두고 Polaroid film이 들어 있 는 Photo-Documentation Camera(Fisher Scientific, USA)를 이용하여 254 nm에 서 촬영하였다.
5. Taxol과 arsenic trioxide의 세포독성능 측정
지수 증식기에 있는 HT-29 세포를 100 ㎕당 1 × 104개의 세포가 되게 희석하 여 1% Seaplaque(BMA)가 깔린 96 well 미세 배양판(Nunc, Denmark)에 well당 100 ㎕씩 분주하였다. 각각의 세포 독성능과 병행처리시의 세포 독성능을 알아보 기 위해 96 well 미세 배양판에 분주된 세포에 농도별로 첨가하여 37℃, 5% CO2,
항온 항습 조건의 배양기에서 48시간 동안 배양하였다. 다음으로 premix WST-1 용액(Takara, Japan) 10 ㎕를 각 well에 첨가하여 4시간 동안 항온 항습기에 다시 배양한 후, spheroid 세포를 제거하고 490 nm에서 ELISA Reader (Molecular Device, USA)로 흡광도를 측정하였다. 각 대조군과 실험군은 동일한 것으로 3개 씩 준비하여 2번 실험해서 나온 모든 값의 평균을 구해 이를 실험값으로 취하였 다. 세포 독성능은 대조군의 흡광도에 대한 각 약제를 농도별로 처리한 실험군의 흡광도를 % survival로 환산하여 세포의 증식을 50% 억제할 수 있는 농도(IC50)를
6. 동결박절 및 DAPI stain
형성된 spheroid 세포를 1 ㎖ 파이펫으로 분리하여 PBS로 세척한 후 0.25% glutaraldehyde에 10분간 고정을 하였다. 고정된 spheroid 세포를 DAPI solution(1 ㎎/㎖, Sigma, USA)을 PBS에 1:1000으로 희석한 용액으로 실온에서 30분간 염색 을 하였다. 염색된 spheroid 세포를 동결박절기를 이용하여 신속하게 박절하여 광 학현미경과 형광현미경을 통해서 관찰하였다.
7. 세포질분리
단층세포(monolayer cell)의 경우 세포 5×106 cells/㎖를 mitogen에 대한 반응 없이 24시간 배양시킨 후 아무것도 처리하지 않은 대조군과, 100 nM taxol과 20 μM arsenic trioxide를 각각과 복합10, 30, 60, 120분간 처리한 실험군을 PBS로 세 척한 후 scraper로 긁어 모았다. 이것을 4℃에서 8,000 rpm으로 5분간 원심분리하 여 상층제거 후 200 ㎕의 cytosolic buffer(10 mM HEPES pH 7.9, 10 mM KCl, 1.5 mM MgCl₂, 0.5% Triton X-100, 1 mM PMSF, 1 mM DTT, 1 mM NaF, 1 mM Na₃VO₄)를 첨가하여 얼음 위에 1시간 방치시킨 다음, 4℃에서 14,000 rpm으로 5분간 원심분리하여 상층액만을 세포질 분획으로 얻었다.
또 spheroid 세포의 경우는 1 ㎖ 파이펫으로 조심스럽게 걷어내어 PBS로 세 척한후 4℃에서 8,000 rpm으로 5분간 원심분리하여 상층제거 후 200 ㎕의 cytosolic buffer(10 mM HEPES pH 7.9, 10 mM KCl, 1.5 mM MgCl₂, 0.5% Triton X-100, 1 mM PMSF, 1 mM DTT, 1 mM NaF, 1 mM Na₃VO₄)를 첨 가하여 얼음 위에 1시간 방치시킨 다음, 4℃에서 14,000 rpm으로 5분간 원심분리 하여 상층액만을 세포질 분획으로 얻었다.
8. 단백질 정량
단백질 정량은 bovine serum albumin(Sigma, USA)을 표준액으로 하여 Bradford assay solution(100 ㎎/L Coomassie Brilliant Blue G-250, 50 ㎖/L 95% ethanol, 100 ㎖/L 85% phosphoric acid) 1 ㎖에 시료를 5 ㎕를 넣고, 0.15 M NaCl을 95 ㎕ 넣어 595 nm에서 측정하여 단백질 양과 흡광도 간의 관계식을 구 하였다. 분리한 sample의 5 ㎕의 흡광도를 측정한 후 관계식을 이용하여 단백질 양을 알아내어 모든 sample의 단백질 양이 동량이 되게 하였다.
9. SDS-PAGE 및 Immunoblotting
분리한 sample 18 ㎕에 4 × sample buffer(0.25 M Tris-HCl pH 6.8, 8% SDS, 40% glycerol, 20% β-mercaptoethanol) 6 ㎕를 첨가한 후 95℃에서 5분간 가열하였다. 그리고나서 4% stacking gel과 10% separating gel 상에서 sample loading후 100 V로 2시간 30분 동안 전기영동 하였다.
전기영동이 끝난 gel을 blotting kit(Bio-Rad, USA)를 이용하여 transfer buffer(25 mM Tris, 192 mM glycine, 0.01% SDS, 20% methanol, pH 8.3)를 사 용하여 220 mA, 1시간 30분간 blotting을 진행시켜 0.45 ㎛의 pore size를 갖고 있 는 nitrocellulose paper에 옮긴 후 nitrocellulose paper를 Ponceau S로 염색하여 확인하였다. 증류수로 세척 후 blocking용액(10% skim milk in TBST)으로 실온 에서 2시간 이상 반응시킨 다음 TBST(10 mM Tris-HCl pH 8.0, 150 mM NaCl, 0.1% Tween-20)로 5분간 3회 세척하였다. 세포질 분획 내에서의 MAPK pathways를 확인하기 위해서 EPK1/2, p38, JNK의 primary antibody (New England Biolab, USA)를 실온에서 1시간처리하고 TBST 용액으로 10분간 3회 세 척하고 horseradish peroxidase(HRP) conjugated anti-mouse IgG antibody (New
England Biolab, USA) 또는 anti-rabbit IgG antibody(New England Biolab, USA)를 처리하여 실온에서 40분간 반응시킨 후 TBST 용액으로 10분간 3회 세 척하였다. 결과를 확인하기 위해 chemiluminescence 기질액인 sloution Ⅰ과 solution Ⅱ(Amersham Pharmacia Biotech, UK)를 동량 섞어 nitrocellulose paper 에 1분간 처리한 후 cassette(Kodak, USA)내에서 X-ray film(Amersham Pharmacia Biotech, UK)에 5분간 노출시키고 암실에서 현상액에 1분간 담근 후 현상하였다.
제 3 장 결 과
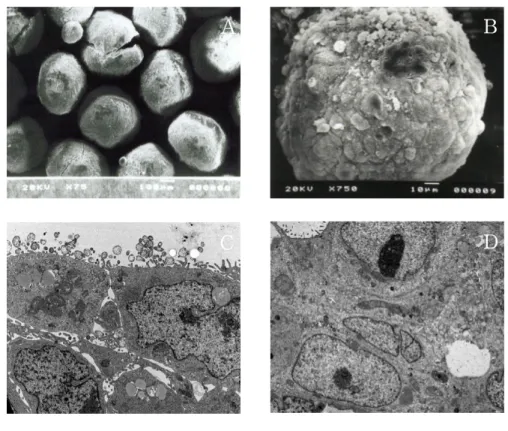
1. 전자현미경을 이용한 HT-29 spheroid 세포의 관찰
완전한 spheroid 세포를 얻기까지는 보통 3일 정도가 소요되며 이런 과정을 통해서 얻은 것을 주사현미경을 통하여 관찰한 결과 1 ㎜ 정도의 in vivo의 암형 태의 spheroid 세포를 생성하였음을 알 수 있었다. 또한 그 spheroid 세포는 많은 단층세포들이 집적되어 공의 형태를 이룬 작은 spheroid 세포들의 집합체라는 것 을 확인할 수 있었다. 각각의 작은 spheroid 세포들은 그 크기와 형태는 대개 유 사하였다. 그리고 조직에서 볼 수 있는 세포간의 연접부(juction)처럼 spheroid 세 포에서도 세포와 세포들간에는 접촉이 잘된 조직의 모습으로 관찰되었다 (Figure 1-A, B). 또한 투사전자현미경을 이용한 관찰에서 spheroid 세포의 중심부와 주변부가 성장분화의 차이에 의해 형태적으로 다양한 세포들이 분포되어 있어 조직과 유사 한 구조를 나타냈으며, 세포안의 구조물들은 정상적으로 잘 발달된 형태를 나타냈 다. 또한 핵의 상태를 관찰한 결과 세포의 분화가 정상적으로 잘 이루어진 것을 알 수 있었고, 세포와 세포간의 연접부(juction)도 정상적으로 이루어져 전체적인 형태는 조직에서 나타나는 특징과 유사하게 나타났다 (Figure 1-C, D).Figure 1. Scanning electron micrographs(A,B) and Transmission
electron micrographs(C,D) of HT-29 spheroid cells. A(x75),
B(x750), C(x6,000), D(x6,000)
A
B
C
D
2. DNA fragmentation analysis
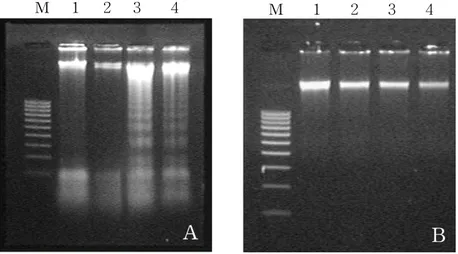
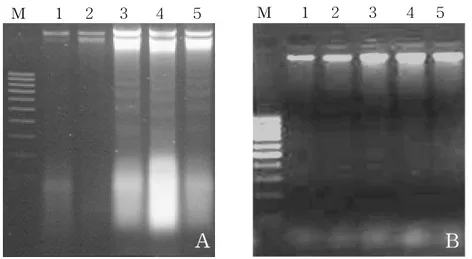
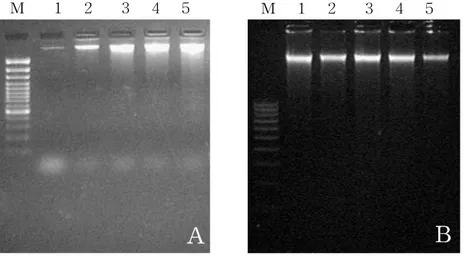
HT-29 spheroid 세포에서 arsenic trioxide와 taxol이 apoptosis를 유도하는지 의 여부를 HT-29 단층세포에서의 결과와 비교하고자 세포에 arsenic trioxide를 5 μM, 10 μM, 20 μM, 30 μM의 농도로 처리하고, taxol을 50 nM, 100 nM, 200 nM, 400 nM의 농도로 처리하였다. 또한 병행처리시에는 arsenic trioxide 20 μM에 taxol을 50 nM, 100 nM, 200 nM, 400 nM의 농도로 처리하였다. 처리후 48시간후 에 DNA를 분리하여 1.8% agarose gel electrophoresis를 실시하여 DNA 분절을 확인하였다. Arsenic trioxide를 처리한 단층세포에서는 10 μM의 농도에서부터 DNA의 분절이 보였으나 spheroid 세포의 경우는 처리군의 가장 높은 농도인 30 μM에서도 DNA의 분절이 보이지 않았다(Figure 2). 또한 taxol을 처리한 단층세 포에서는 100 nM의 농도에서부터 DNA 분절이 보였으나 spheroid 세포의 경우는 미약한 DNA 분절 형태를 관찰할 수 있었다(Figure 3). 그리고 두 약제를 동시에 처리한 경우에서는 단층세포의 경우 taxol만 처리한 것에 비해서 그 DNA 분절의 성향이 많이 감소하는 것을 나타내었고 spheroid 세포의 경우에서는 DNA 분절형 태를 관찰할 수 없었다(Figure 4).
Figure 2. Analysis of DNA fragmentation on HT-29 monolayer cells (A) and HT-29 spheroid cells (B) treated with arsenic trioxide for 48 h. lane M, DNA 100 bp marker ; lane 1, control ; lane 2, 10 μM arsenic trioxide ; lane 3, 20 μM arsenic trioxide ; lane 4, 30 μ M arsenic trioxide. M 1 2 3 4
A
M 1 2 3 4B
B
M 1 2 3 4 5 M 1 2 3 4 5
A
B
Figure 3. Analysis of DNA fragmentation on HT-29 monolayer cells (A) and HT-29 spheroid cells (B) treated with taxol for 48 h. lane M, DNA 100 bp marker ; lane 1, control ; lane 2, 50 nM taxol ; lane 3, 100 nM taxol ; lane 4, 200 nM taxol ; lane 5, 400 nM taxol.
M 1 2 3 4 5 M 1 2 3 4 5
A
B
Figure 4. Analysis of DNA fragmentation on HT-29 monolayer cells(A) and HT-29 spheroid cells(B) treated with the combination of arsenic trioxide and taxol for 48h. lane M, 100 bp DNA marker ; lane 1, control ; lane 2, 20 μM arsenic trioxide and 50 nM taxol, lane 3, 20 μM arsenic trioxide and 100 nM taxol ; lane 4, 20 μM arsenic trioxide and 200 nM taxol ; lane 5, 20 μM arsenic trioxide and 400 nM taxol.
3. HT-29 monolayer cells과 spheroid cells에서의 taxol
과 arsenic trioxide의 세포독성능시험
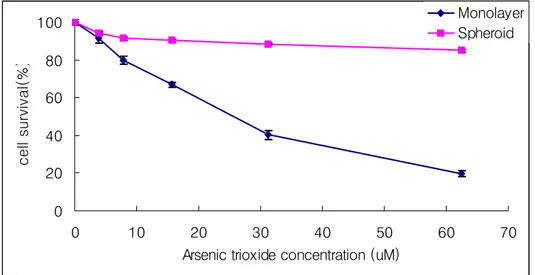
HT-29 spheroid 세포에서 나타나는 세포 독성능을 측정하기 전에, 먼저 premix WST-1 solution(Takara, Japan)을 이용한 세포독성능 시험의 안정성 및 생존 세포수를 잘 반영하는지 알아보기 위해 이미 알고 있는 세포수와 측정된 흡 광도 사이의 관계를 확인하였다. Tryphan blue exclusion법을 통해 확인된 생존 세포들을 96 well 미세 배양판에 well당 1.25 × 104, 2.5 × 104, 5 × 104, 1 × 105, 2 × 105, 4 × 105 개의 세포를 분주한 뒤, premix WST-1 solution을 처리하여 흡광 도를 측정하였다. 측정된 흡광도와 세포 수 사이의 표준 곡선을 구하였는데, 측정 범위 내에서는 정비례 관계를 나타내어, 생존 세포수가 잘 반영됨을 알 수 있었다. 이러한 실험 결과를 토대로 1 × 104개를 분주하여 형성된 96 well 미세 배양판의 spheroid에 taxol과 arsenic trioxide의 각각과 병행처리를 단층세포배양시와 동일 한 농도별로 처리한 후 48시간이 경과한 뒤에 premix WST-1 solution을 처리하 여 490 nm에서 흡광도를 측정하고 이를 % survival로 환산하여 나타냈다. 그 결 과 taxol의 경우에는 단층세포에선 18 nM의 IC50값을 나타내었지만 spheroid 세포
에선 단층세포보다 약제에 대한 저항성이 현저하게 증가함을 확인하였다(Figure 5). 또한 arsenic trioxide의 경우에는 단층세포에서 33 uM의 IC50 값을 나타내지만
taxol의 경우와 같이 spheroid 세포에서 단층세포보다 약제에 대한 저항성이 현저 하게 증가함을 확인하였다(Figure 6). 그리고 병행처리시에는 단층세포에서 길항 작용(antagonic effect)를 나타냈지만 spheroid 세포에서는 taxol만 처리한 실험군 과의 주목할 만한 차이점을 찾을수가 없었다(Figure 7).
Figure 5. Cytotoxic effects of taxol on the monolayer and the spheroid of HT-29 cells. The cells were incubated with indicated concentraton of taxol for 48h.
0 20 40 60 80 100 0 5 10 15 20 25 30 Taxol concentration (nM) c e ll s u rv iv a l( % ) Monolayer Spheroid
Figure 6. Cytotoxic effects of arsenic trioxide on the monolayer and spheroid of HT-29 cells. The cells were incubated with indicated concentraton of arsenic trioxide for 48h.
0 20 40 60 80 100 0 10 20 30 40 50 60 70
Arsenic trioxide concentration (uM)
c e ll sur viv a l(% ) Monolayer Spheroid
Figure 7. Cytotoxic effects of 20 uM arseinc trioxide with various concentration of taxol in HT-29 monolayer cells (A) and the spheroid cells (B). The cells were incubated with indicated concentraton of taxol for 48h.
0 20 40 60 80 100 0 5 10 15 20 25 30 Drug concentration(nM) c e ll s u rvi val( % ) = =
A
Taxol As2O3+Taxol 0 20 40 60 80 100 0 5 10 15 20 25 30 Drug concentration(nM) c e ll s u rvi val( % ) = =B
Taxol As2O3+Taxol4. DAPI stain을 통한 HT-29 spheroid 세포의 핵염색
48 well microplate에서 배양된 spheroid 세포를 동결박절하여 DAPI stain을 통해서 형광현미경으로 관찰한 결과 형광이 spheroid 세포의 내부에서는 보이지 않고 표면부분에서만 관찰되었다(Figure 8). 이 결과를 통해서 DAPI 분자가 spheroid 세포의 내부로는 침투되지 못하였다는 것을 추측할 수 있었다.
A
B
Figure 8. DAPI staining of HT-29 spheroid cells. The spheroid cells were fixed and stained with DAPI and viewed by light (A) and epifluorescence (B) microscopy under 400 × magnification.
5. MAP Kinase(Mitogen-activated protein kinase)의
활성확인
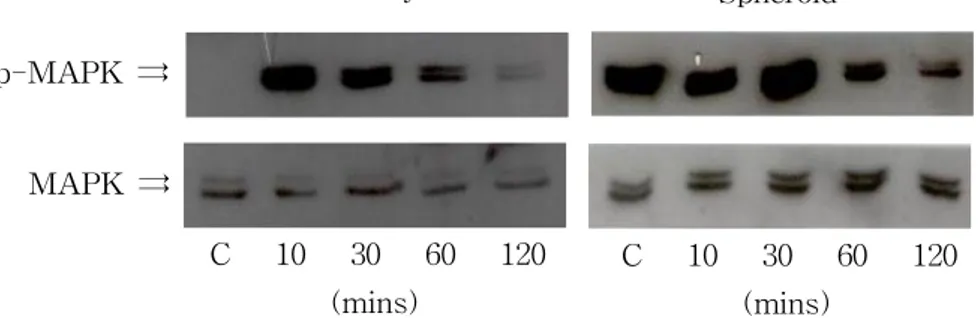
HT-29 monolayer와 spheroid 세포에서의 taxol과 arsenic trioxide에 의한 MAPK의 활성을 확인하였다. 먼저 100 nM taxol을 처리한 경우에는 monolayer와 spheroid 세포에서 모두 ERK1/2가 점차로 활성을 나타내어 30분을 기점으로 그 활성이 감소하는 것으로 나타났다(Figure 9). 그리고 20 μM arsenic trioxide를 처 리한 경우에는 monolayer 세포에서는 10분에서 최대활성을 나타내고 점차 감소하 는 것으로 나타났으며 spheroid 세포에서는 30분에서 최대 활성을 나타내고 점차 로 감소하는 것으로 나타났다(Figure 10). 마지막으로 100 nM taxol과 20 μM arsenic trioxide를 병행처리한 군에서도 역시 monolayer 세포에서는 10분에서 최 대활성을 나타내고 점차 감소하는 것으로 나타났으며 spheroid 세포에서는 30분에 서 최대활성을 나타내고 점차 감소하는 것으로 나타났다(Figure 11). 그리고 모든 처리군에서 p38과 JNK는 활성을 나타내지 않았다(data not shown).
C 10 30 60 120 (mins) p-MAPK ⇉ MAPK ⇉ Monolayer Spheroid C 10 30 60 120 (mins)
Figure 9. Immunoblotting analysis of ERK1/2 activation by taxol on the monolayer and the spheroid HT-29 cells. HT-29 cells were treated with 100 nM taxol.
p-MAPK ⇉ MAPK ⇉ Monolayer Spheroid C 10 30 60 120 (mins) C 10 30 60 120 (mins)
Figure 10. Immunoblotting analysis of ERK1/2 activation by arsenic trioxide on the monolayer and the spheroid HT-29 cells. HT-29 cells were treated with 20 μM arsenic trioxide.
p-MAPK ⇉ MAPK ⇉ C 10 30 60 120 (mins) C 10 30 60 120 (mins)
Figure 11. Immunoblotting analysis of ERK1/2 activation by arsenic trioxide and taxol on the monolayer and the spheroid HT-29 cells. HT-29 cells were treated with the combination of 20 μ M arsenic trioxide and 100 nM taxol.
Monolayer Spheroid
제 4 장 고 찰
최근 항암제에 내성을 나타내는 종양에 대하여 효과적인 항암작용을 나타낼 수 있도록 서로 다른 표적을 갖는 여러 종류의 항암제를 병행사용함으로써 부가 적 또는 상승 작용을 기대하는 연구들과 비슷한 작용기전을 갖는 약제들의 복합 처방에 의한 치료효과에 대해서도 연구중이다(46-50). 이에 본 연구에서는 최근들 어 우리나라에서 증가추세를 보이는 대장암세포주인 HT-29 cell line에 항암효과 가 탁월하다고 알려진 taxol에 arsenic trioxide를 복합처방하였을때 나타나는 효과 에 대해서 연구를 하게 되었다. 그 결과 일반적으로 알려진 것과 같이 각각의 약 제는 HT-29 human colorectal cancer cell에서 세포독성효과를 나타냈지만 두 약 제를 복합처방하였을때는 약제의 세포독성효과가 감소함을 확인할 수 있었다. 그러나 NCI에서 질환의 유형에 맞춘 새로운 체외 검사 방법을 초기암 선별에 적용하기 위해서 폐종양, 대장암, 유방암, 전립선암, 난소암, 신장암, 뇌종양 등에서 유래한 60가지 세포주 pannel을 만들었다. 그리고 이들에 대한 항암효과를 알아보 고자 실험을 하였고 고형암에 대해 실시한 실험에서의 결과들은 항상성을 나타내 지 않았다(1). 실제로 체외 단층세포 배양방법에서의 세포의 성장 생리와 세포간 의 연결이 유사하게 나타났더라도, 배양 세포는 이차원적 구조이지 고형암의 3차 원적 구조가 아니다. 또한 단층세포배양은 종양조직이 가지고 있는 특유의 구조와 이질적인 성질을 나타낼 수는 없다. 그래서 좀 더 고형암에 가까운 모델을 만들기 위하여 collagen-gel 배양, mash-supported organoid 배양(histoculture), multicellular spheroid 배양 등의 3차원적 특성을 나타내는 세포배양 모델이 개발 되었다(9-14). Collagen-gel 배양과 mash-supported organoid 배양은 세포를 지지 체에 포매시켜서 배양하는 반면에 multicellular spheroid 배양의 경우는 지지체없 이 일정한 회전운동에 의한 세포들의 집적만으로도 3차원적 특성을 가지게 할 수 있어 본 연구에서는 multicellular spheroid 배양법을 사용하여 3차원적 특성을 가 지는 spheroid 세포을 얻었다. 배양된 spheroid 세포를 SEM을 이용하여 관찰한결과 형성된 spheroid 세포는 직경이 1 mm에 이르는 크기의 구상체 형태이었으 며 이것은 내부에 더 작은 spheroid 세포들로 이루어져 있었다. 가장 작은 크기의 spheroid 세포들은 수많은 단층세포들로 구성되었음을 확인할 수 있었다. 또한 TEM을 이용하여 spheroid 세포의 내부를 관찰한 결과 spheroid 세포의 내부는 일반 조직에서 볼 수 있는 형태와 유사한 구조를 확인할 수 있었다. 이러한 관찰 결과를 통해서 spheroid 세포가 고형암에 대한 항암제의 효과연구에 사용될 수 있 는 실험적 모델로써의 가능성도 확인할 수 있었다.
Taxol과 arsenic trioxide에 의한 apoptosis 유발여부의 실험결과는 단층세포 에서 강하게 apoptosis를 유발했던 농도에서 조차도 spheroid 세포에서는 apoptosis가 유발되지 않는 것으로 나타났다. 또한 약제에 대한 세포독성능검사 결 과 역시 단층세포에서의 IC50 값인 18 nM 이상의 taxol과 33 μM 이상의 arsenic
trioxide를 처리하였을때 조차도 spheroid 세포가 80%이상이 생존하는 것으로 나 타났다. 즉, HT-29 human colorectal cancer cell의 경우 단층세포에 비해서 spheroid 세포가 두 약제에 대해서 월등히 높은 저항성을 나타냄을 확인하였다. 이러한 높은 저항성은 고형암내로의 약제의 침투가 용이하지 않기때문이라는 보 고가 있었고(51) 이에 본 연구에서는 약제의 spheroid 세포내로의 침투여부를 확 인하고자 457.5 Dalton 크기의 DAPI 분자를 이용한 형광현미경 관찰을 시행하였 다. 관찰한 결과 형광이 spheroid 세포의 내부에서는 보이지 않고 바깥부위에서만 나타나는 결과를 얻었다. 즉, DAPI 분자가 spheroid 세포의 내부로는 이동되지 못 하였다는 것이다. 이 결과로부터 DAPI 분자에 비해서 상대적으로 크기가 큰 약제 가 spheroid 세포내로의 이동이 쉽지 않음을 간접적으로 확인할 수 있었다. 그리 고 이것이 spheroid 세포가 단층세포보다 더 높은 약제에 대한 저항성을 갖게되는 요인중의 하나라고 추측을 할 수 있었다. 또한 두 약제의 병행처리시 세포독성능 실험결과는 단층세포에서는 각각의 약제가 나타내는 독성을 감소시키는 결과를 나타내었고, spheroid 세포에서는 각 각의 약제가 나타내는 세포독성이 단층세포보다 현저히 떨어져 병행처리시 나타 나는 변화를 관찰할 수 없었다. Spheroid 세포의 경우는 90% 이상의 생존률을 나 타내어 단층세포와 같은 농도에서는 변화를 관찰하기 어려웠다.
HT-29 human colorectal cancer에서 taxol과 arsenic trioxide에 의한 MAP kinase pathway의 활성을 확인한 결과 monolayer 세포와 spheroid 세포 모두에서 ERK1/2의 활성을 관찰할 수 있었다. 그 활성이 10분부터 나타나서 30분에 최대 활성을 나타내다가 점차로 감소하는 성향을 나타내었다. 그러나 p38과 JNK의 경 우는 활성을 나타내지 않았다. 특이하게도 spheroid 세포에서는 control에서도 ERK1/2의 활성이 관찰되었다. 이것은 spheroid 세포를 형성하는 과정에서 영양분 고갈로 인해서 spheroid 세포에 스트레스를 주게되어 ERK1/2를 활성시킨것으로 생각된다.
이상의 결과를 통해서 HT-29 human colorectal cancer의 단층세포에서와 고 형암의 특성에 더욱 근접한 spheroid 세포에서의 동일한 실험의 결과가 많은 부분 에서 차이가 나타남을 알 수 있었다. 즉 in vitro 상태에서 단층세포로 실험한 결 과를 in vivo 상태의 고형암에 직접적으로 적용하는데는 문제가 있음을 알 수 있 었다. 따라서 고형암에 대한 항암제의 효과를 연구하기 위해서는 좀 더 in vivo 상태의 고형암의 특성에 근접한 실험모델이 필요하다는 결론을 얻었고 이 실험모 델로서 spheroid 세포를 사용 할 수 있다는 가능성을 확인하였다. 또 DAPI 분자를 이용한 형광현미경 관찰을 통해 얻어진 결과에서 약제의 고 형암내로의 침투가 용이하지 못함이 약제에 대한 내성을 증가시킨다는 추측을 확 인하는 실험이 앞으로 진행되어져야 할 것이다. 또한 이런 차이가 세포신호전달체 계에서 어떤 차이를 나타내는가를 알아보는 실험도 진행되어야 할 것이다.
제 5 장 결 론
HT-29 human colorectal cancer cell의 단층세포에 대한 taxol과 arsenic trioxide의 항암효과를 확인하였고, in vivo 상태의 고형암과 유사한 형태인 spheroid cells을 형성하여 단층세포에서와 동일한 실험을 진행하여 in vitro 상태 의 단층세포에서 얻어진 결과를 in vivo 상태에 적용가능성을 알아보고자 하였다. 모든 조건은 이전의 단층세포에서의 실험과 동일하게 진행하였다. 이 실험을 통해 서 다음과 같은 결론을 얻었다.
1. Spheroid cells을 형성하여 TEM과 SEM을 통해서 형성된 spheroid cells이 in vivo상의 조직과 유사한 구조를 가짐을 확인하였다.
2. DNA 분절능 분석을 통해서 단층세포에서 taxol과 arsenic trioxide에 의한 apoptosis 유발을 확인하였고, 두 약제의 병행처리시 apoptosis 유발이 감 소함을 확인하였다. 그리고 spheroid cells에선 약제에 의한 DNA 분절이 일어나지 않음을 확인하였다.
3. HT-29 human colorectal cancer cell의 단층세포와 spheroid cells에서 두 약제에 대한 세포독성능 검사를 하여 단층세포에 비해서 spheroid cells에서 약제에 대한 저항성이 증가함을 확인하였고, 병용처리시 단층세포에서 antagonic effect를 나타냄을 알 수 있었다.
4. spheroid cells을 동결박절을 하여 DAPI stain으로 핵을 염색하여 형광현 미경으로 관찰하여 형광이 spheroid cells의 바깥부위에서만 관찰됨을 확인 하였다.
5. Taxol과 arsenic trioxide를 처리한후 10분, 30분, 60분, 120분에서 세포내의 MAP kinase가 활성화되는 것을 관찰한 결과 monolayer 세포와 spheroid 세포에서 모두 ERK1/2가 10분에서부터 활성화 되어 30분을 정점으로 점차 활성이 감소하는 것을 확인하였다.
위의 실험 결과로 볼 때, HT-29 human colorectal cancer cell의 단층세포에 선 taxol과 arsenic trioxide 각각은 세포독성효과를 나타내지만 둘을 병행처리하였 을때는 세포독성효과가 감소함을 확인할 수 있었다. 또한 spheroid 세포를 이용한 실험을 통해서 단층세포에서 나타난 각 약제의 세포독성효과가 현저하게 줄어드 는 것을 확인할 수 있었다. 그리고 DAPI stain을 통한 spheroid 세포의 핵을 염색 한 결과를 통해서 각 약제에 대한 저항성이 약제의 spheroid 세포 내부로의 침투 저해에 의한 것이라는 추측을 할 수 있었다.
이상의 결과를 통해서 고형암의 형태를 가지는 HT-29 human colorectal cancar cell의 경우는 단층세포와 spheroid 세포간에 세포독성효과가 크게 차이가 있음을 확인하였고, arsenic trioxide가 taxol의 효과에 길항작용을 나타냄을 알 수 있었다.
참 고 문 헌
1. Jiang S. Encyclopedia of chinese medecine. Shangia, China:Scientific
Publishing House,1986.p.1620-1622.
2. Dai J, Weinberg RS, Waxman S, Jing Y. Maoignant cells can be sensitized to undergo growth inhibition of the glutathione redox system. Blood
1999;93:268-277.
3. Shen ZX, Chen GQ, Ni JH, Li XS , Xiong SM, Qiu QY, Zhu J, Tang W, Sun GL, Yang KQ, Chen Y, Zhou L, Fang ZW, Wang YT, Ma J, Zang P, Zhang TD, Chen SJ, Chen Z, Wang ZY, Use of arsenic trioxide (As₂O₃) in the treatment of acute promyelocic leukemia(APL): Ⅱ Clinical efficacy and pharmacokinetics in relapsed patients. Blood 1997;89:3354-3360.
4. Shao W, Fanelli M, Ferrara FF, Riccioni R, Rosenauer A, Davison K, Lamph WW, Waxman S, Pelicci PG, Lo coco F, Avvisati G, Testa U, Peschle C, Gambacorti-Passerini C, Nervi C, Miller Jr.WH. Arsenic trioxide as an inducer of apoptosis and loss of PML/RARα protein in acute promyelocytic leukemia cells. J Natl Cancer Inst 1998;90:124-133.
5. Wang ZG, Rivi R, Delva L, Konig A, Scheinberg DA, Gambacorti-Paxxerini C, Garbrilove JL, Warrell RP, Pandolfi PP. Arsenic trioxide and melarsoprol induce programmed cell death in myeloid lerkemia cell lines and function in a PML and PML-RARα independent manner. Blood 1998;92:1497-1504.
6. Shen ZY, Shen J, Cai WJ, Hong C, Zheng MH. The alteration of mitochodrias is an early event of arsenic trioxide induced apoptosis in esophageal carcinoma cells. Int J Mol Med 2000;5:155-158.
7. Ora I, Bondesson L, Jonsson C, Ljungberg J, Porn-Ares I, Garwicz S, Pahlman S. Arsenic trioxide inhibits neuroblastoma growth in vivo and promotes apoptotic cell death in vivo. Biochem Biophys Res Commun
2000;277:179-185.
8. Huang SC, Huang CY, Lee TC. Induction of mitosis-mediated apoptosis by sodium arsenite in HeLa S3 cells. Biochem Pharmacol 2000;60:771-780.
9. Uslu R, Sanli UA, Sezgin C, Karabulut B, Terzioglu E, Omay SB, Goker E. Arsenic trioxide-mediated cytotoxicity and apoptosis in prostate and pvarian carcinoma cell lines. Clin Cancer Res 2000;6:4957-4964.
10. Larochette N, Decaudin D, Jacotot E, Brenner C, Marzo I, Susin SA, Zamzami N, Xie Z, Reed JC, Kroemer G. Arsenite induces apoptosis via a direct effect on the mitochondrial permeability tranaition pore. Exp Cell Res 1999;249:413-421.
11. Chen GQ, Zhu J, Shi XG, Ni JH, Zhong HJ, Si GY ,Jin XL, Tang W, Li XS ,Xong SM ,Shen ZX, Sun GL, Ma J, Zhang TD, Gazin C, Naoe T, Chen SJ, Wang ZY, Chen Z, In vitro studies and cellular mechanisms of arsenic trioxide (As₂O₃) in the treatment of acute promyelocytic leukemia: As₂O₃ induces NB₄cell apoptosis with downregulation of BCI-2 expression and modulation of PMLRARα/PML proteins. Blood 1996;88:1052-1061.
12. Hoffman RD, Lane MD. Iodophenylarsine oxide and arsenical affinity chromatogarphy: new probes for dithoil proteims. Application to tubulins and to components of the insulin receptor -glucose transporter signal transdution pathway. J Biol Chem 1992;267:14005-14011.
13. Park WH, Seol JG, Kim ES, Hyun JM, Jung CW Lee CC, Kim BK, Lee YY. Arsenic trioxide-mediated growth inhibition in MC/CAR myeloma cells via cell cycle arrest in association with indution of cyclin-dependent kinase inhibitor, p21, and apoptosis. Cancer Res 2000;60:3065-3071.
14. Ochi T. Induction of centrosome injury, multipolar spindles and multipolar division in cultured V79 cells exposed to dimethylarsinic acid: role for microtubules in centrosome dynamics. Mutat Res 2000;454:21-33.
15. Chen F, Lu Y, Zhang Z, Vallyathan V, Ding M, Castranova V, Shi X. Opposite effect of NF-kappa B and c-Jun N-terminal kinase on p53- independent GADD45 induction by arsenite. J Biol Chem 2001;276:1414-1419.
16. Fracasso PM, Brady MF, Moore DH, Walker JL, Rose PG, Letvake L, Grogan TM, McGuire WP. Phase Ⅱ study of paclitaxel and valspodar(psc 833) in refractory ovarian carcinoma: a gynecologic oncology group study. J Clin
Oncol 2001;19:2975-2982.
17. Nabholtz JM, Slamon D. New adjuvant strategies for breast cancer: meeting the challenger of integrating chemotherapy and trastuzumab (Herceptin). Semin Oncol 2001;28:1-12.
1995;332:1004-1014.
19. Jordan, M. A., Toso, R. J., Thrower, D. and Wilson, L. Mechanism of mitotic block and inhibition of cell proliferation by taxol at low concentrations.
Proc. Natl. Acad. Sci. USA. 1993;90:9552-9556.
20. Lopes, N. M., Adams, E. G., Pitts, T. W., and Bhuyan, B. K. Cell kill kinetics and cell cycle effects of taxol on human and hamster ovarian cell line.
Cancer Chemother. Phromacol., 19933;2: 235-242.
21. Bhalla, K., Ilerado, A. M., Tourkina, E., Tang, C., Mahoney, M. E. and Huang, Y. Taxol induces internucleosomal DNA fragmentation associated with programmed cell death in human myeloid leukemia cells. Leukemia(Baltimore) 19937;:563-568.
22. Long, M. H. and Fairchild, C. R. Paclitaxel inhibits progression of mitotic cells to G1 phase by interference with spindle formation without affecting other microtubule functions during anaphase and telophase. Cancer Res.,
19945;4:4355-4361.
23. Milas, L., Hunter, N. R., Kurdoglu, B., Mason, K. A., Meyn, R., Stephene, L. C. and Peter, L. J. Kinetics of mitotic arrest and apoptosis in murine mammary and ovarian tumors treated with taxol. Cancer Chemother.
Pharmacol., 19953;5:297-303.
24. Rieder, C., Schuitz, A., Cote, R. and Sluder, G. Anaphase onset in vertebrate somatic cells is controlled by a checkpoint that monitor sister kinetochore attachment to the spindle. J. Cell. Biol., 19941;27:1304-1310.
25. Derry, W. B., Wilson, L. and Jordan, M. A. Stoichiometric binding of taxol suppresses microtubule dynamics. Biochemistry. 19953;4:2203-2211.
26. Klauber, N., Parangi, S., Flynn, E., Hamel, E., and D'Amato, R.J. Inhibition of angiogenesis and breast cancer in mice by the microtubule inhibitors 2-methoxyestradiol and taxol. Cancer Res. 1997;57: 81-86.
27. Hornback, N. B., Shen, R. N., Sutton, G. P. Shidnia, H. and Kaiser, H. E. Synergistic cytotoxic and antitumor effects of irradiation and taxol on human HeLa cervix carcinoma and mouse B16 melanoma cells. In Vivo 1994;8:819-823.
28. Hennequin, C., Giocanti, N. and Favaudon, V. Interaction of ionizing radiation with paclitaxel(Taxol) and docitaxel(Taxorate) in HeLa and SQ20B cells. Cancer Res 1996;56:1842-1850.
29. Pulkkinen, J. O., Pekkola-Heino, K. and Grenman, R. Paclitaxel and irradiation induce apoptosis in squamous cell carcinoma cell lines in an additive way. Anticancer Res 1996;16:2923-2929.
30. Mason, K. A., Milas, L. and Peters, L. J. Effect of paclitaxel(taxol) alone and in combination with radiation on the gastrointestinal mucosa. Int J Radiat.
Oncol. Biol. Phys. 1995;32:1381-1389.
31. Andre'N Braguer D, Brasseur G, Goncalves A, Lemesle-Meunier D, Guise S, Jordan MA, Briand C, Paclitaxel induces release of cytochrome c from mitochondria isolated from human neuroblastoma cells. Cancer Res
32. Chen YC, Lin-Shiau SY, Lin JK. Involvement of reactive oxygen species and caspase 3 activation in arsenic-induced apoptosis. J Cell Physiol
1998;177:324-333.
33. Jiang S. Encyclopedia of chinese medecine. Shangia, China:Scientific
Publishing House,1986.p.1620-2
34. Shen ZX, Chen GQ, Ni JH, Li XS , Xiong SM, Qiu QY, Zhu J, Tang W, Sun GL, Yang KQ, Chen Y, Zhou L, Fang ZW, Wang YT, Ma J, Zang P, Zhang TD, Chen SJ, Chen Z, Wang ZY, Use of arsenic trioxide (As₂O₃) in the treatment of acute promyelocic leukemia(APL): Ⅱ Clinical efficacy and pharmacokinetics in relapsed patients. Blood 1997;89:3354-3360.
35. Huang SC, Huang CY, Lee TC. Induction of mitosis-mediated apoptosis by sodium arsenite in HeLa S3 cells. Biochem Pharmacol 2000;60:771-780.
36. Larochette N, Decaudin D, Jacotot E, Brenner C, Marzo I, Susin SA, Zamzami N, Xie Z, Reed JC, Kroemer G. Arsenite induces apoptosis via a direct effect on the mitochondrial permeability tranaition pore. Exp Cell Res 1999;249:413-421.
37. Ribeiro, J. M. and Carson, D. A. Ca2+/Mg2+-Dependent endonuclease from human spleen: purification, properties, and role in apoptosis. Biochemistry 19933;2:9129-9136.
38. McConkey, D. J., Orrenius, S. and Jondal, M. Agents that elevate cAMP stimulate DNA fragmentation in thymocytes. J. Immunol. 1990;145:1227-1230.
39. Champoux, J. J. and Aronoff, R. The effect of camptothecin on the reaction and the specificity of the wheat germ type Ⅰ topoisomerase. J. Biol. Chem. 1989;264:1010-1015.
40. Fukasawa, K., Komatani, H., Hara, Y., Suda, H., Okura, A., Nishimura, S. and Yoshinari, T. Sequence-selective DNA cleavage by a topoisomerase Ⅰ poison, NB-506. Int. J. Cancer. 1998;75:145-150.
41. Yoon, Y. S., Kim, J. W., Kang, K. W., Kim, Y. S., Choi, K. H. and Joe, C. O. Poly(ADP-ribosyl)ation of Histone H1 correlates with internucleosomal DNA fragmentation during apoptosis. J. Biol. Chem. 271:9129-9134, 1996.
42. Wolf, B. B. and Green, D. R. Suicidal tendencies: apopotic cell death by caspase family proteinases. J. Biol. Chem. 1999;274:20049-20052.
43. Wyllie, A. H., Kerr, J. F. R. and Currie, A. R. Cell death: the significance of apoptosis. Int. Rev. Cytol. 1980;68:251-306.
44. Allen, T. D. Ultrastructural aspects of cell death. In perspective on mammalian cell death. Oxford University Press. Oxford. 1987.p.35-65.
45. Kerr, J. F. R., Searle, J. and Harmon, B. V. Apoptosis. In perspective on mammalian cell death. Oxford University Press. Oxford. 1987.p.93.
46. Carles G, Braguer D, Sabeur G, Briand C. The effect of combining antitubulin agents on differentiated and undifferentiated human colon cancer cells. Anti-Canecer Drugs 1998;9:209-221.
47. Fracasso PM, Brady MF, Moore DH, Walker JL, Rose PG, Letvake L, Grogan TM, McGuire WP. Phase Ⅱstudy of paclitaxel and valspodar(psc 833) in refractory ovarian carcinoma: a gynecologic oncology group study. J Clin
Oncol 2001;19:2975-2982.
48. Nabholtz JM, Slamon D. New adjuvant strategies for breast cancer: meeting the challenger of integrating chemotherapy and trastuzumab (Herceptin). Semin Oncol 2001;28:1-12.
49. Kohn EC, Reed E, Sarosy GA, Minasian L, Bauer KS, Bostick Bruton F, Kulpa V, Fuse E, Tompkins A, Noone M, Goldspiel B, Pluda J, Figg WD, Liotta LAA. Phase I trial of carboxylamido triazole and paclitaxel for relapsed solid tumors: potrntial efficacy of the combination and demonstration of pharmacokinetic interaction. Clin Cancer Res 2001;7:1600-1609.
50. Manon Carre, Gerard Carles, Nicolas Andre, Soazig Douillard, Joseph Ciccolini, Claudette Briand, Diane Braguer. Involvement of microtules and mitochondria in the antagonism of arsenic trioxide on paclitaxel-induced apoptosis. Biochemical phamacology 2002;63:1831-1842.
51. K.M. Nicholson, M.C. Bibby, R.M. Philips. Influence of drug exposure parameters on the activity of paclitaxel in mulicellular spheroids. European
Abstract
The effect of taxol and arsenic trioxide
on HT-29 spheroid cell
Lee, In Soo Dept. of Biomedical Laboratory Science
The Graduate School Yonsei University
Human colon cancer is the second most fatal disease among a variety of cancers to cause death in U.S.A. and its incidence rate is currently increased in Korea. Recently, many studies have been being progressed on the efficacy of diverse combination treatments. But results of these in vitro studies were not similar to those of in vivo.
we compared the anticancer activities of arsenic trioxide and taxol respectively, against human colon cancer HT-29 cell line and combined use of two drugs. And these results compared with those of HT-29 spheroid cells having similar charactericstics to the solid tumor in vivo.
The spheroid of HT-29 cells was formed by using a multicellular spheroid system and the result was observed through electron microscopy. The IC50
value for arsenic trioxide was 33 μM and taxol was 18 nM, which were evaluated in HT-29 monolayer cells. The combinational treatment of taxol and
arsenic trioxide decreased the cytotoxicity on the HT-29 monolayer cells. The spheroid cells represented higher resistance against drugs than the monolayer cells. The DNA fragmentations were appeared after incubation with concentrations more than 10 μM arsenic trioxide and 100 nM taxol for 48 h on the monolayer cells. But the results of HT-29 cell line treated with the combination of taxol and arsenic trioxide were disappeared. And we couldn't observe DNA fragmentation in the case of spheroid cells.
These results suggest that apoptosis was not induced in the combinational treatment, which can be thought that arsenic trioxide might work as an antagonist for a taxol mechanism. And the spheroid cells represented higher resistance against drugs than the monolayer cells.
---Key word : taxol, arsenic trioxide, apoptosis, HT-29 cell line, monolayer, spheroid, antagonism