저작자표시-비영리-변경금지 2.0 대한민국 이용자는 아래의 조건을 따르는 경우에 한하여 자유롭게 l 이 저작물을 복제, 배포, 전송, 전시, 공연 및 방송할 수 있습니다. 다음과 같은 조건을 따라야 합니다: l 귀하는, 이 저작물의 재이용이나 배포의 경우, 이 저작물에 적용된 이용허락조건 을 명확하게 나타내어야 합니다. l 저작권자로부터 별도의 허가를 받으면 이러한 조건들은 적용되지 않습니다. 저작권법에 따른 이용자의 권리는 위의 내용에 의하여 영향을 받지 않습니다. 이것은 이용허락규약(Legal Code)을 이해하기 쉽게 요약한 것입니다. Disclaimer 저작자표시. 귀하는 원저작자를 표시하여야 합니다. 비영리. 귀하는 이 저작물을 영리 목적으로 이용할 수 없습니다. 변경금지. 귀하는 이 저작물을 개작, 변형 또는 가공할 수 없습니다.
의학 박사학위 논문
정도관리물질용 ABO 항원 변형
적혈구의 제조
아 주 대 학 교 대 학 원
의학과/의학전공
강 선 주
정도관리물질용 ABO 항원 변형
적혈구의 제조
지도교수 임 영 애
이 논문을 의학 박사학위 논문으로 제출함.
2017년 8월
아 주 대 학 교 대 학 원
의학과/의학전공
강 선 주
강선주의 의학 박사학위 논문을 인준함.
심사위원장
이 위 교
인
심 사 위 원
임 영 애
인
심 사 위 원
조 성 란
인
심 사 위 원
박 일 중
인
심 사 위 원
허 지 영
인
아 주 대 학 교 대 학 원
2017년 6월 22일
– 국문요약 –
정도관리물질용 ABO 항원 변형 적혈구의 제조
잘못된 혈액형 아형 판정은 환자의 진료에 영향을 주고 검사실 신뢰도를 떨어뜨리는 요인이 될 수 있어 결과에 정확성을 요한다. 혈액형 아형 검사의 정도관리를 위해서는 다양한 항원성을 표현하는 물질이 필요한데 헌혈자나 자원자로부터 얻은 검체를 사용하는 방법은 그 종류와 기회의 제한으로 인하여 아직까지 숙련도 평가나 정도관리에 이용하는데 어려움이 많은 실정이다. 이에 본 연구에서는 인체 유래의 적혈구에 A 형 혹은 B 형의 성상을 가진 각각의 합성 당지질인 Function–Spacer–Lipid (FSL) 구조물을 부착시켜 변형 적혈구 kodecyte 를 제조하고 실제 검사에 사용할 수 있게 하여 정도관리물질로의 활용 가능성을 평가하였다. 여러 농도로 물질을 제조하였고 제조된 변형 적혈구는 혈구 응집법과 유세포 분석법으로 항원성을 측정하고 여러 보존용액에서의 안정성을 평가한 다음 실습 워크숍과 외부정도관리 사업에서 시범 사용하였다. 적혈구 kodecyte 는 시험관법에서 FSL 용액 농도에 따라 w+에서 4+의 응집정도를 보였으며(FSL–A, 0.005 ‒ 0.04 mg/mL; FSL–B, 0.05 ‒ 0.4 mg/mL) 제조농도와 상관없이 항–H lectin 에 4+ 응집을, 항–A1 lectin 에 음성반응을 보였다.
적혈구 kodecyte 의 보관 안정성은 인체 유래 O 형 적혈구와 비슷함을 확인하였다.
실기 워크숍에서 사용한 weak A (Aw) 표현형을 보이는 변형 적혈구는
참가자들에게 3+ 미만의 응집을 경험할 수 있는 기회를 제공하였다. 신빙도
와 weak B (Bw) kodecyte (FSL–B, 0.15 mg/mL 로 제조)를 발송하였는데 응답한 43 개 기관 중 의도한 Aw 형과 Bw형으로 답변한 기관은 각각 15 개(35%), 29 개(67%) 기관이었다. 항–A 단클론항체의 종류는 Aw kodecyte 의 혈액형 판정에 영향을 미쳤다. 결론적으로 FSL 용액과 O 형 적혈구를 이용하여 다양한 항원량을 가지는 A 형과 B 형 아형 표현형 적혈구 제조가 가능하였으며 제조한 물질은 정도관리물질로서의 안정성이 확인되었다. 제조된 kodecyte 는 공여자로부터 얻은 검체를 대신하여 ABO 아형 검사를 시행하는 검사실의 질향상에 큰 도움을 줄 것으로 보인다. 핵심어: ABO 아형, Function–Spacer–Lipid, kodecyte, 정도관리, 신빙도조사
차 례
국문요약 ··· ⅰ 차례 ··· ⅲ 그림 차례 ··· ⅴ 표 차례 ··· ⅵ Ⅰ. 서론 ··· 1 Ⅱ. 연구대상 및 방법 ··· 6 A. 항원 변형 적혈구 제조 ··· 6 1. 제조법 확립 ··· 6 2. 항원량 측정 ··· 9 B. 보존 안정성 평가 ··· 13 C. 제조된 변형 적혈구 활용 ··· 14 D. 분석 방법 ··· 18 Ⅲ. 결과 ··· 19 A. 항원 변형 적혈구 제조 ··· 19 B. 보존 안정성 평가 ··· 21 C. 제조된 변형 적혈구 활용 ··· 23 1. 혈액형 검사 실기 워크숍 ··· 23 2. 외부정도관리 시범 사업 ··· 24 Ⅳ. 고찰 ··· 33 Ⅴ. 결론 ··· 44참고문헌 ··· 45 ABSTRACT ··· 49
그림 차례
Fig. 1. Diagram showing the features of the function–spacer–lipid construct of a kodecyte,
using the analogy of a sunflower ··· 5
Fig. 2. The structures of FSL–A(tri) and FSL–B(tri) ··· 8
Fig. 3. A scattergram of the kodecyte used to quantify A or B antigen levels ··· 12
Fig. 4. Preparation of the quality control materials for proficiency testing ··· 15
Fig. 5. Survey specimens used for external proficiency testing of ABO subgrouping ···· 16
Fig. 6. Relationships between the extent of agglutination by monoclonal antibodies and the working solution concentration ··· 20
Fig. 7. The summed agglutination scores and the supernatant hemoglobin levels in suspension of red blood cell kodecytes over time, according to the type of suspension medium ··· 22
Fig. 8. Histograms showing the A and B antigen levels of kodecytes and natural red blood cells (RBCs) obtained with monoclonal antibodies used in ABO typing. ··· 25
Fig. 9. Kodecytes exhibit mixed–field agglutination. ··· 37
표 차례
Table 1. Interpretation of agglutination reactions ··· 10
Table 2. The lactate dehydrogenase (LD) and potassium (K) levels before and after 7 days of refrigerator storage ··· 27
Table 3. The reports of test result and interpretation of ABO grouping for Aw kodecytes
(n=43) ··· 29
Table 4. The reports of test result and interpretation of ABO grouping for Bw kodecytes
(n=43) ··· 30
Table 5. The reactivities of monoclonal antibodies to survey samples according to the manufacturer (n=43) ··· 31
I. 서 론
적혈구 표면의 A 또는 B 항원의 양이 적게 표현된 혈액형을 ABO 혈액형 아형이라고 한다. ABO 항원은 당사슬로 이루어져 있으며 전이효소의 작용으로 항원성의 차이가 생기는데, 혈액형 아형을 만드는 전이효소는 유전자에 의해 결정되므로(Clausen 등, 1985; Svensson 등, 2005; Daniels 등, 2013) 혈액형 아형의 감별을 위한 유전자 검사를 시행할 수 있다. 그러나 유전자 검사는 검사실에서 일반적으로 시행하기 어렵고 유전형과 표현형이 반드시 일치하는 것도 아니며(Yazer 등, 2008) 여러 대립유전자가 같은 표현형을 나타내거나 같은 대립유전자에서 한가지 이상의 표현형을 나타내기도 하므로(Olsson 등, 2001) 표현형을 결정하는 혈청학적 검사의 결과가 중요하다. ABO 혈액형 판정을 위해 일반적으로 시행하는 혈청학적 검사는 다양한 원인에 의한 항원의 약화, 용혈, 혈장 단백으로 인한 결과 오류 등의 한계점도 있으나 현재까지 모든 검사실에서 시행할 수 있는 가장 간편하고 신속하며 효율적인 검사법이다. 수혈의학 검사실 및 혈액은행에서 시행하는 혈액형 검사는 수혈, 태아/신생아 용혈질환, 친자감별, 장기이식 등 실로 여러 분야에서 그 결과의 정확도가 진료에 큰 영향을 미치는 검사로서, ABO 혈액형 아형이 잘못 판정되는 경우 그 파급효과는 치명적일 수 있다. 이를테면 헌혈자의 ABO 아형이 O 형으로 판독되어 환자에게 수혈되었을 때 항체 생성을 유발하거나 용혈수혈부작용을 초래할 가능성이 있고, 반대로 환자의 ABO 아형이 정상 ABO 혈액형으로 판정되면 혈구형과 혈청형의 혈액형 불일치로 인하여 검사 진행에 어려움이 생기고 나아가 적합 혈액을 찾지 못하여 수혈을 지연시킬 수 있다(오흥범 등, 1993; 황동희 등, 2000; 조덕 등 2006; Moiz
등, 2007; Jung 등, 2015). 또한 이러한 일이 반복되면 검사실을 비롯한 의료기관 자체의 신뢰도마저 떨어뜨리는 요인이 될 수 있기 때문에 검사자의 주의가 필요하다. 수혈의학 검사실에서 발견되는 ABO 아형에 대해서는 혈액형 검사 판독 시의 세심한 관찰로 발견되는 혈구형과 혈청형 결과의 불일치 결과를
바탕으로 항–A1 lectin (Dolichos biflorus) 또는 항–H lectin (Ulex europaeus) 과의
반응성 확인을 통하여 임상적으로 적절한 판단을 내리는 것이 중요하므로 혈액형 검사를 시행하는 검사자의 숙련도 향상 및 혈액형 아형검사의 정도관리를 위하여 다양한 항원성을 표현하는 물질이 필요하다. 현재까지는 이러한 물질이 상품화 되어 있지 않기 때문에 다른 검사항목에 비하여 숙련도 평가가 어렵고 검사의 정확도 평가를 위해서 외부정도관리가 필수적이다. 2012 년부터 매년 대한임상검사정도관리협회 혈액은행분과에서 ABO 아형 혈액형에 대한 실기 워크숍을 시행해 왔으며 외부정도관리 신빙도평가에서 시범항목으로 A1 형과 O 형 적혈구를 이용하여 ABO 아형 감별에 중요한 항– A1 시약과 항–H 시약에 대한 평가 항목을 추가로 시행해오고 있다. 결과분석을 들여다보면, 많은 참가기관이 ABO 아형 검사에 대한 질관리가 요구되고 있으며(임영애 등, 2015) 또한 앞으로도 지속적인 사업 및 교육을 이어 가는 것이 중요하고 이를 위해 ABO 아형 검사를 위한 별도의 다양한 항원성을 가진 물질이 필요함을 알 수 있다. 현재 활용 가능한 ABO 아형 적혈구의 공급책으로는 몇 가지가 있으나 만족스러운 선택은 어려운 실정이다. 먼저 ABO 아형인 헌혈자로부터 유래된 폐기 혈액을 이용하는 방법이 있는데 이 경우 그 절차를 비롯하여 발견 이후
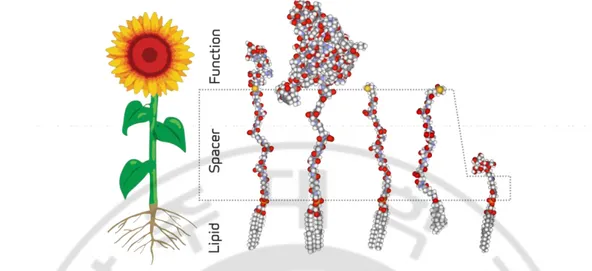
확인된 ABO 혈액형 아형의 빈도는 2002 년 7 월에서 2003 년 2 월까지 대한적십자사 광주전남혈액원에서 보고한 0.114%(Cho 등, 2004)와 2007 년에서 2009 년까지 대학적십자사 중앙혈액검사센터에서 보고한 0.05%(이자영 등, 2010)로 매우 낮음을 알 수 있다. 혹은 공여자로부터 혈액을 얻는 방법을 생각해 볼 수 있으나 실현 가능성이 희박하며 원하는 항원을 선택하기 힘들고 이 방법도 마찬가지로 절차적 어려움이 따른다. 이러한 한계들을 극복하기 위하여 ABO 아형 적혈구를 직접 제조하는 방법이 있는데 이는 혈액형 항원을 변형하여 다른 혈액형에게 수혈이 가능하게 하려는 노력으로부터 출발해왔다. 그 예로 효소를 이용하여 항원 결정기의 당을 변형하거나(Goldstein 등, 1982; Henry 등, 2004; Henry 등, 2005) 혹은 항원 적혈구 막의 단백질을 안정시키고 항원성 감소를 유도하는 방법들이 있다(Scott 등, 1997; Garatty, 2008). 먼저 항원 결정기의 당을 분해하는 방법은 ECO RBC (enzymatically converted O RBC)라고 부르며 B 형 적혈구의 α–linked galactose 를 분해하는 방법으로서, A 형 항원에는 적용하기 힘든 한계점이 있다. Methoxy polyethylene glycol 은 세포막 단백질을 화학적으로 변형하여 항원성을 감소시키며 말단부 hydroxyl group 이 lysine 과 공유결합을 하며 glutaraldehyde 는 aldehyde group 이 단백 아민기와 반응하여 methylene crosslink 를 형성하여 적혈구 막을 안정시키고 항원 항체 반응으로 인한 응집이 일어나지 않도록 한다. 그 외에도 적혈구막 구조에 부착하여 항원을 숨기는 polydopamin 등이 보고되어 있으나(Wang 등, 2014) 위에서 언급한 방법들은 모두 아직까지 상용화 되어 있지 않다. 최근에는 세포표면에 합성 당지질인 Function–Spacer–Lipid (FSL) 구조물을 부착함으로써 원하는 새로운 성상이나 기능을 갖게 하는 KODETM cell surface engineering 이 소개되었다(Frame 등, 2007) (Fig. 1). FSL 구조물은 세포 뿐만이
아니라 바이러스와 유기체의 표면을 조작하거나 용액과 비생물학적 표면을 생리활성물질로 변환할 수 있는 양친매성(amphiphile)의 생물표면공학(biosurface engineering) 물질이다. FSL 구조물은 명칭과 같이 말단의 기능적인 부분과 가운데 기둥과 지질막에 고정하는데 이용되는 지질꼬리의 부분으로 이루어져 있기 때문에 세포와 잘 섞어주었을 때 세포표면에 자연적으로 세포막에 결합된다. 본 연구에서는 인체 유래의 O 형 적혈구에 A 형 혹은 B 형의 성상을 가진 FSL 구조물을 이용하여 변형 적혈구 kodecyte 를 적절히 제조하여 실제 ABO 아형 검사용 물질로 사용할 수 있게 하고 정도관리 물질로의 활용 가능성을 평가하여 궁극적으로 의료기관 검사실의 혈액형 검사의 정확성을 기하는데 도움이 되고자 하였다.
Fig. 1. Diagram showing the features of the function–spacer–lipid construct of a kodecyte, using the analogy of a sunflower. As indicated in the figure, the function group
analogous to the flower head can be arranged in different substances, the spacer analogous to the stalk (including the leaves) can have a variety of different features, and the lipid can be a variety of different lipids. Together the three components of function, spacer & lipid represent the FSL construct (from https://en.wikipedia.org/wiki/Function–spacer–lipid_construct).
II. 연구대상 및 방법
A. 항원 변형 적혈구 제조
1. 제조법 확립
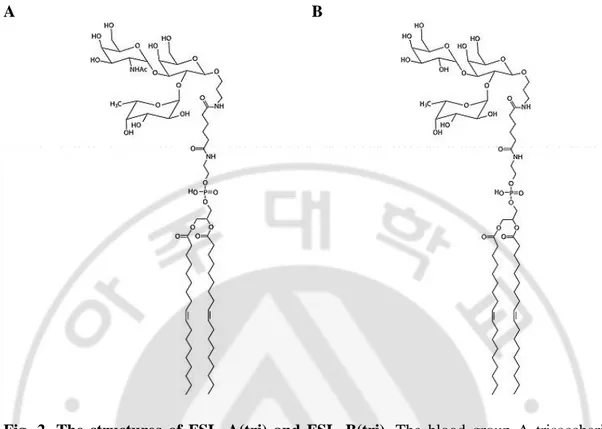
O 형 적혈구를 기본으로 하여 말단에 A 와 B 항원의 삼당 항원결정기를 가진 합성 당지질인 FSL–A(tri) (Sigma–Aldrich, St. Louis, MO, USA)와 FSL–B(tri)
(Sigma–Aldrich)(Fig. 2)를 삽입하는 방법으로 다양한 항원성을 나타내는
적혈구 kodecyte 를 제조하였다. 먼저 O 형 적혈구는 생리식염수 또는 phosphate– buffered saline (PBS)에 1000 ×g 에서 5 분 동안 원심침전하여 3 회 세척하고 40% 부유액의 상태로 준비하였으며 FSL construct 는 제조사 지침에 맞게 PBS 에 녹여
stock solution 을 준비하였다. 제조사는 stock solution 용해 시 사용 전에
sonication 을 해야 한다고 하였으나 용해를 돕기 위하여 stock solution 제조 시에도 30 초 동안 sonication 하여 준비하였다. Stock solution 의 농도는 각각 FSL– A 가 1 mg/mL, FSL–B 가 2 mg/mL 이었으며 마이크로 튜브에 100μL 씩 aliquot 하여 –20°C 에 보관하였다. 사용할 때는 PBS 로 적절히 희석하여 여러 가지 농도의 working solution 을 준비하여 4°C 에 냉장 보관하며 1 주일 내로 사용하였고, 한 번 해동한 stock solution 은 다시 냉동하지 않았다. A 형 및 B 형 적혈구 kodecytes 는 이전의 연구(Frame 등, 2007; Hult 등, 2012)를 변형하여 제조하였다. 각 튜브에 적혈구 120 μL 과 FSL 용액 40 μL 을 넣고 37°C 수조에 2 시간 동안 반응 시키면서 간헐적으로 흔들어 주었고 PBS 에 2 회 세척하였다.
최종적으로 3 mL 가 되도록 용액(PBS 등)에 부유하여 약 3% 혈구 부유액의 형태로 4°C 에 냉장 보관하며 사용하였다. 본 연구에서 FSL 물질 농도에 따른 항원량 측정, 보존 안정성 평가, 워크숍과 외부정도관리 사업에 사용한 A kodecyte 와 B kodecyte 는 6 개월에 걸쳐 각각 10 개와 4 개의 독립적인 묶음(batch)으로 제조되었다. Kodecyte 제조에 필요한 O 형 농축적혈구와 A 형 및 B 형 항원량 비교를 위한 헌혈자 ABO 아형 검체는 대한적십자사 연구윤리위원회의 승인을 받아 대한적십자사 경기 혈액원으로부터 연구용 혈액을 ethylenediaminetetraacetic acid (EDTA) 검체의 형태로 공급받았다.
A B
Fig. 2. The structures of FSL–A(tri) and FSL–B(tri). The blood group A trisaccharide
GalNAcα3(Fucα2)Galβ (A) and the blood group B trisaccharide Galα3(Fucα2)Galβ (B) is conjugated via an O(CH2)3NH spacer to an activated adipate derivative of dioleoyl –
2. 항원량 측정
혈청학적 측정법은 시험관에 3% 적혈구 부유액과 동량의 IgM 형의 항–A 항체(Millipore, Livingstone, UK) 또는 항–B 항체(Millipore)를 넣고 잘 혼합한 다음 3400rpm 에서 15 초 원심 침전하여 흔들면서 응집이 풀리는 모습을 관찰하는
시험관법을 시행하였다(Fung 등, 2014). 항–A1 lectin (Lorne Laboratories Ltd.,
Berkshire, UK)은 항–A 시약 및 항–B 시약과 같은 방법으로 사용하였고 항–H lectin (Lorne Laboratories Ltd.)은 제조사 권장사항에 따라 5 분간 실온 배양 후에 원심 침전하여 판독하였다. 응집 반응은 Table 1 과 같이 응집 없음을 나타내는 0 에서부터 가장 강한 응집을 나타내는 4+로 판정하였고(Race 등, 1975), 용혈은 있으나 혈액형 검사가 적합하면 허용 가능한 범위의 용혈로 간주하고 검사를 시행하였다. 외부 정도관리 물질로 발송하기 위해 제조한 Aw kodecyte 와 Bw kodecyte 는 헌혈자 ABO 아형 검체와 함께 추가로 유세포 분석법으로도 항원량을 측정하여 비교하였는데 그 방법은 이전의 연구와 비슷한 방법이며(Kang 등, 2014) 자세한 방법은 다음과 같다. 먼저 적혈구 응집을 막기 위해 glutaraldehyde (Junsei chemicals, Tokyo, Japan) 로 표면 고정처리를 시행하였고 이때의 농도는 적혈구 응집이 없으면서 항원 손실이 가장 적고 비특이적 항체 반응이 최소인 0.05%로, 3% 적혈구 부유액과 동량으로 실온에서 5 분간 반응시킨 후 PBS 로 1000×g 에서 5 분 동안 원심침전하여 3 회 세척하였다. 이후 적혈구 부유액을 혈청학적 측정법에 사용된 IgM 형의 항–A 또는 항–B 항체와 실온에서 30 분간 반응 후 2 회 세척한 다음, 2 차 항체로 phycoerythrin 형광이 표지된 rat anti–mouse k a p p a 항체 ( S o u t h e r n b i o t e c h , B i r m i n g h a m , U S A ) 를 넣고 실온 암 소 에 서
Table 1. Interpretation of agglutination reactions
Macroscopically observed findings Designation Score
One solid agglutinate Several large agglutinates
Medium–size agglutinates, clear background Small agglutinates, turbid background Very small agglutinates, turbid background Barely visible agglutination, turbid background No agglutination
Mixtures of agglutinated and unagglutinated red cells (mixed field) Complete hemolysis
Partial hemolysis, some red cells remain
4+ 3+ 2+ 1+ 1+w w+ or +/− 0 mf H PH 12 10 8 5 4 2 0
30 분 두었고 유세포 분석기로 측정하기 전 PBS 로 2 회 세척하였다. 각 항체의 사용량은 제조사의 권고를 따랐다. 유세포 분석기는 Cytomics FC 500 (Beckman Coulter, Fullerton, CA, USA)를 사용하였고, CXP Software (Beckman Coulter) 프로그램을 이용하여 forward light scatter (FSC)와 side light scatter (SSC)를 log amplification 하였다. 적혈구 위치에 해당하는 부위를 gating 하여(Fig. 3) 최소
10,000 개 이상이 되도록 acquisition 후 적혈구의 형광 항체 히스토그램을 얻었다
각 검체의 형광 강도는 검체/대조 평균 및 중앙값 형광 강도(fluorescence intensity,
FI) 비율을 구하였고 음성 대조군으로는 모두 O 형 적혈구를 사용하였다. Aw
kodecyte 에 대한 양성 대조군으로는 시험관법에서 A2 표현형을 보인 검체(항–A
시약에 4+ 응집, 항–A1 시약에 음성, 항–H 시약에 3+ 응집을 보임)와 A3
표현형을 보인 검체(항–A 시약에 2+ mixed field 응집, 항–A1 시약에 음성, 항–H
시약에 3+ 응집을 보임)를 사용하였고 Bw kodecyte 에 대한 양성 대조군으로는
시험관법에서 B3 표현형을 보인 검체(항–B 시약에 1+ mixed field 응집, 항–H
B. 보존 안정성 평가
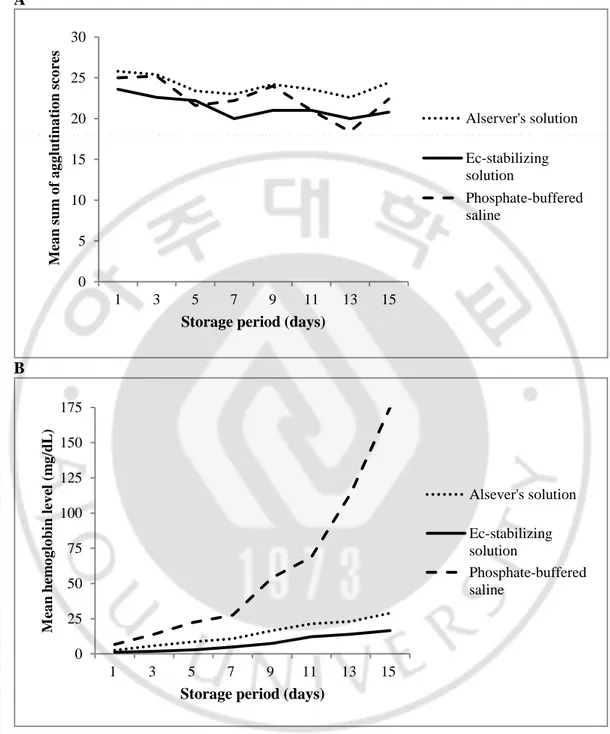
제조한 적혈구 kodecyte 의 보존 안정성을 평가하기 위하여 제조 후 15 일 동안 4°C 에 냉장 보관하면서 이틀마다 혈액형 검사를 실시하여 혈구 응집 정도와 상층액의 hemoglobin (Hb)을 측정하였다. 검체는 각각 FSL–A 0.02 – 0.022 mg/mL 와 FSL–B 0.2 – 0.25 mg/mL 의 working solution 으로 제조한 A kodecyte 3 검체와 B kodecyte 2 검체를 평가하였고 모두 4 개의 batch 에서 제조되었다. 혈구 응집은 항원성의 보다 민감한 변화를 비교하기 위하여 항혈청의 역가를 달리하여 같은 검체의 응집 강도를 여러 번 측정하여 응집 값의 합을 구하였다. 방식은 마치 혈청의 항체 역가 측정을 할 때와 같이 항–A 시약 또는 항– B 시약을 계단 희석하여 원래 농도부터 1:32 까지 만들고 각각의 항혈청으로 반복 측정하여 얻은 시험관법의 결과를 scoring system (Table 1)으로 나타내었다. 각각의 결과는 응집 없음을 나타내는 0 에서부터 가장 강한 응집을 나타내는 12 까지 숫자로 기록하였고(Marsh, 1972), 결과적으로 검체의 항원성은 각 날짜 별로 측정한 모든 응집 점수의 합으로 나타내었다.
용혈의 정도를 보기 위해 측정한 상층액의 Hb 수치는 Na2CO3 용액을
이용하여 Allen correction (Burtist 등, 1999)의 방법으로 측정하였다.
또한 적혈구 부유액은 Alsever’s solution (Sigma–Aldrich), Ec–stabilizing solutions (DiaMed, Cressier, Switzerland), 그리고 PBS 의 세가지 보존용액으로 나누어 제조하였다.
C. 제조된 변형 적혈구 활용
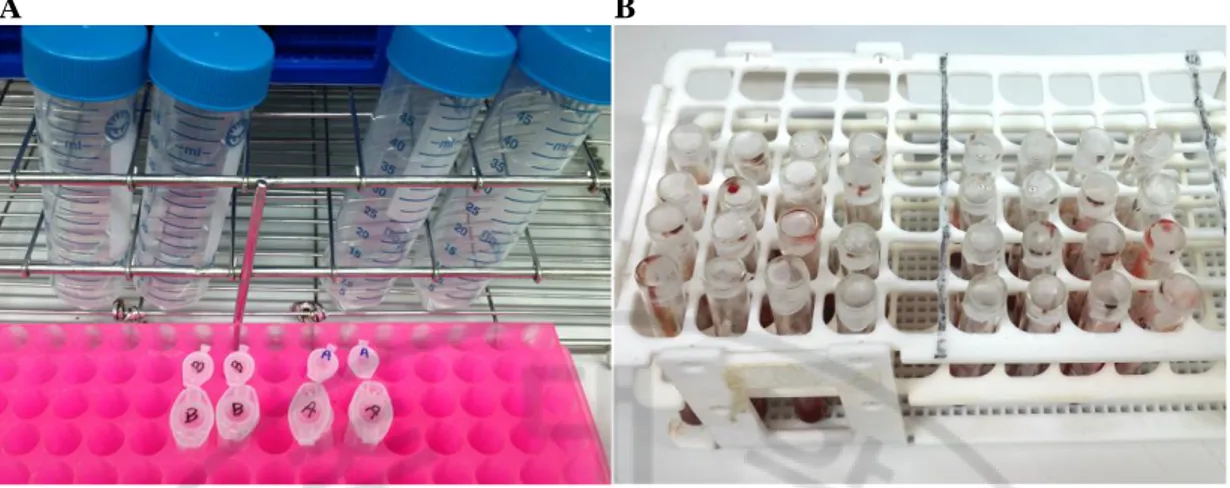
혈액형 검사 실기 워크숍에 이용하기 위한 ABO 아형 검체는 사용하기 하루 전에 O 형 적혈구에 0.015 mg/mL 의 FSL–A 용액을 37°C 에서 2 시간 동안 반응시켜 3% 적혈구 부유액 15 mL 를 제조하였고 6 개 그룹에서 사용하도록 시험관에 소분하여 밀봉 후 냉장보관 하였고 사용 전에 실온에 꺼내두었다. 외부 정도관리 물질로 시범 사용하기 위한 검체는 Bw, O, Aw 표현형을 보이는 순서의 검체–1, 검체–2, 검체–3 의 형태로 준비하였고 참여대상인 실시기관은 검체 발송 전에 대한임상검사정도관리협회 외부신빙도조사 1 차 ABO 아형 시범사업에 참여하였던 53 개 기관으로 한정하였다. 3%의 O 형 적혈구 부유액을 비롯하여 나머지는 각각 O 형 적혈구에 0.02 mg/mL 의 FSL–A 용액과 0.15 mg/mL 의 FSL–B 용액으로 제조한 검체로, 110 mL 의 3% 적혈구 부유액으로 제조하였다. 먼저 검체의 균질성을 위하여 각 튜브에 최종 부유액 9 mL 에 해당하는 양인 40% 적혈구 360 μL 와 FSL 용액 120 μL 를 넣고 37°C 수조에서 2 시간 동안 간헐적으로 흔들어 주면서 반응시킨 다음 7 개씩 50 mL tube 에 옮겨 담고 PBS 에 세척하였다. 세척 후 상층액을 버리고 나서 각 튜브에 보존용액을 넣어 적혈구를 재부유 하였고 hematocrit 을 측정하여 3% 농도가 되도록 조절하는 방법으로 검체 종류별로 55 mL 씩 2 개의 튜브로 준비되도록 새로운 튜브로 옮겨 담으면서 잘 혼합하였다(Fig. 4). 최종적으로 발송 전의 상태인 cryotube 에 검체를 1.5 mL 씩 나누어 담았고(Fig. 5, A) 발송할 때까지 4°C 에 냉장보관 하였다.A B
Fig. 4. Preparation of the quality control materials for proficiency testing. (A) Microtubes containing the FSL–A (1 mg/mL) and FSL–B (2 mg/ mL) stock solution and Eppendorf tubes containing the FSL–A (0.02 mg/mL) and FSL–B (0.15 mg/mL) working solutions. (B) The tubes used for incubation phase.
A B
C D
Fig. 5. Survey specimens used for external proficiency testing of ABO subgrouping. (A) Three types of specimens in cryotubes including red blood cell (RBC) kodecytes of
weak B (Bw) phenotype, O RBCs and RBC kodecytes of weak A (Aw) phenotype in order.
(B–D) The serologic reactions observed in tube test at the time of starting being dispersed from red cell button (B), being recorded results (C) and 1 minute later (D).
추출하여 5 개 검체를 3 회씩 반복하여 혈액형 검사를 시행하였고 안정성 평가를 위하여 냉장보관 일주일 전후로 혈액형 검사 응집 강도 변화와 상층액에서의 lactic dehydrogenase (LD)와 Potassium (K)을 측정하였다. 안정성 평가 데이터는 참여한 53 개 기관 중 무작위로 선정한 10 개의 3 차 의료기관에 검체를 추가로 발송 및 요청하여 본 검사실의 결과를 포함하여 총 11 개 결과를 얻었으며 검체 상층액의 LD 와 K 값은 같은 날에 측정되었다. 발송된 세 가지 검체에 대한 외부 정도관리 결과는 온라인의 시범 항목란에 입력된 답변을 분석하였다.
D. 분석 방법
적혈구 kodecyte 의 보존 안정성 평가를 위해 제조 후 15 일까지 측정한
혈구 응집 점수의 합과 상층액의 Hb 은 multivariate repeated measures analysis of
variance (ANOVA) (Wilk’s Lambda)로 분석하여 보관 중의 변화와 보존용액에 따른 차이를 비교하였다. 제조한 외부정도관리 물질의 냉장보관 1 주일 간의 상층액
LD 와 Hb 값의 변화는 보관 전 후의 평균값을 paired t
-
test 로, 세 물질간의비교는 one–way ANOVA 를 시행하였다. P<0.05 인 경우 통계학적으로 유의한 것으로 간주하였으며 프로그램은 Excel 2007 (Microsoft Corporation, WA, USA) 과 SPSS version 12.0.1 for Window (SPSS, Chicago, USA) 를 이용하였다.
III. 결 과
A. 항원 변형 적혈구 제조
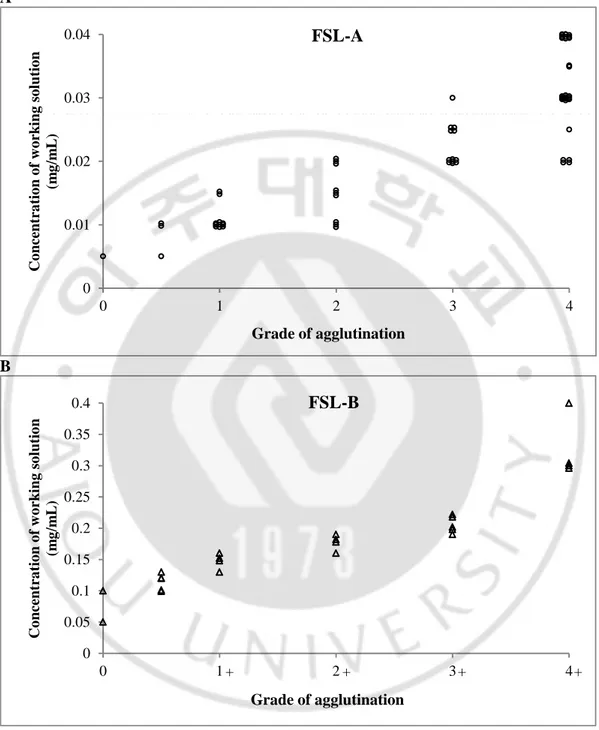
O 형 적혈구와 FSL–A 로 제조한 A kodecyte 는 시험관법에서 항–A 시약에 대하여 음성에서 4+ 응집까지의 다양한 결과를 나타내었으며 이 때 해당하는 제조 working solution 의 농도는 0.005 – 0.04 mg/mL 이었다(Fig. 6, A). A kodecyte 는
FSL 용액의 농도와는 상관없이 항–A1 시약에는 응집을 보이지 않고 항–H 시약과
반응하여 4+ 응집을 보였다(n=40). O 형 적혈구와 FSL–B 로 제조한 B kodecyte 또한 시험관법에서 항–B 시약에 대하여 음성에서 4+ 응집까지의 다양한 결과를 나타내었으며 이 때 해당하는 제조 working solution 의 농도는 0.05 – 0.4 mg/mL 이었다(Fig. 6, B). B kodecyte 도 A kodecyte 와 마찬가지로 FSL 용액의 농도와는 상관없이 항–H 시약과 반응하여 4+ 응집을 보였다(n=24).
A 0 0.01 0.02 0.03 0.04 0 1 2 3 4 Co ncent ra tio n o f w o rk ing s o lutio n (m g /m L ) Grade of agglutination FSL-A B 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0 1 2 3 4 Co ncent ra tio n o f w o rk ing s o lutio n (m g /m L ) Grade of agglutination FSL-B + + + +
Fig. 6. Relationships between the extent of agglutination by monoclonal antibodies and the working solution concentration. (A) Function–spacer–lipid (FSL)–A (n=40), (B) FSL–B (n=24).
B. 보존 안정성 평가
5 개의 적혈구 kodecyte 는 모두 제조 당시 시험관법에서 3+ 응집을 보였고 제조일로부터 보관일이 경과함에 따라 scoring system (0–12)으로 표시한 항혈청과의 응집 점수의 합계가 점차 감소하였다. 적혈구 kodecyte 제조 후 15 일 째와 제조 당일 측정한 혈구응집 점수 합의 차이는 그 평균값이 Alsever’s solution 이 1.4, Ec–stabilizing solution 이 2.8, PBS 가 2.6 으로 Alsever’s solution 에서 가장 적은 차이를 보였다. 응집 단계로 비교하였을 때는 Alsever’s solution 은 9 일 째, Ec–stabilizing solution 은 7 일 째, 그리고 PBS 는 5 일 째부터 응집강도가 한 단계씩 떨어지는 경우가 있었다. 그러나 통계적으로 분석한 세 보존용액에서 응집점수의 합계는 통계적으로 유의한 차이가 없었으므로(P=0.45, Fig. 7, A), 결과적으로는 모든 보존용액에서 15 일간 냉장 보관 중 적혈구 kodecyte 의 응집 강도는 의미 있는 변화를 보이지 않았다고 판단하였다. 상층액의 Hb 값은 보관일이 경과함에 따라 통계적으로 유의한 변화를 보였고(P<0.001, Fig. 7, B), 세 가지 중 Ec–stabilizing solution 이 가장 용혈 정도가 적었으며 특히 PBS 을 사용한 적혈구 kodecyte 부유액에서 Alsever’s solution 과 Ec–stabilizing solution 에 비하여 용혈 정도가 큰 것으로 측정되었다. 15 일 째에 측정한 5 개 검체 상층액의 Hb 평균값은 Alsever’s solution 이 26.3 mg/dL, Ec–stabilizing solution 이 15.3 mg/dL, 그리고 PBS 가 168.3 mg/dL 이었다.
A 0 5 10 15 20 25 30 1 3 5 7 9 11 13 15 M ea n sum o f a g g lutina tio n sco re s
Storage period (days)
Alserver's solution Ec-stabilizing solution Phosphate-buffered saline B 0 25 50 75 100 125 150 175 1 3 5 7 9 11 13 15 M ea n hem o g lo bin lev el (m g /dL )
Storage period (days)
Alsever's solution Ec-stabilizing solution Phosphate-buffered saline
Fig. 7. The summed agglutination scores and the supernatant hemoglobin levels in suspension of red blood cell kodecytes over time, according to the type of suspension medium. The supernatant hemoglobin level increased significantly in the phosphate–buffered saline group (P<0.001); however the summed agglutination scores
C. 제조된 변형 적혈구 활용
1. 혈액형 검사 실기 워크숍
준비한 A kodecyte 검체는 시험관법에서 항–A 시약에 2+ 응집을 보이면서 항–A1 시약과는 응집이 없고 항–H 시약에 4+ 응집을 보이는 3% 적혈구 부유액이었다. 6 개 그룹으로 나뉜 참가자들은 ABO 혈액형 검사 후 아형이 의심되면 항–A1 시약 및 항–H 시약을 사용하여 추가 검사를 진행하여 결과를 기록하도록 하였는데, 각 조마다 항–A 시약에 대한 응집 강도는 1+ 응집에서 3+ 응집까지 다양하게 관찰되었고 항–H 시약에 대한 응집 강도는 3+ 응집에서 4+ 응집을 보고하였다.2. 외부정도관리 시범 사업
(A) 검체의 A 와 B 항원량 측정
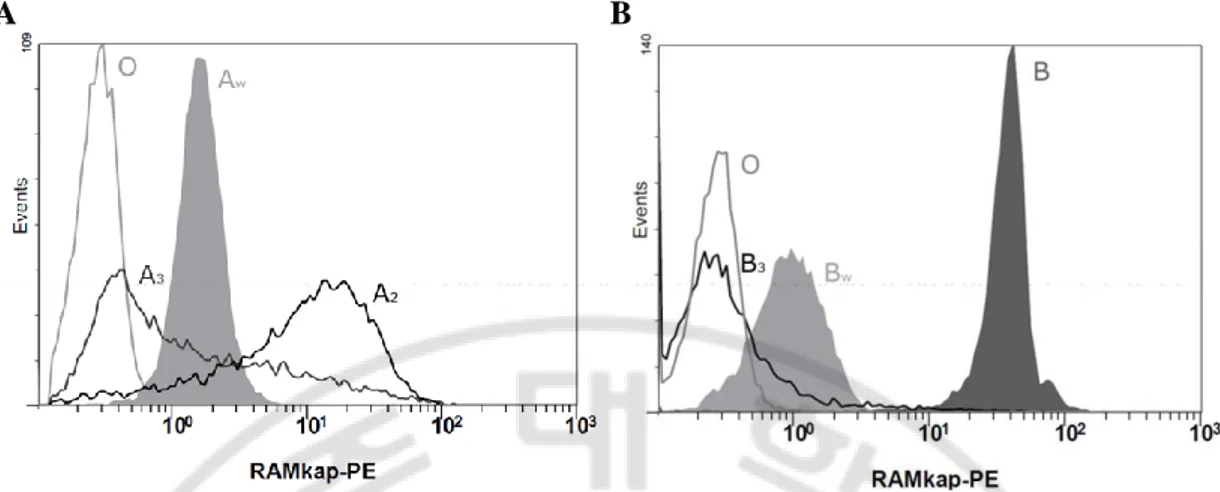
Aw kodecyte 와 Bw kodecyte 는 균질성 평가를 시행한 모든 검체에서 각각 항–A 와 항–B 시약에 대하여 시험관법으로 1+ 와 2+ 이하의 응집을 보임을 확인하였고(Fig. 5, B – D) O 형 적혈구 검체는 두 항체 모두에서 응집이 없었다. 유세포 분석법으로 측정한 검체들의 평균 FI 비율은 Aw kodecyte 가 4.16 이고 Bw kodecyte 가 3.55 였다. 양성 대조군으로 비교한 인체 유래의 헌혈자 ABO 아형 적혈구의 평균 FI 비율은 A2 표현형을 가진 검체가 35.14, A3 표현형을 가진 검체가 11.5, B 표현형을 가진 검체가 127.04, 그리고 B3 표현형을 보인 검체가 3.1 이었다. 중앙값 FI 비율 분포는 평균 FI 비율 분포와 다소 다르게 나타났는데Aw kodecyte 가 5.6 이고 Bw kodecyte 가 3.37 이었다. 헌혈자 ABO 아형 적혈구의
중앙값 FI 비율은 A2 표현형을 가진 검체가 37.97, A3 표현형을 가진 검체가 2.91, B 표현형을 가진 검체가 133.22, 그리고 B3 표현형을 보인 검체가 1.07 이었다. 적혈구 표면에 표현된 항원량을 나타내는 FI 비율은 Aw kodecyte 의 경우 실제 인체 유래 ABO 아형 적혈구에 비하여 그 분포가 더 좁기 때문에 중앙값은 A3 표현형을 가진 검체와 A2 표현형을 가진 검체 사이에 존재하지만 평균값은 A3 표현형을 가진 검체보다 낮은 값을 나타내었다. Bw kodecyte 또한 B3 표현형을 보인 적혈구에 비하여 히스토그램 분포가 더 좁아서 FI 비율을 비교하였을 때 중앙값과 평균값의 순위가 바뀐 양상이었다(Fig. 8).
A B
Fig. 8. Histograms showing the A and B antigen levels of kodecytes and natural red blood cells (RBCs) obtained with monoclonal antibodies used in ABO typing. (A) O, A3, A2 phenotype RBCs and A kodecytes (Aw) prepared in solutions of 0.02 mg/mL FSL–A
were tested with anti–A, (B) O, B3, B phenotype RBCs and B kodecytes (Bw) prepared in
solution of 0.15 mg/mL FSL–B were tested with anti–B. The mean (median) fluorescent intensity ratios were as follows: A3, 11.50 (2.91); A2, 35.14 (37.97); Aw kodecytes, 4.16
(B) 검체 안정성 비교
냉장보관 일주일 후 측정한 상층액의 LD와 K는 제조일에 측정한 값과 유 의한 차이가 있었다. 11개의 기관에서 측정한 냉장보관 일주일 후의 상층액의 LD 와 K 의 결과값은 Table 2 와 같이 유의한 증가를 나타냈다. 그러나 세 검체 간 의 유의한 차이는 보이지 않았다. 혈액형 검사의 응집강도 비교결과는 Aw– kodecyte의 응집변화 2건(4+ 응집에서 2+ 응집으로, 2+ 응집에서 3+ 응집으로) 과 Bw kodecyte의 응집변화 2건(4+ 응집에서 3+ 응집으로, 3+ 응집에서 4+ 응집으로) 이 보고되었으나 나머지 대부분의 측정기관에서 같은 결과를 보고하였으므로 적 혈구 kodecyte와 인체유래 적혈구 사이의 안정성 차이는 없는 것으로 판단하였다.Table 2. The lactate dehydrogenase (LD) and potassium (K) levels before and after 7 days of refrigerator storage
Storage status Parameter Samples O Aw Bw Total Before LD (U/L) 9.85±4.27 8.43±3.80 9.55±6.59 9.28±4.92 K (mMol/L) 5.44±0.13 5.55±0.23 5.45±0.14 5.48±0.18 After LD (U/L) 15.91±6.5** 14.83±6.9* 13.98±6.7 14.91±6.54* K (mMol/L) 5.72±0.21* 5.80±0.28* 5.74±0.23* 5.75±0.24* *
P<0.001and **P<0.01 by paired t-test based on the before storage data. There was no
significant difference in the LD or K levels before and after storage among the three survey samples [O cells, Aw kodecytes (prepared in 0.02 mg/dL FSL–A) and Bw kodecytes
(C) 참여기관의 답변 분석
검체를 발송한 총 53개 기관 가운데 43기관이 답변 회신하여 81.1%의 회신 율을 보였으며 각 기관의 검사 소요일은 검체 제조 후로부터 4일에서 14일까지
로 다양하였다(평균 6.3±2.6일). 검체의 상태는 한 기관이 보고한 Bw kodecyte의
‘약한 용혈’ 외에는 모두 상태 좋음으로 보고하였다. O형 적혈구 부유액 검체는 not available로 답한 한 기관을 제외한 42개 기관에서 모두 O형으로 답하였고 적
혈구 kodecyte의 항 혈청반응과 혈액형 판정 결과는 Table 3과 Table 4와 같다. Aw
kodecyte의 항–A 시약에 대한 반응은 음성(n=6), 1+ 응집(n=5), 2+ 응집(n=14), 3+ 응집(n=15), 4+ 응집(n=3)으로 다양하였고 혈액형은 15개 기관(34.9%)이 Aw, 21개 기관(48.3%)이 A2형으로 판정하였다. A2형으로 판정한 기관 중에서도 항–A 시약 에 2+ 이하의 응집을 보고한 곳이 7개 기관이 있었으며, Aw형으로 판정한 기관 중에서 항–A 시약에 3+ 이상의 응집을 보고한 곳도 4개 기관이 있었다. 한 기관 은 항–A1 시약에 대한 반응을 2+ 응집으로 보고하였음에도 불구하고 Aw 형으로
판정하였으며 6개 기관(13.4%)은 O형으로 판정하였다. Aw kodecyte는 Novaclone 항
–A 시약(Immucor & Dominion Biological Limited, Dartmouth, Canada)을 사용한 5개
기관과 Diagast 시약(Loos, France)을 사용한 2 개 기관 중 1개 기관 에서 응집 반
응이 일어나지 않음을 보고하였다(Table 5). Bw kodecyte의 항–B 시약 에 대한 반응
또한 다양하였으며 1+ 응집(n=6)에서 2+ 응집(n=13), 3+ 응집(n=17), 4+ 응집(n=7)
까지 보고하였고 이 중 29개 기관(67.4%)이 혈액형을 Bw형으로 판정하였다. 10개
기관은 항–H 시약에 2+ 이상의 응집을 보고하였음에도 불구하고 항–B 시약에
Table 3. The reports of test result and interpretation of ABO grouping for Aw kodecytes
(n=43)
Reactions of red blood cells Interpretation of the
with antisera or lectin ABO blood group
Anti–A Anti–A1 Anti–H A1 A2 Aw O N/A
4+ (n=3) 0 4+ 3 3+ (n=15) 2+ 3+ 1 0 4+ 7 3 0 3+ 2 0 2+ 1 0 N/D 1 2+ (n=14) 0 4+ 2 4 0 3+ 3 4 0 N/D 1 1+ (n=5) 0 4+ 1 2 0 3+ 1 0 N/D 1 0 (n=6) 0 4+ 3 0
3+
2 02+
1Total
21 15 6 1Table 4. The reports of test result and interpretation of ABO grouping for Bw kodecytes
(n=43)
Reactions of red cells with antisera or lectin
Interpretation of the ABO blood group
Anti–B Anti–H AwB B Bw N/A
4+ (n=7) 4+ 3 1 3+ 1 1 N/D 1 3+ (n=17) 4+ 3 6 3+ 1a 3 1 2+ 2 N/D 1 2+ (n=13) 4+ 7 3+ 6 1+ (n=6) 4+ 4 3+ 1 N/D 1
Total
1 12 29 1 aHigh probability of clerical error considering reactivity with anti–A. AwB, B with weak A; Bw, weak B; N/A, not available; N/D, not done
Table 5. The reactivities of monoclonal antibodies to survey samples according to the manufacturer (n=43)
Specimens (MoAb)
Monoclonal antibodies Agglutination
Total Manufacturer Clones 4+ 3+ 2+ 1+ 0 Aw kodecyte (anti–A) Diagast 9113D10 1 1 2 Immucor F98 7C6 5 5 Ortho MH04/A3D3 4 2 6 Millipore BIRMA–1 3 11 12 4 30 Bw kodecyte (anti–B) Diagast 9621A8 1 1 2 Immucora F84 3D6/ F97 2D6 2 3 5 Ortho NB1.19/NB10.5A5/NB10.5A5 1 3 2 6 Millipore LB–2 4 13 9 4 30 a
IV. 고 찰
본 연구에서는 Aw 형 및 Bw 형의 표현형을 나타내는 적혈구 kodecyte 를 제조하는 조건을 설정하고 보관 안정성을 확인하였으므로 제조한 물질을 ABO 아형 검사의 내부정도관리물질로서 일상검사에서의 활용할 수 있음을 알 수 있었다. 뿐만 아니라 교육 및 숙련도 평가에도 이용될 수 있으며 외부정도관리 물질로도 이용이 가능함을 실례로써 입증하였다. B 형 적혈구에 FSL–A 를 부착하거나 A 형 적혈구에 FSL–B 를 부착했을 때도 적혈구 표면에 원하는 만큼의 추가 항원 표현이 가능하지만 본 연구에서는 인체 유래의 O 형 적혈구를 이용하여 적혈구 kodecyte 를 제조하였다. 대부분의 약한 A 형 및 약한 B 형의 적혈구는 항–H 시약과 강한 응집을 나타내고 Aw 형의 경우 항–A1 시약에 대하여 응집이 일어나지 않는데, 이는 O 형 적혈구의 경우에도 동일하기 때문에 ABO 아형 혈액형의 이런 특성을 재현할 수 있는 좋은 조건이 된다. 같은 농도의 FSL 용액으로 제조한 적혈구 kodecyte 는 A 형 항원이 B 형 항원 kodecyte 에 비하여 더 강한 항원성을 나타내었다. 혈청학적 검사에서의 응집 반응 강도에 따른 FSL solution 농도는 문헌에 따라 차이를 보였으며 특히 B kodecyte 에서 더 큰 분포를 보였다. FSL 농도에 따른 적혈구 kodecyte 의 항원성 차이에 대한 연구를 살펴보면 본 연구에서 4+ 응집을 나타내는 FSL–A 용액의 농도는 최소 0.035 mg/mL 이었으나 문헌에 따라 0.01 mg/mL(Frame 등, 2007), 0.008 mg/mL(Hult 등, 2012), 0.04 mg/mL(Henry, 2009) 로 보고하였고, 1+ 응집을 보이는 농도는 최소 0.005 mg/mL 로 확인하였는데 다른 연구에서는 0.002 mg/mL(Hult 등, 2012)와 0.02 mg/mL (Henry, 2009)이 보고되었다.FSL–B 용액의 경우 4+ 응집을 나타내는 최소 농도는 0.3 mg/mL 로 확인하였는데 같은 0.3 mg/mL(Henry, 2009)와 0.1 mg/mL (Frame 등, 2007), 0.078 mg/mL(Hult 등, 2012) 등 다양한 농도가 보고되었으며, 1+ 응집을 보이는 농도는 최소 0.15 mg/mL 로 확인하였으나 선행 연구에서는 0.03 mg/mL(Henry, 2009)와 0.01 mg/mL(Hult 등, 2012)가 보고되었다. FSL 용액의 농도뿐만 아니라 배양 온도와 시간 또한 적혈구 kodecyte 제조 시 주요한 조건 요인이다. 본 연구에서는 3:1 의 비율로 40% 적혈구 부유액에 FSL 용액을 섞고 37°C 수조에서 2 시간 동안 반응시키는 것으로 조건을 정하였다. 제조사에서 4–37°C 의 온도 범위와 1– 12 시간의 조건이 가능하다고 하였으나 같은 농도의 FSL 용액으로 실온에서 6 시간 반응할 때와 4°C 에서 18 시간 반응시키는 방법을 병행하였을 때 결과적으로 시험관법에서 항체에 더 강한 응집반응을 보임을 확인하였기에 가온 조건으로 제조하는 것이 짧은 시간에 더 효율적인 항원 삽입이 가능하다고 판단하였다. 반응 조건에 따라 동일한 working solution 농도라도 제조 물질의 항원량이 달라질 수 있으며, 타 연구에서는 농도 외의 조건을 밝히지 않거나 21°C 에서 3–5 시간 반응시키는 방법을 사용하였다고는 하였으나 사용한 적혈구의 농도를 구체적으로 밝히지 않아 직접적인 비교는 어려웠다. 본 연구의 조건으로는 적혈구 아형 검사의 정도관리에 활용하기 적절한 적혈구 kodecyte 를 제조하기 위해서 시험관법에서 2+ 이하의 응집을 보이도록 0.01 – 0.015 mg/dL 의 FSL–A solution 과 0.1 – 0.2 mg/dL 의 FSL–B solution 이 필요하였다. 그 외에 고려할 요인으로는 vial 에 담긴 FSL 특성상 회수율의 차이가 있을 수 있으므로 stock solution 제조시 PBS 분주 후에 고르게 잘 섞어 흔들고 spin down 하여 얻는 과정과 FSL 용액을 세포 표면에 삽입하는 과정에서 간헐적으로 잘 흔들어 주는
제조한 적혈구 kodecyte 의 안정성은 3% 적혈구 부유액의 형태로 냉장 보관했을 때와 외부정도관리물질로서 운송되었을 때 각각 15 일과 일주일 간 항원성이 잘 유지되는 것을 알 수 있었다. 또한 보관 중에 일어나는 용혈도 인체 유래 형 적혈구와 차이가 없음을 확인하였다. PBS 를 보존용액으로 사용하였을 때 상품화된 다른 적혈구 전용 보존액에 비하여 용액 내 용혈 정도는 크지만 혈청학적 반응에는 유의한 차이를 보이지 않았으므로 비용효과 측면에서 선택할 수 있는 사항으로 생각되었다. 혈액형 검사 실기 워크숍 에서 참가자들이 답변한 A kodecyte 의 항– A 시약에 대한 응집 강도는 그룹별로 여러 참가자들이 돌아가면서 관찰하면서 원심침전을 수 차례 반복하게 되는 워크숍 방식의 특성상 같은 그룹 안에서도 결과를 다양하게 기록하였다. 비단 적혈구 kodecyte 뿐만 아니라 다른 검체의 검사에서도 처음 원심 하였을 때 보다 반복 원심침전 할수록 혈구응집반응이 더 강해질 수 있으므로 약한 응집 반응에 대하여 반응 강도를 정확하게 판독하기 위해서는 반복 원심침전 하지 않고 재검사를 하는 것이 더 정확할 것이다. 인체 유래의 A3 형과 B3 형 적혈구는 유세포 분석의 히스토그램에서 인공적으로 고른 항원 분포를 갖게 한 적혈구 kodecyte 에 비하여 넓은 분포를 나타내었고 이는 혈청학적 검사에서 mixed field 응집을 보이는 특성과 같은 양상이었다. 이와 같은 항원분포 양상의 차이로 인하여 적혈구 표면에 표현된 항원량을 나타내는 FI 값은 Aw kodecyte 의 중앙값의 경우 A3형 표현형을 가진 검체와 A2형 표현형을 가진 검체 사이에 존재하지만 평균값은 A3형 표현형을 가진 검체보다 낮은 값을 나타내었다. 즉, 히스토그램에서는 시험관법에서 1+ 응집을 보이는 적혈구 kodecyte 가 2+ 응집 이상의 반응을 보이는 인체 유래 ABO 아형 적혈구의
peak 부위보다는 더 오른쪽에 위치하게 되었다. Bw kodecyte 의 경우에도 마찬가지로 중앙값이 B3 형 표현형을 가진 검체와 B 형 검체 사이에 존재하지만 평균값은 B3 형 표현형을 가진 검체보다 낮은 값을 나타내었다. Fig. 8 과 같은 전압에서 A 형 아형 혈구 중 항–A 시약에 3+ 응집 이하의 반응을 보이는 검체들 대부분은 세 번째 log decade 까지(0 – 102 ) 넓게 펼쳐져 있는 불균질한 항원 분포의 히스토그램으로 보이고 시험관법 응집의 2+ 응집 이하일 때와 3+ 응집 이상일 때의 차이는 첫 번째 log decade(100– 102) 사이의 표면 항원량을 가진 적혈구의 양적 차이에 해당하였다. 따라서 인공적으로 비교적 항원 분포를 균질하게 만든 적혈구 kodeyte 와 인체 유래의 ABO 아형 적혈구의 혈청학적 반응 차이를 히스토그램에서 직관적으로 비교하기는 어려울 수 있다. 저자는 강한 응집을 보이도록 제조한 적혈구 kodecyte 와 O 형 적혈구를 혼합하였을 때
혼합시야반응(mixed field agglutination)을 표현할 수 있음을 확인하였는데(Fig. 9), 인체유래의 적혈구와 비슷한 항원 분포를 재현하기 위해서는 두 가지 이상의 다른 농도의 FSL 용액으로 제조한 적혈구 kodecyte 를 혼합하거나 FSL 용액 과 반응시킬 적혈구 부유액의 농도를 조절하는 방법으로 표면 항원 분포의 균질성을 추가로 조절할 수 있을 것으로 생각된다. 실제 우리나라에서 가장 많이 동정되는 ABO 아형은 A2B 형과 A2B3 형, A1B3 형인데(Cho 등, 2004; 정옥주 등, 2004; 이자영 등, 2010), A2 형의 혈청형에서 보일 수 있는 A 혈구에 대한 약한 응집과 B3 형의 혈구형 검사에서 보이는 2+ 이하의 mixed field 응집을 표현하기 위하여 위에서 언급한 것과 같은 방법으로 더 실용적인 정도관리 물질을 제조할 수 있을 것이다.
A B
Fig. 9. Kodecytes exhibit mixed–field agglutination. (A) Macroscopic views of
agglutinated and free red blood cells on repeated testing of the same specimen, (B) Microscopic findings (× 100).
제조한 적혈구 kodecyte 의 약한 A 항원 또는 B 항원량을 시험관법과 유세포 분석법으로 측정하는 것이 가능하였으나 겔 카드인 ABO/D + Reverse Grouping (DiaMed)을 이용한 원주응집법으로 시행할 경우 응집이 관찰되지 않아 방법간 비교나 실기 워크숍 및 외부신빙도조사 시행 시 병행 검사를 실시하지 못하였다. 일반적으로 인체 유래 적혈구는 ABO 혈액형 검사에서 시험관법에서 4+ 응집을 보이는 경우 겔 카드법에서 4+ 응집을 보이고, ABO 아형 적혈구의 경우에는 시험관법에서 2+ mixed field 이나 3+ mixed field 응집을 보이는 경우 겔 카드법에서도 2+ 또는 3+ 응집으로 판독되거나, 시험관법에서 1+ mixed field 응집을 보이는 경우 겔 카드법에서 double population 으로 판독되는 등 응집 한 단계 정도 차이는 있을 수 있으나 결과값의 상관성이 좋은 편이다. 그러나 본 연구에서는 FSL 용액으로 제조한 A kodecyte 의 경우 시험관 법에서 4+ 응집을 보이는 경우에도(working solution 0.05mg/mL 로 제조) 겔 카드에서 응집을 보이지 않는다는 사실을 확인하였다. 조건을 바꾸어 혈액형 동정용 겔 카드가 아닌 일반 겔 카드 ID–Card NaCl, Enzyme Test, and Cold Agglutinins (Dia–Med)에 시험관법에서 사용한 것과 같은 항–A 시약을 이용하여 항원 항체반응 후 원심침전 해보았는데, 혈액형 동정용 겔 카드와는 달리 비록 시험관법에서 3+ 응집을 보인 A kodecyte(working solution 0.02 mg/mL 로 제조)는 응집을 보이지 않았으나 시험관법에서 4+ 응집을 보인 A kodecyte(working solution 0.04 mg/mL 로 제조)는 겔 카드법에서 2+ 응집을, 이보다 더 높은 농도인 working solution 0.1 mg/mL 으로 제조한 A kodecyte 는 겔 카드법에서 4+ 응집을 보이는 것을 확인하였다(Fig. 10). 같은 원심분리 속도와 겔 입자라는 medium 의 조건에서도 응집정도의 차이를
시험관법에서 사용한 시약은 BIRMA–1 로 시약 제조에 사용된 clone 이 다르고, 또한 전자는 원심침전 동안 적혈구가 겔 카드 내에서 이동하면서 항원항체 반응이 일어나고 후자는 원심침전 전에 항원 항체 반응이 먼저 일어난 다음에 겔을 통과하게 되기 때문이다. 그러나 변경된 조건의 겔 카드법이 원래의 방법에 비하여 항체와 적혈구의 결합을 더 강하게 하더라도 인체유래 ABO 아형 적혈구와 달리 FSL–A(tri)로 제조한 A kodecyte 는 시험관법에서 보이는 응집반응에 비해 겔 카드법의 응집반응이 약하다는 것을 알 수 있었다. 이것은 아마도 합성 당지질이 실제 인체 유래 적혈구 항원과는 구조적 차이가 있음으로 인하여 항원항체 결합력의 약화가 있고, 따라서 유세포 분석에서 확인하는 항원성에 비하여 시험관법에서 관찰하는 응집정도는 인체 유래 적혈구와 다소 차이가 적지만 겔 카드 medium 의 응집 분리 조건보다는 결합력이 약하기 때문에 생긴 현상으로 생각된다. 겔 카드법은 시험관법과 달리 일어난 혈구응집이 원심침전 과정에서 medium 의 저항을 받기 때문이다. 본 연구에서 사용한 합성 당지질은 일반 항원성을 나타내기 위하여 말단의 4 번째 당을 제거하여 chain 특이성을 없앤 trisaccharide 항원이므로 말단 galactose 에 N–acetyl–
D–glucosamine 이 연결되어 있는 tetrasaccharide 항원을 사용한다면 겔 카드법에서 다른 양상을 보일 가능성도 있으나 이는 추후 확인이 필요할 것으로 생각된다. 최근에는 여러 검사실에 원주응집법이나 마이크로플레이트법을 원리로 하는 자동화 검사 장비가 도입되고 있으므로 물질 활용을 위하여 극복해야 할 문제로 생각되며 각 검사방법간의 상관성이 완전히 일치하지 않는 부분에 대해서는 원주응집법에 사용할 물질은 시험관법에서 사용할 물질보다 고농도의 working solution 에서 제조하여 각각 따로 관리해야 하겠다.
A B
C
D
E F G H
Fig. 10. Gel cards showing the extent of the reaction by the monoclonal antibody used.
Both A kodecytes prepared in an FSL–A solution (0.05 mg/mL) (A, B) and a mixture of B cells and AwB cells prepared in an FSL–A solution (0.1 mg/mL FSL–A solution; C, D)
exhibited stronger agglutination in neutral gels with anti–A (B, D) than on the ABO grouping card (A, C). The agglutination grades on the gel card were weaker than those in the tube test (E – H). Kodecytes exhibiting agglutination grades of 4+ to 2+ in solutions of 0.1, 0.04, 0.02 and 0.015 mg/mL FSL–A in tube tests.
신빙도 조사사업에 답변함으로써 본 연구에 참가한 43 개 기관은 대부분 3 차 의료 기관으로, 다른 기관들에 비하여 검사실 직원 수와 직무능력에 있어서 더 나은 조건에 있을 것으로 기대할 수 있다. 그러나 A kodecyte 및 B kodecyte 의
혈구 응집 결과에는 다소 차이가 있었으며 의도한 Aw 형과 Bw 형을 답변한
기관은 각각 34.9% 와 67.4% 에 해당하였다.
과거 2004 년과 2008 년에 Royal College of Pathologists of Australasia 에서 시행한 질관리 교육프로그램에서는 참가기관들이 제조한 변형 적혈구 kodecyte 를 평가하였는데(Henry, 2009), strong A kodecytes 에 음성으로 답한 기관이 각각 6% 와 3% 를, 1+ 응집 이하인 약양성으로 답한 기관이 17% 와 12%를 차지하였으며 medium A kodecytes 에 대하여 음성으로 답한 기관도 18%와 9%에 해당하여 weak A kodecytes 를 바르게 답한 기관은 28%와 36%에 불과했다고 하였다. 위 연구에서는 평판법과 시험관법, 원주응집법, 마이크로플레이트법의 결과가 혼합되어 본 연구의 결과와 직접적으로 비교하기는 어려우나 한 batch 에서 특정 검사 플랫폼의 문제가 있었던 것과 특정 시약의 역가에 문제가 있었음을 확인하였다고 하였으므로 해당 제조사를 밝히지는 않았으나 본 연구 결과에서도 항체 시약의 문제를 생각해볼 수 있었다. 본 연구에서는 6 개 기관에서 항–A 시약에 대한 Aw kodecyte 의 응집 결과를 음성으로 보고하였는데, 답변한 5 개 기관 모두가 항–A 시약에 Aw
kodecyte 에 음성 반응을 보고한 Immucor & Dominion Biological Limited 사의 시약의 경우 그 중 한 기관에서 항원 항체 반응을 실온에서 15 분간 연장할 경우 mixed field 응집이 보이며 해당기관에서 Millipore 사의 시약으로 병행검사 하였을 때 2+ 응집이 관찰됨을 보고하였다. Diagast 사 시약을 사용한 2 개 기관 중 1 개
기관은 1+ 응집을 보였다고 답변하였다. 다른 연구(Frame 등, 2007)에서 특정 단클론항체 시약이 합성 당지질과의 반응성이 다소 떨어짐을 보고하였고 그 종류는 다음과 같다: 항–A 단클론항체(101500[2005], Immucor), 항–AB 단클론항체 (NAB04601 [2005], Dominion Biologicals), 항–B 단클론항체(BBB630A[2004], Ortho Diagnostic Systems), 항–AB 단클론항체 (ABB173A [2004], Ortho Diagnostic Systems). 다른 연구에서도 trisaccharide 항원의 경우 tetrasaccharide Type 2 항원과 달리 특정 항–A 단클론항체에 반응이 일어나지 않을 수 있음을 보고한 바가 있으며 본 연구에서처럼 Diagast 사 시약은 trisaccharide 항원에 반응하지 않는다고 하였다 (Barr 등, 2014). 앞서 언급한 바와 같이 tetrasaccharide 항원을 사용한다면 사용 시약 종류에 따른 결과 차이를 줄일 수 있었을 것이다. Diagast 사 시약과 같은 종류의 clone (9113D10)을 사용한 Lorne Laboratories 사의 시약은 2+ 응집으로 다소
그 정도는 약하지만 같은 trisaccharide 항원에 반응성이 있다고 보고하였으므로 단클론항체와 trisaccharide 항원과의 반응성에 영향을 미치는 요인은 사용하는 시약의 clone 종류 이외에도 또 다른 요인이 있음을 알 수 있다. 예상한 응집 강도 보다 강한 응집을 보고한 기관들이 적지 않았던 것에 대해서는 혈구 응집 판독시의 요인을 생각해 볼 수 있다. 적혈구 kodecyte 가 세게 흔들면 인체 유래의 ABO 아형 적혈구에 비하여 더 쉽게 풀어지는 경향이 있어 응집강도 확인 전에 이미 정도관리 물질로서 ABO 아형 검체라는 점을 염두에 두고 응집을 약하게 풀어서 확인하였거나, 혹은 실기 워크숍에서 있었던 일처럼 검사를 재확인 하면서 반복된 원심침전으로 의도한 응집 강도 이상으로 답하게 된 기관이 있을 수 있다. 반대로 응집 강도 확인 시 지나치게 세게
비하여 항원의 구조적 차이로 인해 항원항체 반응이 다소 약하여 원심침전 후 응집이 풀릴 때 시험관을 흔드는 과정에서 정상 적혈구보다 영향을 더 많이 받을 수 있겠으나, 발송된 검체의 균질성이 확인된 검체들이었으므로 각 기관마다 원심침전 후 응집을 확인하는 방법이나 동일한 응집에 대하여 이를 판정하는 기준이 다를 가능성에 대한 검토 또한 필요할 것이다. 적혈구 응집 반응의 정확한 판독 이외에도 혈액형 판정 또한 중요한데 Aw kodecyte 의 항–A 시약에 대한 반응을 2+ 응집 이하, 항–H 시약에 대한 반응을 3+ 응집 이상으로 보고하면서도 A2 형으로 보고한 경우는 혈액형 판정 과정에 문제가 있어 추가 교육이 필요하다고 볼 수 있다. Bw kodecyte 를 AwB 형이라고 보고한 기관은 항–B 시약과 항–H 시약에 대한 반응만을 각각 3+ 응집으로 보고하였고 항–A 시약에는 응집 없음을 보고하였던 기관으로 사무적 착오에 의한 판정 오류로 생각되며, 수혈의학 검사실에서는 수기법으로 결과를 입력하는 경우가 많으므로 사무적 오류를 점검하는 단계 또한 매우 중요하며 실수가 없도록 주의를 요한다. 또한 바른 혈액형 판정의 훈련을 위해서는 정도관리물질을 혈구용 검사를 위한 적혈구 부유액의 형태만으로 제공할 것이 아니라 혈청형 혈액형 검사를 위한 검체를 함께 준비하도록 하는 것이 더 효과적일 것이다.
V. 결 론
본 연구 결과 정해진 조건 내에서 특정 농도의 FSL 용액을 이용하여 원하는 항원량을 표현하는 적혈구 kodecyte 를 재현성 있게 제조할 수 있음을 확인하였다. 정도관리 물질로서 실기 워크숍 참가자들에게는 ABO 아형 적혈구에서 관찰되는 3+ 응집 미만의 응집을 보이는 적혈구를 제공하여 효율적인 ABO 아형 판정 실습에 도움을 줄 수 있었고 여러 검사실에 외부정도관리 물질로서 발송하여 ABO 아형의 판정뿐만 아니라 항혈청 시약의 점검도 가능하게 하였다. 결론적으로 제조된 적혈구 kodecyte 는 국내 검사실 질 향상에 큰 도움을 줄 것으로 생각된다.참고문헌
1. 오흥범, 한규섭, 김병국, 한복연, 조한익: Bm 형 1 예. 대한수혈학회지 4: 97–101, 1993 2. 이자영, 오덕자, 박윤미: 국내 헌혈자 ABO 아형 빈도와 분포. 대한수혈학회지 21: 223–229, 2010 3. 임영애, 오진숙, 권석운, 권계철, 김신영, 박경운, 박현준, 송운흥, 조 덕, 엄태현, 이미경, 한상무: 혈액은행분과 신빙도조사 결과보고(2014). 임상검사와 정도관리 37: 47–55, 2015 4. 정옥주, 김문정, 정화령, 임아현, 김지연, 오덕자: 헌혈자에서의 ABO 혈액형 불일치 혈액의 유전자형 분석. 대한수혈학회지 15: 145–152, 2004 5. 조덕, 전미정, 송정원, 이진솔, 최현우, 권소영, 김수현, 신명근, 신종희, 서순팔, 양동욱: Avar (784G>A) 혈액형의 혈청학적 다양성 및 동반 ABO 대립유전자에 따른 표현형의 차이. 대한수혈학회지 17: 61–70, 2006 6. 황동희, 신보문, 이홍섭, 허미나, 한복연, 한규섭. Cis–AB 형 가계에서 비정상적인 표현형 1 예 : A 형과 O 형 부모에서 태어난 cis–AB 형 자녀. 대한수혈학회지 11: 169–175, 20007. Barr K, Korchagina E, Ryzhov I, Bovin N, Henry S: Mapping the fine specificity of ABO monoclonal reagents with A and B type–specific FSL constructs in kodecytes and inkjet printed on paper. Transfusion 54: 2477–2484, 2014
8. Burtis CA, Ashwood ER: Tietz Textbook of Clinical Chemistry. 3rd ed. Philadelphia, W.B.Saunders, pp.1674–1676, 1999
9. Cho D, Kim SH, Jeon MJ, Choi KL, Kee SJ, Shin MG, Shin JH, Suh SP, Yazer MH, Ryang DW: The serological and genetic basis of the cis–AB blood group in Korea. Vox
Sang 87: 41–43, 2004
10. Clausen H, Levery SB, Nudelman E, Tsuchiya S, Hakomori S. Repetitive A epitope (Type 3 chain A) defined by group A1–specific monoclonal antibody TH–1 : Chemical basis of qualitative A 1 and A2 distinction. Proc Natl Acad Sci USA 82: 1199–1203, 1985
11. Daniels G. Human blood groups. 3rd ed. Oxford, Wiley–Blackwell, 2013
12. Frame T, Carroll T, Korchagina E, Bovin N, Henry S: Synthetic glycolipid modification of red blood cell membranes. Transfusion 47: 876–882, 2007
13. Fung MK, Grossman BJ, Hillyer CD, Westhoff CM: Technical Manual. 18th ed.
Bethesda,American Association of Blood Banks, 2014
14. Garratty G: Modulating the red cell membrane to produce universal/stealth donor red cells suitable for transfusion. Vox Sang 94: 87–95, 2008
15. Goldstein J, Siviglia G, Hurst R, Lenny L, Reich L: Group B erythrocytes enzymatically converted to group O survive normally in A, B, and O individuals. Science 215: 168–170, 1982
16. Henry SM: Modification of red blood cells for laboratory quality control use. Curr Opin
Hematol 16: 467–472, 2009
17. Henry SM, Gilliver LG: Preparation of red blood cells with a modified level of blood group antigen expression and their use in the quality control of blood typing reagents.
18. Henry SM, Gilliver LG, Weinberg CS: Enzymatic modification of cell–surface H antigen by glycosyltransferases. World Intellectual Property Organisation patent, WO 2005121322, Cited May 6, 2016. http://www.google.ch/patents/WO2005121322A1?cl=en 19. Hult AK, Frame T, Chesla S, Henry S, Olsson ML: Flow cytometry evaluation of red
blood cells mimicking naturally occurring ABO subgroups after modification with variable amounts of function–spacer–lipid A and B constructs. Transfusion 52: 247–251, 2012
20. Jung BK, Choi GR, Chang JH, Cho HN, Hyun JJ, Nam MH, Lim C, Choi JS:
ABO*Ael03/O genotype with ABO discrepancy: the first case in Korea. Ann Lab Med 35:
137–140, 2015
21. Kang SJ, Lim YA, Baik S: Comparison of ABO antibody titers on the basis of the antibody detection method used. Ann Lab Med. 34:300–306, 2014
22. Marsh WL. Scoring of hemagglutination reactions. Transfusion 12: 352–3. 1972
23. Moiz B, Adil S, Suleman M: Transfusion medicine illustrated: B subgroup mistyped as O.
Transfusion 47: 753, 2007
24. Olsson ML, Irshaid NM, Hosseini–Maaf B, Hellberg A, Moulds MK, Sareneva H, Chester MA: Genomic analysis of clinical samples with serologic ABO blood grouping discrepancies: Identification of 15 novel A and B subgroup alleles. Blood 98: 1585–1593, 2001
25. Race RR, Sanger R. Blood groups in man. 6th ed. Oxford, Blackwell Scientific publications, 1975.
26. Scott MD, Murad KL, Koumpouras F, Talbot M, Eaton JW: Chemical camouflage of antigenic determinants: stealth erythrocytes. Proc Natl Acad Sci USA 94: 7566–7571, 1997
27. Svensson L, Rydberg L, Hellberg A, Gilliver LG, Olsson ML, Henry SM. Novel glycolipid variations revealed by monoclonal antibody immunochemical analysis of weak ABO subgroups of A. Vox Sang 89: 27–38, 2005
28. Wang B, Wang G, Zhao B, Chen J, Zhang X, Tang R: Antigenically shielded universal red blood cells by polydopamine–based cell surface engineering. Chem Sci 5: 3463–3468, 2014
29. Yazer MH, Hosseini–Maaf B, Olsson ML: Blood grouping discrepancies between ABO genotype and phenotype caused by O alleles. Curr Opin Hematol 15: 618–624, 2008
– ABSTRACT –
Modification of ABO antigens in quality control materials
Seon Joo Kang
Department of Laboratory Medicine The Graduate School, Ajou University
(Supervised by Professor Young Ae Lim)
The interpretation of variable results of blood group testing must be accurate to prevent potentially fatal consequences and to maintain laboratory confidentiality. So far, both quality control and proficiency testing (PT) of ABO subgrouping have been challenging with specimens from blood donors or volunteers because of antigenic diversity. The purpose of the present study was to explore whether modified blood red cells (RBCs) bearing synthetic analogs of blood group A or B antigens, Funtion–Spacer–Lipid (FSL) structure, can aid in quality control. The antigenicity of the modified RBCs (RBC kodecytes) were measured by hemagglutination assays and flow cytometry, and the storage periods of RBC kodecytes in several media were assessed. The quality control materials were evaluated in both a workshop and an educational trial of external PT. In tube test, RBC kodecytes exhibited agglutination grade of w+ to 4+ by reagent ABO antibodies; the cells were prepared in solution of 0.005 ‒ 0.04 mg/mL synthetic blood group A antigen (FSL–A) or