서론
골다공증은 ‘골량의 감소와 미세구조의 이상을 특징으로 하는 전신적인 골격계 질환으로, 결과적으로 뼈가 약해져서 부러지기 쉬운 상태가 되는 질환’으로 세계보건기구는 정의 하고 있다[1]. 골다공증은 과거 노화에 의한 성인의 질환으 로 인식되어 왔으나 현재는 그 기원이 소아청소년기에 부적 절한 골형성 및 골량의 축적에서 시작한다는 인식이 지배적 이다[2]. 골다공증의 위험인자로 고령화, 가족력, 흡수장애, 저체중, 칼슘섭취량의 감소 등 다양한 것들이 제기되고 있으 나 가장 중요한 것은 소아청소년기에 최대골량을 획득하지 못한데 기인한다[3]. 최대골량이란 개인이 평생 축적되는 골량의 최대치로 알 려져 있다[3]. 골량의 축적은 주로 소아청소년기에 이루어 지고 성인기 초기까지 이루어지며 이후 점차 감소한다. 최 대골량은 건강한 상태에서 약 70%는 유전에 의한 영양을 받 으며, 질병, 영양 및 운동 등 후천적 요인에 의해 변화될 수 있다. 한국 소아청소년에서 여아 18세(남아 19세)의 골량 및 골밀도는 20-30대 성인의 골량 및 골밀도와 차이가 없어 한 국인의 최대골량의 획득은 19세까지 이루어진다[4]. 소아청소년에서 일차성 골다공증은 매우 드문 질환이나 다른 만성질환의 경과 또는 그 치료에 의해 발생하는 이차성 골다공증은 증가하고 있는 추세이다[2,5]. 또한 소아청소년 골다공증은 소아청소년기뿐만 아니라 추후 성인기의 골절을 비롯한 골건강의 위험인자 이다[6].소아청소년기 골다공증의 원인과 진단 및 치료
임 중 섭 | 원자력병원 소아청소년과Causes, diagnosis, and treatment of pediatric
osteoporosis
Jung Sub Lim, MD
Department of Pediatrics, Korea Cancer Center Hospital, Seoul, Korea
Received: August 23, 2018 Accepted: September 4, 2018 Corresponding author: Jung Sub Lim
E-mail: limjs@kcch.re.kr © Korean Medical Association
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons. org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Osteoporosis was once thought to be a disease of the elderly. Now, there is universal agreement that osteoporosis has a pediatric origin. If individuals fail to achieve optimal peak bone mass and strength in childhood and adolescence, the development of osteoporosis later in life becomes more likely. Furthermore, increased knowledge and improved care for children with genetic disease and chronic illnesses has led to many children living long enough to develop osteoporosis and fractures even in childhood or adolescence. Thus, early interventions including nutrition, exercise, and pharmacological treatment are paramount. The objective of this review is to help clinicians diagnose and manage children at a high risk of osteoporosis. This article also reviews the latest advances in the treatment of pediatric osteoporosis including Korean experiences.
미래의 주역이 될 소아청소년의 골건강을 저해하는 위험 요소들을 조기발견하고 관리하는 것은 매우 중요하다. 저자 는 임상의로서 알아야 할 소아청소년에서 골다공증의 정의 및 진단방법, 원인질환, 관리 및 치료방법에 대한 최신지견 을 공유하고자 한다.
소아청소년 골다공증의 정의와 진단
소아청소년의 경우, 최근 International Society for Cli-nical Densitometry의 기준에 따라 다음 2가지 중 하나의 기 준을 충족할 때 골다공증으로 정의한다[7]. 1) Dual-energy X-ray absorptiometry (DXA) 검사상 저골밀도로 진단되고 장골의 비외상성 골절력이 3회 이상 발생되었을 때(단 10세 이하는 2회 이상); 2) 골밀도와 상관없이 1개 이상의 비외상성 척추골절이 발생할 경우이다. 저골밀도의 기준은 국가 또는 민족별 로 기준치가 다르며, 소아청소년은 성별, 연령별, 사춘기발달별로 표준화된 참고 치를 기반으로 Z-score ≤-2.0(정상 표 준치의 2SD 이하)일 때로 한다[4]. 현재 GE (Lunar) 모델과 Hologic 모델에 대한 국내 소아청소년 골밀도 표준 레퍼런스 가 발표되어 이용되고 있다[8,9]. 중등도 이상의 요통이나 비외상성 골 절(저충격 골절)로 내원하는 경우, 골절 부위와 흉요추(T-L spine)부위에 대한 일반 X-ray를 찍고, 소견상 골다공증이 의심되는 경우나 병력청취나 신체검진 상 골밀도 감소를 동반할 수 있는 질환 을 확인한 후 골밀도 검사를 시행한다. 일반 X-ray 상에서 골다공증의 소견이 보일 경우, 이미 골밀도의 30-50%의 소실이 있다는 사실을 명심해야 한다. 골밀도검사 방법에는 정량적 컴퓨터 단층촬영, 정량적 초음파와 DXA법이 있다. 정량적 컴퓨터단층촬영은 3차원 측정법으로 진정한 의미의 정량적 골밀도를 측정할 수 있으나 방사선 노출량 이 많고 성인과 소아에서 정상 표준데이터가 매우 부족하다 [4]. 정량적 초음파도 소아의 정상 표준데이터가 없다. 한편 DXA는 빠르고 정확하며 안전하고 재현성이 높을 뿐만 아니 라 추후 골절의 위험도를 평가할 수 있는 정량적 골밀도 측 정법의 대표적인 방법이다[4,7]. 또한 소아청소년에서 DXA 로 판정된 저골밀도는 추후 골절의 발생위험도와 관련이 있 다[10]. 한편 소아청소년에서는 척추 또는 머리를 제외한 전 신 부위를 DXA로 측정하는 것을 권고한다[4].
소아청소년 골다공증의 원인
소아청소년에서 골량의 감소와 골절위험도가 증가할 수 Table 1. List of diseases associated with low bone mass or fractures in children and adolescentsDisease
Primary Osteogenesis imperfecta Congenital brittle bones Marfan syndrome Ehlers-Danlos syndrome Homocystinuria Klinefelter syndrome Down syndrome (trisomy 21) Idiopathic juvenile osteoporosis Secondary
Endocrine disorders
Growth hormone deficiency Primary hyperparathyroidism Hypogonadism
Cushing syndrome Type 1 diabetes mellitus Chronic diseases
Neuromuscular diseases (celebral palsy, muscular dystrophy)
Rheumatic disorders (juvenile rheumatic arthritis, systemic lupus erythematosus, and others)
Renal disease (chronic renal failure, nephrotic syndrome) Inflammatory bowel disease
Liver disease
Malignancy (leukemia, lymphoma, brain tumors, osteosarcoma) Transplantation
Others
Iatrogenic disorders (glucocorticoid, anticonvulsants, chemotherapy, immunosuppressants, radiotherapy)
Nutritional disorders (malnutrition, malabsorption, vitamin D deficiency, calcium deficiency, anorexia nervosa, total parenteral nutrition) Immobilization
있는 질환에는 크게 유전질환, 내분비질환, 그리고 만성질환 의 합병증을 들 수 있다. 또한 소아청소년 골다공증은 크게 일차성과 이차성 골다공증으로 나뉜다(Table 1). 1. 일차성 골다공증 일차성 골다공증은 대개 유전질환이며 대표적인 질환이 골 형성부전증이다. 골형성부전증은 청색공막, 치아형성부전, 청 력소실, 인대이완증, 관절과잉신전, 혈관여림과 성장부전을 보인다. 이는 95%에서 제1형 콜라겐의 α 사슬의 형성에 관여 하는 COL1A1 또는 COL1A2 유전자의 돌연변이에 의해 발생 한다[11]. 골형성부전증양증후군은 골형성부전증과 골다공증 의 임상양상을 갖는 드문 질환들로 두개골조기융합증과 안구 돌출증을 동반한 Cole-Carpenter증후군, 관절구축을 동반하 고 PLOD2의 돌연변이에 의한 Bruck증후군, 그리고 LRP-5 의 돌연변이에 의한 osteoporosis-pseudoglioma증후군이 있 다[12]. 특발성 청소년 골다공증은 사춘기 전 소아에서 발병 되는 질환으로, 급성기에 환아는 척추와 장골의 다발성골절, 요통, 골변형, 보행장애와 성장저하를 보이며 골간단에 골다 공성 신성골이 출현한다[13]. 터너증후군은 에스트로젠 결핍, 골대사이상, 그리고 내인적 골질의 이상으로 골절률이 높다. 또한 정상 골밀도를 보이는 환아에서도 손목골절의 빈도가 높 은 것으로 알려져 있다. Marfan증후군, Ehlers-Danlos증후 군과 호모시스틴요증도 관절과 피부의 과잉신전과 골격계 이 상을 보이며 골밀도가 감소되고 골절률이 높다[14]. 2. 이차성 골다공증 최근 의학의 발달로 소아 만성질환의 장기 생존율이 증 가하여 소아청소년 골다공증이 증가하고 있다. 만성질환을 앓던 소아가 이차성 골다공증에 이환되는 이유는 만성염증, 질환 자체, 영양결핍 또는 흡수장애, 부동화 그리고 글루코 코르티코이드(gluco-corticoid) 등 치료에 의한 의인성 등의 다양한 조합때문에 발생한다[2,5,12]. 각종 호르몬의 과잉 또는 결핍에 의한 내분비질환은 이 차성 골다공증의 중요한 병적기전을 설명한다. 쿠싱증후군 이나 외인성 글루코코르티코이드 과잉노출은 소아청소년기 골량의 증가에 지장을 주며 특히 수질골에 영향을 준다. 글 루코코르티코이드 과잉은 직접적으로 장관에서 칼슘의 흡 수를 저해하며 골모세포 숫자와 기능을 감소시키고 간접적 으로 성선스테로이드의 형성을 저해와 근육량의 감소로 골 량의 증가에 지장을 준다[12]. 성장호르몬은 골의 모형화 와 재형성에 동화효과가 있다. 직접적으로 1-α 수산화효소 (hydroxylase)의 활성도를 증가시켜 1,25 비타민D의 생성 을 증가시켜 칼슘의 흡수에 관여하며, 간접적으로 근육량의 증가와 운동능력을 증가시켜 골량의 증가에 도움이 되나 결 핍 시 골다공증이 발생한다[12]. 부갑상선기능항진증은 부 갑상선선종, 복합내분비샘신생물, 만성신부전에서 나타날 수 있으며 부갑상선호르몬(parathyroid hormone, PTH) 이 과잉 분비되면 파골세포의 기능을 증가시켜 골량의 감 소를 야기한다[12]. 갑상선기능항진증 시 골교체율이 증가 되는데 상대적으로 골 흡수에 비해 골 생성기간을 감소시켜 피질골의 감소가 두드러진다. 또한, 갑상선중독증에는 PTH 와 1,25 비타민D의 생성이 감소되어 칼슘의 장관흡수를 감 소시키고 신장으로 배설을 증가시킨다. 성선과 부신에서 생 성된 남성호르몬은 골모세포의 증식과 분화 그리고 그 유전 자발현을 조절한다. 또한 남성호르몬과 여성호르몬은 성장 호르몬의 분비, IGF-1의 생성 그리고 성장판에서 성장인자 의 생성에 관여한다[12]. 골다공증을 야기하는 대표적인 만 성질환에는 신경근육질환, 소화기질환, 신장질환, 제한신경 성식욕부족증, 류마티스질환, 소아암, 그리고 이식 등이 해 당된다[5,12,15]. 뇌성마비 환자는 관절의 부분이탈을 포함한 다양한 골격이 상과 근육위축 등에 의한 운동장애로 골량의 증가에 필수적인 중력부하가 감소되어 있으며, 그 외 영양결핍과 항경련제의 사 용이 골다공증의 주 원인이다[16]. 염증장병(inflam-matory bowel disease, IBD) 성인에서 약 30-50% 정도 골감소의 소 견이 보이며 골절률을 높다. 또한, 소아청소년기에 발생하 면 최대골량의 획득에 문제가 있으며 척추골절의 위험도가 3.3배 증가한다[17,18]. 그 원인은 스테로이드 치료, 영양결 핍, 사춘기의 지연 또는 생식샘기능저하증, 비타민D 부족, 운 동부족 등의 다양한 원인에 기인하는 것으로 알려져 있다. IBD 환자가 진단시기에 이미 골다공증이 와있는 경우가 많아 IBD 가 기본적으로 염증성질환으로 이 염증의 진행 때문으로 생각
되며 IBD 환자 중 골다공증이 발생한 환자에서 interleukin-6 가 증가되어 있어 골다공증의 발병에 어떤 영향을 미칠 것으로 생각된다[12]. 한편 제한신경성식욕부족증의 경우 칼슘과 비 타민D의 섭취저하, 동반된 저생식샘자극호르몬생식샘기능저 하증 그리고 혈중 IGF-1의 감소가 원인이다[19]. 소아암은 소아청소년기 골절 및 골다공증의 위험요인일 뿐만 아니라 장기 생존자의 성인기 골다공증을 야기하여 삶 의 질을 저하시킨다. 백혈병, 임파종, 뇌종양의 치료 후, 성 인기에 골밀도의 감소는 잘 알려져 있다[20-22]. 예로 백혈 병은 진단 시 이미 7% 정도에서 병적 척추골절이 발견되며, 2년간의 항암치료 후, 83%에서 골밀도의 감소소견을 보이 고 약 39%에서 골절이 일어난다[23]. 이는 항암치료 과정 중, 환아는 영양결핍과 운동부족을 경험하고, 항암치료 자 체의 골독성으로 골밀도의 증가가 나타나지 않는다. 이식 후, 골절 및 골다공증의 발생률은 매우 높다[20,24]. 이식 의 대상이 만성질환의 가장 심한 상태에서 이루어지고, 스 테로이드나 사이클로스포린등의 면역억제재를 비롯한 의인 성 골다공증을 야기할 수 있는 치료가 적극적으로 사용되 기 때문이다. 끝으로 질병치료를 위해 사용되는 글루코코 르티코이드, methotrexate, 사이클로스포린, 해파린, 항경 련제, GnRH 유사체와 방사선 치료 등은 의인성골다공증을 야기한다[15].
골다공증의 예방과 치료
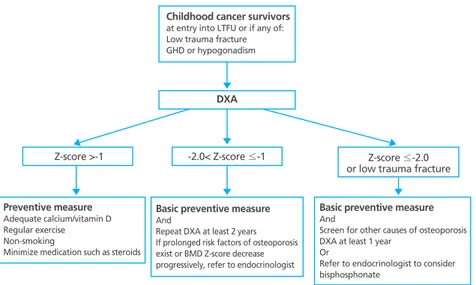
1. 목표 소아에서 골다공증과 골절은 병적상태 를 지속시키고 삶의 질을 저하시킨다. 치 료의 일차 목적은 척추를 포함한 골절을 예방하여 통증을 없애고 운동능력을 유 지하게 하는데 있다. 이차 목적은 척추 의 모양을 유지하여 추후 요통, 척추후 만, 부동화와 신장의 손실을 막아 정상적 인 최대골량의 획득과 성장이 이루어지 게 돕는데 있다. 이차성 골다공증의 원인이 유병된 질 환자체, 만성염증, 영양결핍, 부동화 그 리고 치료에 사용되는 약물 등의 각각 또는 상호악순환에 의 하므로 이를 교정하는 것이 치료의 기본 원칙이다. 특히 대표 적인 골다공증의 위험 질환인 소아암 환자에 대하여 2008년 Children’s Oncology Group은 생존 환아에 대한 장기관리 지침(long-term follow-up [LTFU] guidelines)을 제시하였 다[25]. 소아암 생존자는 골다공증의 위험인자인 내분비질환 을 동반, 글루코코르티코이드 등 골독성 약물을 사용한 과거 력, 또는 LTFU 관리에 참여할 경우, 기본적으로 DXA검사를 시행하고 골밀도 Z-score에 따라 관리 및 치료를 시행한다 (Figure 1) [20]. 2. 칼슘과 비타민 D 적절한 영양공급은 성장에 필수적이다. 특히, 적절한 칼 슘과 비타민D 섭취는 소아청소년기 골량과 골밀도 증가에 필수 적이다. 칼슘섭취량이 적은 중국인 소아에서 치료 후 유의한 골량과 골밀도의 증가가 관찰되었다[26]. 유제품 섭 취량이 많은 소아에서 더 높은 골량과 더 작은 골절률이 관 찰되었다. 또한 쌍생아에서 칼슘과 비타민D 보충은 골밀도 를 증가시키고 골강도를 강화시켰다[27]. 이에 Institute of Medicine에서는 8-18세의 칼슘 권장량을 1,300 mg/day로 하고 있다[28]. 또한 비타민D는 혈중 25(OH)-비타민D를 20 ng/mL 이상으로 유지하기 위해 600 IU를 권하고 있다.Childhood cancer survivors
at entry into LTFU or if any of: Low trauma fracture GHD or hypogonadism
DXA
Basic preventive measure
And
Screen for other causes of osteoporosis DXA at least 1 year
Or
Refer to endocrinologist to consider bisphosphonate
Z-score ≤-2.0 or low trauma fracture -2.0< Z-score ≤-1 Z-score >-1 Preventive measure Adequate calcium/vitamin D Regular exercise Non-smoking
Minimize medication such as steroids
Basic preventive measure
And
Repeat DXA at least 2 years If prolonged risk factors of osteoporosis exist or BMD Z-score decrease progressively, refer to endocrinologist
Figure 1. Algorithm to prevent osteoporosis in childhood cancer survivors. LTFU, long-term follow-up; GHD,
growth hormone deficiency; DXA, dual energy X-ray absorptiometry; BMD, bone mineral density. Reproduced from Kang MJ, et al. Korean J Pediatr 2013;56:60-67, according to the Creative Commons license [20].
최근 연구결과에 의하면, 한국 소아청소년의 평균 칼슘 섭 취량이 남아 510 mg(여아 431 mg)으로 62.3%가 권장량에 못 미친다. 또한 13.4%의 청소년이 혈중 25(OH)-비타민D 결핍소견을 보인다[29]. 이를 고려할 때 골건강을 위해 적극 적인 칼슘섭취가 모든 소아청소년에 권고된다. 특히 흡수장 애가 있거나 글루코코르티코이드 등의 치료를 받는 소아청 소년은 고용량의 칼슘 보충이 필요하며 비타민D는 1,500-2,000 IU가 필요하다. 3. 운동 소아기와 사춘기에 지속적인 체중부하운동은 골량과 골강 도를 증가시킨다[30]. 이러한 체중부하운동이 부족한 소아에 서 저골밀도와 골절의 위험도가 증가하는 것이 알려져 있다 [16]. 만성질환에 유병된 아이들은 특히 통증조절, 그리고 관 절의 안정성을 향상시키는 치료를 통해 저충격 중력부하 운 동을 규칙적으로 할 수 있게 하는 것이 필요하다. 4. 약물치료 골다공증이 심하거나 골절에 이환 된 환아의 경우, 칼슘 과 비타민D 그리고 운동만으로 치료는 부족하며 약물치료 가 병행되어야 한다. 새로운 골형성을 자극하는 치료로 합성 teriparatide가 성인에서 사용되고 있으나 동물실험상 골육 종을 야기할 수 있어 소아에서는 금기이다. 현재 골대사 전문가들은 심한 소아청소년 골다공증에서 골흡수 억제제인 비스포스포네이트의 사용을 정당화하는 추세이다. 비스포스포네이트는 파골세포의 활성도를 감소 시키고, 동원을 억제하며, 세포자멸사를 증가시켜 파골세포 의 골흡수를 감소시킨다[31]. 또한 골모세포를 활성화시켜 간접적으로 파골세포를 억제하는 효과도 있다. 현재 소아 에서 사용된 비스포스포네이트에는 pamidronate, zolan-dronate, alenzolan-dronate, residronate 등이 있으며, 국내에서 는 주로 경주용 pamidronate 제재에 대한 연구결과가 대 다수이다. Glorieux 등이 심한 골형성부전증 환아에서 4개월 간격 으로 3일간 pamidronate (0.5-1.0 mg/kg/day)을 사용하 여 골형성부전증 환아에서 통증의 감소, 골밀도의 증가, 골 절률의 감소와 활동량의 증가 보였으며, 치료 후 골절의 회 복과 결합에 영향을 미치지 않는다고 보고하였다[32]. 국내 에서도 Choi 등[33]이 골형성부전증 환자에서 pamidronate 를 사용 후 골밀도의 증가뿐만 아니라 골절의 발생빈도가 연간 2.3±1.01회에서 0.6±0.69회로 감소한다고 보고하 였다. 아직 대규모의 연구는 부족하지만 뇌성마비, 류마토 이드질환, 악성종양, 만성신부전, 이식, 고용량의 글루코코 르티코이드 등의 다양한 이차성 골다공증 환자에서 비스포 스포네이트 제재가 유효한 효과를 보이고 있다[34]. Moon 등[35]은 10명의 뇌성마비환아를 치료 후 골밀도의 증가뿐 만 아니라 골절의 발생빈도가 감소함을 보고 하였다. Kim과 Cho [36]는 신질환이 있는 44명에서 환아에서 pamidronate 가 고용량스테로이드에 의한 골다공증을 예방함을 보였다. 특히 pamidronate 치료를 받은 환아들에서 통증의 감소, 골 밀도의 증가, 골절률의 감소가 관찰되었고 현재까지 심각한 부작용이 발생하지 않았다. 소아의 경우 경주용 비스포스포네이트 제재의 가장 흔한 부작용은 급성기 반응으로 약 70% 정도에서 치료 만 3일째 체온의 증가와 심한 몸살을 앓는다. 지속시간은 약 24시간 이고 부루펜이나 경구용 스테로이드제재에 잘 조절된다. 또 한 일시적인 저칼슘혈증이 20% 정도에서 나타나며, 대부분 에서 칼슘과 비타민D 전 처치로 해결될 수 있다[12,37]. 장 기적인 안전성의 경우 미세골손상축적, 수술 시 골절치료의 지연과 부정유합의 발생, 성장판의 손상과 성장장애, 그리고 산모에서 태아에의 기형유발이 있을 수 있으나 임상상 실제 사용중인 비스포스포네이트 용량에서 약 20년간 문제가 되 지 않았다[31]. 또한 성인에서 보고되었던 턱뼈의 뼈괴사소 견과 동물실험에서 보고된 기형유발작용도 현재까지 관찰되 지 않았다. 한편 소아에서 비스포스포네이트를 치료하면 마 치 나이테모양으로 성장판의 근위부에 경화선이 나타난다. 이는 성장판 주위의 골형성 부위의 상대적인 골 형성량의 증 가 때문으로 여겨지며 치료 종료 후 점진적으로 감소하다 사 라지는 것으로 알려져 있다. 경구용 비스포스포네이트 제재 의 경우, 두통, 설사나 변비, 소화불량, 부식식도염 등의 부 작용은 발생할 수 있다. 최근에는 비약물적 치료인 전신 진동기가 근력을 증가시
켜 골밀도를 늘이는 방법으로 뇌성마비 환아에서 시도되고 있다[38]. 약물치료로는 근육량과 골밀도를 증진시킬 것으로 기대되는 성장호르몬을 비스포스포네이트와 병행해서 심한 골형성부전증 환아에서 시도되고 있다[39]. 또한 최근 성인 에서 안전성이 검증된 RANKL-단일항체인 denosumab가 소아에서 다기관연구되고 있다[5].
결론
소아청소년에서 일차성 골다공증은 매우 드문 질환이나 다 른 만성질환의 경과 또는 그 치료에 의해 발생하는 이차성 골 다공증은 증가하고 있는 추세이다. 소아청소년기는 최대 골 량을 획득하는 시기이다. 만성질환 자체와 그 치료의 부작용 으로 인한 부적절한 최대 골량의 획득은 차후 성인기의 골다 공증과 그로 인한 골절로 이어진다. 이들에 있어서 주기적인 골밀도의 측정과 칼슘 및 비타민D의 섭취량을 파악하고 부 족 시 보충하는 것이 중요하며 적절한 체중부하운동을 통하 여 최대골량을 획득하는데 관심을 가져야 할 것이다. 한편 통 증과 골절 등으로 식이와 운동만으로 치료할 수 없는 소아청 소년 골다공증 환자에서 비스포스포네이트 제재의 사용이 필 요하다. 찾아보기말: 소아청소년; 골절; 골다공증; 최대골량 ORCIDJung Sub Lim, https://orcid.org/0000-0001-9560-8921
REFERENCES
1. Riggs BL, Melton LJ. Osteoporosis: etiology, diagnosis, and management. New York: Raven Press; 1988.
2. Ma NS, Gordon CM. Pediatric osteoporosis: where are we now? J Pediatr 2012;161:983-990.
3. Heaney RP, Abrams S, Dawson-Hughes B, Looker A, Marcus R, Matkovic V, Weaver C. Peak bone mass. Osteoporos Int 2000;11:985-1009.
4. Lim JS. Pediatric dual-energy X-ray absorptiometry: inter-pretation and clinical and research application. Korean J Pedi-atr 2010;53:286-293.
5. Saraff V, Hogler W. Endocrinology and adolescence: Oste-oporosis in children: diagnosis and management. Eur J Endo-crinol 2015;173:R185-R197.
6. Osteoporosis prevention, diagnosis, and therapy. NIH Con-sens Statement 2000;17:1-45.
7. Bishop N, Arundel P, Clark E, Dimitri P, Farr J, Jones G, Makitie O, Munns CF, Shaw N; International Society of Clini-cal Densitometry. Fracture prediction and the definition of osteoporosis in children and adolescents: the ISCD 2013 Pediatric Official Positions. J Clin Densitom 2014;17:275-280. 8. Lim JS, Hwang JS, Lee JA, Kim DH, Park KD, Cheon GJ, Shin
CH, Yang SW. Bone mineral density according to age, bone age, and pubertal stages in Korean children and adolescents. J Clin Densitom 2010;13:68-76.
9. Yi KH, Hwang JS, Kim EY, Lee JA, Kim DH, Lim JS. Reference values for bone mineral density according to age with body size adjustment in Korean children and adolescents. J Bone Miner Metab 2014;32:281-289.
10. Goulding A, Jones IE, Taylor RW, Manning PJ, Williams SM. More broken bones: a 4-year double cohort study of young girls with and without distal forearm fractures. J Bone Miner Res 2000;15:2011-2018.
11. Venturi G, Tedeschi E, Mottes M, Valli M, Camilot M, Viglio S, Antoniazzi F, Tato L. Osteogenesis imperfecta: clinical, biochemical and molecular findings. Clin Genet 2006;70:131-139.
12. Lim JS. Treatments of osteoporosis in pediatric fields. J Korean Soc Pediatr Endocrinol 2006;11:138-147
13. Krassas GE. Idiopathic juvenile osteoporosis. Ann N Y Acad Sci 2000;900:409-412.
14. Lim JS, Lee DH. Changes in bone mineral density and body composition of children with well-controlled homocystinuria caused by CBS deficiency. Osteoporos Int 2013;24:2535-2538. 15. Ward LM, Glorieux FH. The spectrum of pediatric osteopo-rosis. In: Glorieux FH, Pettifor JM, Juppner H, eds. Pediatric bone: biology and disease. Boston: Academic Press; 2003. p. 401-441.
16. Jung KJ, Kwon SS, Chung CY, Lee KM, Sung KH, Cho BC, Chung MK, Moon SJ, Kim J, Park MS. Association of gross motor function classification system level and school attendance with bone mineral density in patients with cerebral palsy. J Clin Densitom 2016 Oct 11 [Epub]. https:// doi.org/10.1016/j.jocd.2016.09.002.
17. Laakso S, Valta H, Verkasalo M, Toiviainen-Salo S, Makitie O. Compromised peak bone mass in patients with inflammatory bowel disease: a prospective study. J Pediatr 2014;164:1436-1443.
18. Kyriakou A, Shepherd S, Mason A, Ahmed SF. Prevalence of vertebral fractures in children with suspected osteoporosis. J Pediatr 2016;179:219-225.
19. Soyka LA, Grinspoon S, Levitsky LL, Herzog DB, Klibanski A. The effects of anorexia nervosa on bone metabolism in female
adolescents. J Clin Endocrinol Metab 1999;84:4489-4496. 20. Kang MJ, Lim JS. Bone mineral density deficits in childhood
cancer survivors: Pathophysiology, prevalence, screening, and management. Korean J Pediatr 2013;56:60-67.
21. Choi YJ, Park SY, Cho WK, Lee JW, Cho KS, Park SH, Hahn SH, Jung MH, Chung NG, Cho B, Suh BK, Kim HK. Factors related to decreased bone mineral density in childhood cancer survivors. J Korean Med Sci 2013;28:1632-1638.
22. Kang MJ, Kim SM, Lee YA, Shin CH, Yang SW, Lim JS. Risk factors for osteoporosis in long-term survivors of intracranial germ cell tumors. Osteoporos Int 2012;23:1921-1929. 23. Atkinson SA, Halton JM, Bradley C, Wu B, Barr RD. Bone
and mineral abnormalities in childhood acute lymphoblastic leukemia: influence of disease, drugs and nutrition. Int J Can-cer Suppl 1998;11:35-39.
24. Fratzl-Zelman N, Valta H, Pereira RC, Misof BM, Roschger P, Jalanko H, Wesseling-Perry K, Klaushofer K, Makitie O. Abnormally high and heterogeneous bone matrix minerali-zation after childhood solid organ transplantation: a complex pathology of low bone turnover and local defects in minerali-zation. J Bone Miner Res 2017;32:1116-1125.
25. Children’s Oncology Group. Long-term follow-up guidelines for survivors of childhood, adolescent, and young adult cancers, ver. 4.0 [Internet]. Philadelphia: Children’s Oncology Group; c2018 [cited 2018 Jun 15]. Available from: http:// survivorshipguidelines.org/.
26. Lee WT, Leung SS, Wang SH, Xu YC, Zeng WP, Lau J, Oppenheimer SJ, Cheng JC. Double-blind, controlled calcium supplementation and bone mineral accretion in children accustomed to a low-calcium diet. Am J Clin Nutr 1994;60: 744-750.
27. Greene DA, Naughton GA. Calcium and vitamin-D supple-mentation on bone structural properties in peripubertal female identical twins: a randomised controlled trial. Oste-oporos Int 2011;22:489-498.
28. Ross AC, Taylor CL, Yaktine AL, Del Valle HB. Dietary refe-rence intakes for calcium and vitamin D. Washington, DC: The National Academies Press; 2011.
29. Kim SH, Oh MK, Namgung R, Park MJ. Prevalence of 25-hydroxyvitamin D deficiency in Korean adolescents: asso-ciation with age, season and parental vitamin D status. Public Health Nutr 2014;17:122-130.
30. Bass SL, Saxon L, Daly RM, Turner CH, Robling AG, Seeman E, Stuckey S. The effect of mechanical loading on the size and shape of bone in pre-, peri-, and postpubertal girls: a study in tennis players. J Bone Miner Res 2002;17:2274-2280.
31. Russell RG. Bisphosphonates: mode of action and pharmaco-logy. Pediatrics 2007;119 Suppl 2:S150-S162.
32. Glorieux FH, Bishop NJ, Plotkin H, Chabot G, Lanoue G, Travers R. Cyclic administration of pamidronate in children with severe osteogenesis imperfecta. N Engl J Med 1998;339: 947-952.
33. Choi JH, Shin YL, Yoo HW. Short-term efficacy of monthly pamidronate infusion in patients with osteogenesis imper-fecta. J Korean Med Sci 2007;22:209-212.
34. Lee J, Yoon J, Lee YA, Lim JS, Shin CH, Yang SW. Pamidronate therapy in children and adolescents with secondary osteopo-rosis. J Korean Soc Pediatr Endocrinol 2011;16:178-184. 35. Moon SJ, An YM, Kim SK, Kwon YS, Lee JE. The effect of
low-dose intravenous bisphosphonate treatment on osteopo-rosis in children with quadriplegic cerebral palsy. Korean J Pediatr 2017;60:403-407.
36. Kim SD, Cho BS. Pamidronate therapy for preventing steroid-induced osteoporosis in children with nephropathy. Nephron Clin Pract 2006;102:c81-c87.
37. Ward L, Tricco AC, Phuong P, Cranney A, Barrowman N, Gaboury I, Rauch F, Tugwell P, Moher D. Bisphosphonate therapy for children and adolescents with secondary osteoporosis. Cochrane Database Syst Rev 2007;(4):CD005324. 38. Wren TA, Lee DC, Hara R, Rethlefsen SA, Kay RM, Dorey FJ,
Gilsanz V. Effect of high-frequency, low-magnitude vibration on bone and muscle in children with cerebral palsy. J Pediatr Orthop 2010;30:732-738.
39. Antoniazzi F, Monti E, Venturi G, Franceschi R, Doro F, Gatti D, Zamboni G, Tato L. GH in combination with bis-phosphonate treatment in osteogenesis imperfecta. Eur J Endocrinol 2010;163:479-487.
Peer Reviewers’ Commentary
골다공증은 노화에 따른 성인 질환으로 인식되어 왔으나, 최근 에는 소아청소년에서 내분비 질환에 의한 이차성 골다공증이 증 가하고 있다. 소아청소년기 골다공증과 같은 골대사 이상은 성 인기의 골 건강에 영향을 미칠 수 있기 때문에 골다공증의 예방 과 치료가 중요하다. 이 논문은 소아청소년기 골다공증의 정의를 International Society for Clinical Densitometry (ISCD) 기준에 따 라 제시하고 있으며, 적절한 골밀도 측정 부위와 방법 및 골밀도 에 따른 진단적 접근 방법 등을 체계적으로 설명하고 있다. 또한 소아청소년기 골다공증의 약물 치료뿐만 아니라, 적절한 영양 공 급과 운동 방법을 제시하여 골다공증 예방의 중요성을 강조하고 있다. 소아청소년기 골밀도에 대한 국내 표준 참고치나 골다공증 에 대한 연구가 부족한 상황에서 소아청소년기 골다공증에 대한 이해를 돕고, 골대사 질환들에 대한 관심과 연구를 증진시키는데 이 논문은 많은 도움이 될 것으로 판단된다. [정리: 편집위원회]