항노화 기술의 연구 사례 및 기술 동향 이기백 Page 1 / 10 BRIC View 2021-T26
항노화 기술의 연구 사례 및 기술 동향
이 기 백
서울대학교 의과대학E-mail: lkb3431@snu.ac.kr
요약문 인간의 기대 수명이 증가함에 따라 노화 연관 질환의 발병률이 증가하고 있다. 최근 연구 결과에 의하면, 개체의 나이가 들어감에 따라 체 내에 노화된 세포의 양은 증가하며, 이렇게 증가된 노화 세포는 직접적으로 노인성 질환에 관련이 있다는 보고되고 있다. 마우스를 이용한 동물 실험에서 노화 세포를 제거할 수 있는 기술은 건강 수명 및 노화 연관 질환에 개선을 나타내며, 이는 인간의 질환 및 수명에도 긍정적인 결과를 나타낼 수 있다는 가능성을 보여주고 있다. 노화 세포의 직접적인 제거 혹은 노화 세포의 부정적인 기능을 억제시키는 전략은 기존에 다양한 질환에서 효과를 나타낼 것이라고 기대를 하고 있다. 본 글에서는 최신 항노화 기술의 연구 사례에 대해 서술하고 현재의 상황에 대해 정리해보고자 한다.Key Words: Cellular senescence, Aging, Age-related diseases, Anti-aging research, Senolytics,
Senomorphics
목 차
1. 서론 2. 본론 2.1. 노화 연관 질환에서의 새로운 치료책 & 노화 치료제(Senotherapeutics) 2.1.1. Senolytics 2.1.2. Senomorphics 2.2. 노화 치료제의 국외 임상시험 현황2.3. 다른 항노화 치료 연구들(Other anti-aging interventions) 2.3.1. 식이 제한(Caloric restriction, CR) 2.3.2. 병체 결합(Parabiosis) 2.3.3. 조로증 마우스 모델에서의 유전자 교정술 3. 결론 4. 참고문헌 BRIC View 동향리포트
항노화 기술의 연구 사례 및 기술 동향 이기백 Page 2 / 10
1. 서론
개체 수준의 노화(Aging)는 노화에 따른 육체적 손실, 기능적 저하 그리고 각 종 노화 연관 질환을 수반한다. 이러한 개체 수준의 노화를 이해하기 위해서는 세포 수준의 노화를 이해하는 것이 필수적이며, 최근의 연구 결과들은 세포 노화의 중요성에 대해 언급하고 있다.
세포 노화(Cellular senescence)는 계대 배양 스트레스(텔로미어의 축소), 방사선(Radiation), 항암 화학 요법(Chemotherapy), 암 유발 유전자 활성화(Oncogene activation), 산화 스트레스 (Oxidative stress)와 같은 다양한 자극에 의해 유도되며 지속적인 세포 성장 정지(Stable cell cycle arrest) 상태를 일컫는다. 노화된 세포는 다양한 스트레스에 의해 DNA damage가 축적되고 세포 내 여러 소기관들의 기능이 감소되며, 다양한 신호 전달 체계 및 대사 과정에도 변화가 일어나는 것으 로 알려져 있다. 이러한 노화된 세포는 노화 세포 특이적인 사이토카인(Cytokine) 및 케모카인 (Chemokine)들을 분비하게 되는 데, 이를 “노화 연관 분비 표현형(Senescence-associated secretory phenotype, SASP)”이라 부르며, 이는 자가 분비 신호 전달(Autocrine signaling) 혹은 측분비 신호 전 달(Paracrine signaling)을 통해 세포 노화를 가속화하거나, 주변 세포의 노화를 촉진하기도 한다.
무한 증식하는 암세포와 달리 정상 세포의 경우, 40-60회의 세포 분열을 진행하다가 세포 성 장 곡선이 완만해지면서, 세포 노화에 접어들게 되는데, 이를 “Hayflick limit”라 일컫는다. 이러한 개 념은 1961년도에 Leonard Hayflick과 Paul Moorhead에 의해 최초로 제안되었다 [1]. 그러나, 당시에 많은 학자들은 이러한 현상을 생리학적으로 이상적이지 않은 세포 배양 조건으로 인한 인위적인 결 과물(Artefact)가 아니냐며 쉽게 받아들이지 않았다. 이후에 약 50여 년간 많은 학자들이 노화 연구 를 지속하여, 세포 노화는 개체 노화(Aging) 및 노화 연관 병리(Age-related pathologies)와 연관성이 있을 것이라는 주장을 해왔는데, 이를 뒷받침할 수 있는 직접적인 근거가 나오게 되었다. 2011년에 Van Deursen 그룹은 노화 세포의 제거는 노화 연관 질환들을 지연될 수 있다는 연구 결과를 발표 [2]하였으며, 이는 기존의 노화 연구 및 항노화 전략에 있어서 새로운 방향성을 제시하였다.
연구 내용을 살펴보면, 이들 연구진은 노화 세포 특이적인 마커를 이용한 표적 시스템을 구 축하였다. 노화 세포에서 나타나는 다양한 특이적인 마커 중 p16Ink4a 단백질은 노화 세포에서 많이 증가되어 있으며, Rb tumor-suppressor pathway를 통해 세포 주기 정지(Cell cycle arrest)를 촉진하는 것으로 알려져 있다. 개체 노화 과정 중에도 p16Ink4a 단백질의 발현량은 증가되어 있으며, 노화 연관 질환에도 연관성이 있다는 연구 결과들이 잘 나와 있다 [3]. 개체 노화 및 체내 기관들의 기능적 저 하에 있어서 노화 세포의 역할을 보여주기 위해 minimal p16Ink4a promoter에 Caspase-8 및 형광을 나타내는 유전자를 표지(Tagging)한 형질 전환 유전자(Transgene) (“INK-ATTAC “라 명명)을 제작하였 으며, 이 형질 전환 유전자가 들어간 세포는 노화가 되어 p16Ink4a 발현 시, 특이적인 약물에 반응하 여 caspase-8에 의한 세포 사멸을 일으키며, 형광을 이용한 노화 세포의 추적 관찰이 가능한 시스템 을 구축하였다 [2]. 이러한 형질 전환 유전자가 삽입된 형질 전환 마우스와 BubR1 조로증 마우스와 의 교배를 통해 BubR1 조로증 마우스 기반의 이형 접합 마우스(Heterozygous mouse)를 생산하였다. 이러한 이형 접합 형질 전환 마우스는 골격근(Skeletal muscle), 눈(Eye), 지방(Fat)과 같은 조직에서 노화 연관 질환의 발병을 유의미적으로 늦추며 외형적으로 좀 더 젊은 마우스의 모습을 가지는 것 으로 나타났다. 그리고 같은 그룹에서 후속 연구로써, INK-ATTAC 마우스를 이용한 자연 노화 모델에 서의 실험이 이루어졌다 [4]. 이러한 마우스를 자연 노화시킨 후, 노년기에 접어든 마우스에서
항노화 기술의 연구 사례 및 기술 동향 이기백 Page 3 / 10 p16Ink4a 양성(Positive)인 노화 세포의 제거를 일으킨 결과, 암 발생뿐만 아니라, 골격근, 눈, 지방 같 은 조직에서 이미 진행 중이었던 노화 연관 질환의 진행을 늦추는 등의 건강 수명(노화에 따른 기능 저하 및 만성 질환이 나타나지 않는 좋은 건강 상태를 유지하는 기간)이 늘어나는 것을 확인하였다. 또한, 이와 유사한 모델로서, 2014년에 Judith Campisi 그룹에 의해 p16 promoter에 3개의 리포터 유전자(Reporter gene)를 결합한 삼중 융합 단백질(Trimodal fusion protein)을 생성하는 마우스를 제 작하여, 노화 세포의 제거 및 추적이 가능한 모델도 만들었다 [5]. 이러한 마우스 모델들 덕분에 다 양한 노화 연관 질환 모델에서 노화 세포 제거 연구가 가능해졌다. 하지만, 이러한 연구와 더불어, 1) 노화된 세포가 어떻게 노화에 따른 기능 장애(Age-related dysfunction)를 촉진할 수 있는지, 2) 노화된 세포들이 나이가 들어감에 따라 생체 내 기관들에 왜 축적이 되는지, 3) 특수한 경우에 생기는 노화 세포들 또한 이러한 노화 연관 병리에 관여하는지, 4) 실제 인간의 노화에서도 적용이 가능한지 등에 관한 후속 연구가 필요한 상황이기는 하다. 그럼에도 불구하고, 노화 세포를 표적 하여 제거하는 전략은 건강 수명 및 노화 연관 질환에 있어서 효과적인 치료책일 수 있다는 가능성을 보여주고 있으며, 새로운 항노화 전략으로 제시되고 있다. 필자는 본 글에서 노화 세포 제거에 대한 연구와 더불어 다양한 항노화 연구 사례에 대해 전달하고자 한다.
2. 본론
2.1. 노화 연관 질환에서의 새로운 치료책 & 노화 치료제(Senotherapeutics)
개체의 나이가 들어감에 따라, 생체 내 기관들에 노화된 세포가 많이 축적이 된다고 알려져 있다. 또한, 암(Cancer), 섬유화 질환(Fibrosis), 알츠하이머(Alzheimer’s diseases), 관절염(Arthritis), 죽 상 경화증(Atherosclerosis), 망막 변성(Retinal degeneration)과 같은 노화 연관 질환에서도 노화 세포 는 증가하여 있다고 알려져 있다. 노화 세포를 제거하는 것은 효과적인 노화 연관 질환들의 치료책 이 될 수 있다는 연구 결과 덕분에, 다양한 연구진들과 세계적인 바이오테크 기업들이 노화 세포를 선택적으로 제거할 수 있는 항노화 전략들을 앞다투어 연구하고 있다. 구글의 자체 벤처 기업인 Calico와 미국의 노화 전문가들이 설립한 Unity Biotechnology와 같은 많은 바이오테크 기업들은 인 류의 건강 수명을 늘리기 위한 연구를 지속하고 있으며, 노화 세포를 타겟으로 하는 저분자 약물 (Small molecule), 유전자 치료(Gene therapy), 항체 치료 등 다양한 치료책들을 제시하고 있으며 전 임상 및 임상 시험에 돌입하고 있는 상황이다 [6]. 노화 세포를 치료 타겟으로 하는 전략은 “노화 치료제(Senotherapeutics)”라 명명하고 있으며, 이 전략은 크게 두 가지로 나뉠 수 있다. 하나는 화학 약물들을 이용하여 노화 세포를 직접적으로 제거하는 방식을 “Senolytic”이라 부르고 노화 세포로 인해 나타나는 부정적인 역할(ex. 노화 세포에 서 분비되는 SASP로 인한 주변 세포의 노화 가속화)을 억제하는 방식을 “Senomorphic”이라 부른다 [7]. 이러한 두 종류의 노화 치료 전략은 건강 수명을 증가시키고, 나아가 수명 연장의 가능성도 바 라보고 있다.항노화 기술의 연구 사례 및 기술 동향 이기백 Page 4 / 10 그림 1. 노화 세포를 표적 하는 항노화 전략.
2.1.1. Senolytics
Senolytic은 Senescence로부터 나온 ‘seno-‘와 lysis를 의미하는 ‘-lytic’의 합성어이다. 1세대 Senolytic에 관한 연구는 노화 세포에서 나타나는 특징 중 하나인 세포 사멸 저항성(Apoptosis re-sistance)을 이용하였다. 노화 세포는 젊은 세포와는 달리 주변 스트레스 및 세포 사멸(Apoptosis)을 유발할 수 있는 자극에 저항성을 가진다고 알려져 있다. 2015년 James L. Kirkland 그룹은 정상 분열 하는 일반 세포와 노화 세포에서 RNA sequencing을 통해 유전자 프로파일링(Profiling)을 진행하였고, 노화된 세포에서는 PI3K/Akt 신호 전달에 관여하는 인자들과 세포 사멸 저항성을 나타낸다고 알려진 pro-survival한 Bcl-2 family들이 증가해 있음을 보여줬다. 이러한 발견을 통해, 노화 세포에서 증가된 유전자들은 억제하고, 세포 사멸을 유도할 수 있는 약물인 Dasatinib (Tyrosine kinase inhibitor)과 Flavonoid로 더 잘 알려진 Quercetin을 이용한 Senolytic 약물을 찾을 수 있었다 [8]. Dasatinib과 Quercetin은 일부 노화 세포에서 효과적이었으며, 두 약물의 조합(D+Q combination)은 노화된 마우 스에서 일부 노화 연관 표현형들의 완화를 나타내었고, 이는 Senolytics의 건강 수명 증가에 적용할 수 있는 가능성을 보여주었다. 같은 그룹에서 2016년도에 Bcl-2 family inhibitor인 Navitoclax도 Senolytic 약물로서의 기능을 보고하였다 [9]. 그러나, 이 마저도 일부 노화 세포에서만 Senolytic 효 과를 나타냈다. 즉, 세포 사멸 저항성을 나타내는 노화 세포에서 Survival pathway만을 표적화 해서 는 Senolytic 효과를 나타내는데 한계가 있으며, 추가적으로 다른 신호 전달 체계를 표적화하는 시도 가 필요한 상황이다.
이 후 Senolytics 관련한 연구들은 노화 연관 질환들에 적용해보는 것으로 확장되었다. D+Q 조합은 신경 퇴행성 질환(Neurodegenerative diseases), 특발성 폐섬유증(Idiopathic pulmonary fibro-sis), 간 섬유화증(Liver fibrofibro-sis), 죽상 경화증(Atherosclerofibro-sis), 골관절염(Osteoarthritis), 심장 기능 장
항노화 기술의 연구 사례 및 기술 동향 이기백 Page 5 / 10 애(Cardiac dysfunction)에 있어서, 질병 정도를 완화하는 등의 치료 효과를 나타냈다 [10]. 또한, Bcl-2 family를 억제하는 ABT-737, A133185Bcl-2, A1155463가 개발되었으며 [11], 간 섬유화증 및 간 지방증 (Hepatic steatosis)에 효과를 나타냈다. 다른 Survival pathway를 표적화하는 약물도 개발되었다. 이는 Foxo4가 p53의 핵으로의 이동을 유도해 미토콘드리아 유래 세포사멸 기전(Mitochondrial apoptosis pathway)을 억제하는 데에 착안하여 Foxo4 inhibitor peptide (FOXO4-DRI)를 개발하였다. 이는 노화 세포를 감지하고 세포 사멸을 유도하였으며, 노화된 쥐에서 근육 감소증(Sarcopenia frailty), 신장 기 능 장애(Renal dysfunction), 털 밀집도(Hair density) 등에 효과를 나타냈다 [12]. 이 밖에도 최근 시국 과 관련된 연구도 발표되었다. COVID-19가 세계적 유행 감염병(Pandemic)인 상황에서 Senolytics는 노화된 쥐에서 코로나 바이러스와 관련된 사망률을 낮춘다는 보고가 나왔다 [13]. 고령이거나 만성 질환을 앓고 있는 사람들은 코로나 바이러스에 좀 더 취약하다고 알려져 있으며, 이러한 사람들은 체 내에 노화 세포가 많이 축적된다고 알려져 있다. 노화 마우스 모델에 SARS-CoV-2-related mouse β-coronavirus pathogen을 노출시키기 전 또는 후에 Senolytic 약물치료를 시행하면 사망률이 확연 하게 감소하였다고 보고하였다.
최근에는, Survival pathway를 표적화하는 것 외에도 다른 접근 방식의 Senolytics도 개발되었 다. 먼저, 노화 세포에서 나타나는 가장 큰 특징 중 하나인 Senescence-associated β-gal activity를 활용한 방법이다. 노화 세포에서 Lysosomal β -galactosidase activity가 증가되어 있는 것을 이용하 여 약물에 β-gal responsive moiety를 부착하거나 [14] Galacto-oligosaccharides로 약물을 감싸는 방 식 [15]으로 개발하였다. 이를 통해 노화 세포 특이적인 Senolytics를 개발할 수 있었고 노화 연관 질환에도 효과적임을 보여줬다. 다음으로는, 요즘 면역학 분야에서 큰 관심을 받고 있는 Chimeric antigen receptor T cell (CAR-T)를 이용한 치료 전략이다 [16]. 이 방식은 “Urokinase-type plasmino-gen activator receptor (uPAR)”이라고 하는 세포 표면 단백질(Cell surface protein)이자 세포 노화 시 증가되는 단백질을 이용하여 uPAR-specific CAR-T 시스템을 만들었고, 이는 in vitro 및 in vivo에서 Senolytic 효과를 잘 나타냈다. 이 외에도 독성이 낮으며, 과일과 야채에 많이 존재하는 Flavone으로 알려진 Fisetin은 Human umbilical vein endothelial cells(HUVECs)로 만든 세포 성장이 멈춘 노화 세 포에서는 세포 사멸을 유도하는 반면에, 정상적으로 성장하는 HUVECs 세포에서는 그렇지 않았다 [17].
현재까지 나온 Senolytics는 저마다의 한계점을 가지고 있다. 기존 약물 기능 재배치(Drug repositioning), Drug combination 효과 및 노화 세포에서 새로운 신호 전달 체계를 표적화하는 등의 노력이 필요한 상황이다.
2.1.2. Senomorphics
노화 세포의 해로운 기능을 억제할 수 있는 또 다른 전략은 노화 연관 분비 표현형(SASP)의 억제를 통해서 가능하며, 이를 “Senomorphics”라 부른다. SASP는 2008년도에 최초로 제안되었으며 [18], 이는 노화 세포에서 나타나는 대표적인 특징 중 하나가 되었다. SASP는 다양한 사이토카인, 케 모카인, Protease, Growth factor와 같은 인자들로 구성되어 있으며 이는 주변 세포 혹은 미세 환경에 긍정적 혹은 부정적인 영향을 끼친다고 알려져 있다. 이러한 노화 세포 특이적인 분비 물질들은 세 포 유형(Cell type)과 노화를 유도하는 자극에 따라 다르다고 알려져 있다 [18, 19]
항노화 기술의 연구 사례 및 기술 동향 이기백 Page 6 / 10 노화 세포로부터 분비된 SASP의 다양한 조절자에 대한 연구가 이루어지고 있으며, Seno-morphics는 SASP 조절자들에 의한 신호 전달 기전을 타겟으로 하는 약물들이 많이 알려져 있다 [20]. 이러한 타겟 신호 전달 기전에는 p38 MAPK, NF-kB, IL-1α, mTOR, PI3K/AKT, ROS 등이 있으며, 주로 SASP 인자들의 전사(Transcription), 번역(Translation), mRNA 안정성(Stability) 등을 조절하는 것 으로 알려져 있다. 이러한 Senomorphics는 특성상 지속적인 투여를 필요로 하게 되는데, 가장 큰 단 점은 SASP는 여러 가지 인자들로 이루어져 있기 때문에 특이성(Specificity)가 떨어진다. SASP 억제제 인 Senomorphics는 전체를 억제하는 시스템이기 때문에 예상치 못한 부작용(Side-effect)의 우려가 있어 추가적인 연구가 필요하다.
2.2. 노화 치료제의 국외 임상시험 현황
표 1. 노화 치료제의 종류 및 국외 임상시험 현황.Compound Targets Clinical trial status Senolytics
Dasatinib
Pan receptor tyrosine kinases
(including ephrin B1)
Phase II, (NCT02848131) for chronic kidney disease, phase II (NCT04313634) for skeletal health, phase I/II (NCT04063124) for Alzheimer disease
Quercetin Numerous
(including PI3K)
Phase II NCT02848131) for chronic kidney disease, phase II (NCT04313634) for skeletal health, phase I/II (NCT04063124) for Alzheimer disease
Fisetin PI3K/AKT/mTOR Phase I/II (NCT04210986) for osteoarthritis of the knee, phase II (NCT04313634) for skeletal health
ABT-263 (navitoclax)
2, XL and BCL-W (prosurvival proteins)
Phase I/II (NCT00445198), phase II (NCT02591095), phase I (NCT02520778), phase II (NCT02079740) for various cancers
UBX0101 MDM2 and p32 Phase II (NCT04129944) for osteoarthritis of the knee
Senomorphics
Metformin IKK and/or NF-κB Approved for type 2 diabetes
Rapamycin mTOR Approved for immunosuppression
RAD001 mTOR Approved for tuberous sclerosis complex-associated diseases
Ruxolitinib JAK Approved for graft-versus-host disease
Loperamide HSP90 Approved for treatment of diarrhea
Anakinra IL-1R Approved for rheumatoid arthritis
Canakinumab IL-1β Approved for cryopyrin-associated periodic syndromes
Rilonacept IL-1α and IL-1β Approved for cryopyrin-associated periodic syndromes
Etanercept TNF Approved for autoimmune diseases
Infliximab TNF Approved for autoimmune diseases
Tocilizumab IL-6R Approved for autoimmune diseases
Siltuximab IL-6 Approved for multicentric Castleman disease (출처: Di Micco, R., et al. Nat Rev Mol Cell Biol, 2021, Modified by Lee)
항노화 기술의 연구 사례 및 기술 동향 이기백 Page 7 / 10 앞서 설명한 노화 치료제(Senotherapeutics)는 임상 시험이 진행 중인 약물들이 있다 (표 1 참조)[21]. Dasatinib + Quercetin combination (D+Q)의 경우는 임상 2상(Phase II) 2건(Chronic kidney disease, Skeletal health), 임상 1/2상(Phase I/II) (Alzheimer disease)가 진행되고 있다. Fisetin은 임상 1/2상(Osteoarthritis of knee) 및 임상 2상(Skeletal health)가 진행 중이다. 그리고 Prosurvival 단백질 들을 표적화하는 ABT-263 (Navitoclax)는 다양한 Cancer 모델에서 임상 시험이 진행 중이다. 이 밖에 도, 많은 후보군들이 전임상 연구를 진행 중이며 및 Senomorphics 약물들의 경우는 기존에 다른 질 환에 적용이 되었던 약물들이 대다수이며 이를 활용한 약물 기능 재배치에 관한 연구가 진행되고 있다.
2.3. 다른 항노화 치료 연구들(Other anti-aging interventions)
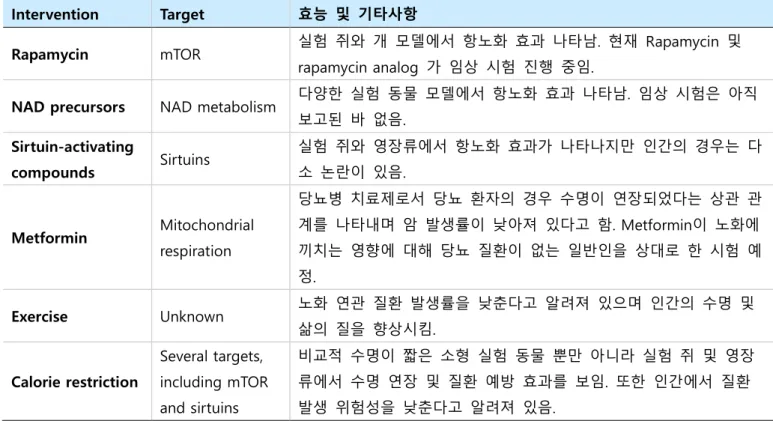
표 2. 항노화 치료책 및 그 효능.
Intervention Target 효능 및 기타사항
Rapamycin mTOR 실험 쥐와 개 모델에서 항노화 효과 나타남. 현재 Rapamycin 및
rapamycin analog 가 임상 시험 진행 중임.
NAD precursors NAD metabolism 다양한 실험 동물 모델에서 항노화 효과 나타남. 임상 시험은 아직 보고된 바 없음. Sirtuin-activating compounds Sirtuins 실험 쥐와 영장류에서 항노화 효과가 나타나지만 인간의 경우는 다 소 논란이 있음. Metformin Mitochondrial respiration 당뇨병 치료제로서 당뇨 환자의 경우 수명이 연장되었다는 상관 관 계를 나타내며 암 발생률이 낮아져 있다고 함. Metformin이 노화에 끼치는 영향에 대해 당뇨 질환이 없는 일반인을 상대로 한 시험 예 정. Exercise Unknown 노화 연관 질환 발생률을 낮춘다고 알려져 있으며 인간의 수명 및 삶의 질을 향상시킴. Calorie restriction Several targets, including mTOR and sirtuins 비교적 수명이 짧은 소형 실험 동물 뿐만 아니라 실험 쥐 및 영장 류에서 수명 연장 및 질환 예방 효과를 보임. 또한 인간에서 질환 발생 위험성을 낮춘다고 알려져 있음.
(출처: Campisi, J., et al, Nature 2019, Modified by Lee)
2.3.1. 식이 제한(Caloric restriction, CR) 앞서 설명한 여러 약물에 의한 치료법(Pharmacologic intervention) 외에도 식이 조절 및 운 동과 같은 여러 다른 Anti-aging intervention에 대한 연구도 진행되어 왔다 (표 2 참조)[22]. 식이 제 한 (Caloric restriction, CR)은 영양소의 부족 없이 전체 칼로리 섭취의 축소를 일컫는다. 식이 제한은 다양한 실험 동물 모델에서 건강 및 수명을 증진 시키는 것으로 알려져 있다. 그러나, 서로 다른 그 룹에서 진행한 인간과 유사한 영장류 모델에서는 수명 연장과 관련하여 다소 결과의 차이가 나타났
항노화 기술의 연구 사례 및 기술 동향 이기백 Page 8 / 10 지만, 식이 제한은 여러 건강 지표가 개선됨을 보여줬고, 노화 연관 질환들의 위험성을 낮춘다는 데 에는 이견이 없었다. 이러한 현상들을 기반으로 다양한 기전 연구가 진행되어 왔다 [23]. 식이 제한 은 다양한 실험을 통해, mTOR는 억제/ AMPK, SIRT, PGC1α는 활성화시킨다고 보고되었으며, 이는 후 성 유전학적 조절(Epigenetic modulation), DNA 복구(DNA repair), 단백질 항상성(Proteostasis), 오토 파지(Autophagy), 미토콘드리아 합성(Mitochondrial biogenesis) 등을 향상시켜 건강 수명 및 장수에 영향을 끼친다고 보고되었다. 이러한 기전 연구는 식이 제한의 효능을 따라 할 수 있는 식이 제한 모방제제(CR mimetics)에 대한 연구로 이어지게 되었고, 대표적으로, Rapamycin, Metformin, Spermi-dine 등이 있으며, 이러한 약물들은 항노화 약물로 제안되어 후속 연구가 이어지고 있다.
2.3.2. 병체 결합(Parabiosis)
노화 연구에서도 병체 결합(Parabiosis)을 이용한 연구가 진행되었다. 옆을 뜻하는 ‘Para-‘ 와 mode of life를 뜻하는 ‘-biosis’의 합성어로 두 개체의 혈관을 외과적으로 연결하는 수술을 통해 혈 액을 주고 받는 시스템을 말한다. 이를 이용해 늙은 쥐와 젊은 쥐의 혈관을 연결하는 이종성 병체 결합(Heterochronic parabiosis) 모델을 만들었고, 혈액 내에 존재하는 어떤 물질이 노화를 제어할 수 있다는 가능성을 보여주었다. 이러한 모델에서는 늙은 쥐에서 나타나는 심장 비대(Cardiac hypertro-phy) 및 인지 기능에 개선을 나타냈다 [24, 25]. 또한, 혈액 내의 단일 성분인 “Growth differentiation factor 11 (GDF11)”이라는 성장 인자가 늙은 쥐에는 적고 젊은 쥐에는 많으며 이러한 성분이 회춘 인자로 작용한다고 제안하였다. 이러한 결과는 다소 논란이 있었지만(“GDF11”과 “Myostatin”이라는 단백질의 유사성), 기존의 노화에 대한 입장은 비가역적이라고 여겨져 왔는데 이러한 발견은 노화라 는 현상도 단일 성분에 의한 가역적인 제어가 가능하다는 증거를 제시해주었다. 2.3.3. 조로증 마우스 모델에서의 유전자 편집술 노화 연구는 조로증(Progeria) 모델에서도 많은 연구가 진행되고 있다. 조로증은
“Hutchinson–Gilford progeria syndrome (HGPS)”이라고도 불리며 이는 “Lamin A”라고하는 핵 단백질 을 암호화하는 유전자인 LMNA에 변이(Mutation) (C1824T)의 발생에 의해 야기된다고 알려져 있다. 이러한 변이는 RNA mis-splicing을 일으켜 “Progerin”이라는 독성을 나타내는 단백질을 생성하게 되 고, 이는 급성 노화 및 수명 단축을 일으킨다고 알려져 있다. 최근 연구에 의하면, CRISPR-Cas9 (Clustered regularly interspaced short palindromic repeats associated with Cas9 endonuclease) 시스 템을 이용하여, HGPS 마우스 모델에 in vivo 유전자 편집술(Gene editing)을 시행하였다 [26]. 태어난 지 3일 혹은 14일 된 HGPS 마우스 모델에 in vivo 유전자 편집술을 위한 바이러스를 주입하였고, 이는 조로증 마우스에서 나타나는 동맥의 두께 및 내부 직경의 감소에 있어서 개선과 평균 수명의 증가를 나타냈다(그러나, 일부 치료받은 쥐의 간에 암이 발생함). 실제 환자에 적용하기 위해 아직 넘어야 할 산이 많긴 하지만 조로증 치료에 있어서 한 걸음 더 나아갔다는 사실만은 분명하다.
항노화 기술의 연구 사례 및 기술 동향 이기백 Page 9 / 10
3. 결론
최근의 노화 연구들은 노화 프로세스를 억제할 수 있는 새로운 항노화 타겟에 대한 연구들 이 이루어지고 있다. 최근 몇 년 간은 다양한 항노화 치료법들이 소개되었고, 이는 항노화 연구에 있어서 큰 발전을 이루었다. 동물 모델에서의 결과에 힘입어 이러한 전략들을 인간의 노화 및 노화 연관 질환에 적용하기 위해 다양한 연구자들이 노력을 하고 있으며 일부 노화 치료제 (Senotherapeutics)들이 임상 시험을 진행 중이며, 후속으로 나온 약물들도 비임상 연구를 진행하고 있다. 그러나, 이러한 약물들은 특이성(Specificity), 선택성(Selectivity), 효율성(Efficacy) 같은 한계점을 보완하고 좀 더 명확한 작용 기전 및 부작용에 대한 연구가 이루어져야 한다.현재의 항노화 전략들은 노화 연관 질환들을 예방 및 지연 시켜 건강 수명을 늘릴 것이라 기대하고 있다. 인간의 최대 수명에 관해서는 아직 논란이 있지만 현재 개발된 혹은 앞으로 개발될 다양한 항노화 전략들이 인간의 최대 수명도 연장시킬 수 있을 것이라 기대해본다.
4. 참고문헌
[1] Hayflick, L. and P.S. Moorhead, The serial cultivation of human diploid cell strains. Exp Cell Res, 1961. 25: p. 585-621.
[2] Baker, D.J., et al., Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature, 2011. 479(7372): p. 232-6.
[3] Campisi, J., Senescent cells, tumor suppression, and organismal aging: good citizens, bad neighbors. Cell, 2005. 120(4): p. 513-22.
[4] Baker, D.J., et al., Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature, 2016. 530(7589): p. 184-9.
[5] Demaria, M., et al., An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA. Dev Cell, 2014. 31(6): p. 722-33.
[6] Dolgin, E., Send in the senolytics. Nat Biotechnol, 2020. 38(12): p. 1371-1377.
[7] Niedernhofer, L.J. and P.D. Robbins, Senotherapeutics for healthy ageing. Nat Rev Drug Discov, 2018. 17(5): p. 377.
[8] Zhu, Y., et al., The Achilles' heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell, 2015. 14(4): p. 644-58.
[9] Zhu, Y., et al., Identification of a novel senolytic agent, navitoclax, targeting the Bcl-2 family of anti-apoptotic factors. Aging Cell, 2016. 15(3): p. 428-35.
[10] Kang, C., Senolytics and Senostatics: A Two-Pronged Approach to Target Cellular Senescence for Delaying Aging and Age-Related Diseases. Mol Cells, 2019. 42(12): p. 821-827.
[11] Zhu, Y., et al., New agents that target senescent cells: the flavone, fisetin, and the BCL-XL inhibitors, A1331852 and A1155463. Aging (Albany NY), 2017. 9(3): p. 955-963.
[12] Baar, M.P., et al., Targeted Apoptosis of Senescent Cells Restores Tissue Homeostasis in Response to Chemotoxicity and Aging. Cell, 2017. 169(1): p. 132-147 e16.
항노화 기술의 연구 사례 및 기술 동향 이기백 Page 10 / 10 [14] Cai, Y., et al., Elimination of senescent cells by beta-galactosidase-targeted prodrug attenuates
inflamma-tion and restores physical funcinflamma-tion in aged mice. Cell Res, 2020. 30(7): p. 574-589.
[15] Munoz-Espin, D., et al., A versatile drug delivery system targeting senescent cells. EMBO Mol Med, 2018. 10(9).
[16] Amor, C., et al., Senolytic CAR T cells reverse senescence-associated pathologies. Nature, 2020. 583(7814): p. 127-132.
[17] Zhu, Y., et al., New agents that target senescent cells: the flavone, fisetin, and the BCL-X-L inhibitors, A1331852 and A1155463. Aging-Us, 2017. 9(3): p. 955-963.
[18] Coppe, J.P., et al., Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biol, 2008. 6(12): p. 2853-68.
[19] Ito, Y., M. Hoare, and M. Narita, Spatial and Temporal Control of Senescence. Trends Cell Biol, 2017. 27(11): p. 820-832.
[20] von Kobbe, C., Targeting senescent cells: approaches, opportunities, challenges. Aging (Albany NY), 2019. 11(24): p. 12844-12861.
[21] Di Micco, R., et al., Cellular senescence in ageing: from mechanisms to therapeutic opportunities. Nat Rev Mol Cell Biol, 2021. 22(2): p. 75-95.
[22] Campisi, J., et al., From discoveries in ageing research to therapeutics for healthy ageing. Nature, 2019. 571(7764): p. 183-192.
[23] Ros, M. and J.M. Carrascosa, Current nutritional and pharmacological anti-aging interventions. Biochim Bi-ophys Acta Mol Basis Dis, 2020. 1866(3): p. 165612.
[24] Loffredo, F.S., et al., Growth Differentiation Factor 11 Is a Circulating Factor that Reverses Age-Related Car-diac Hypertrophy. Cell, 2013. 153(4): p. 828-839.
[25] Villeda, S.A., et al., Young blood reverses age-related impairments in cognitive function and synaptic plas-ticity in mice. Nature Medicine, 2014. 20(6): p. 659-663.
[26] Koblan, L.W., et al., In vivo base editing rescues Hutchinson-Gilford progeria syndrome in mice. Nature, 2021. 589(7843): p. 608-614.
The views and opinions expressed by its writers do not necessarily reflect those of the Biological Research Information Center.
이기백(2021). 항노화 기술의 연구 사례 및 기술 동향. BRIC View 2021-T26
Available from https://www.ibric.org/myboard/read.php?Board=report&id=3841 (Jul. 27, 2021)