COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 1 / 23 BRIC View 2020-TX8
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향
정 의 경
JW홀딩스E-mail: jek@jw-holdings.co.kr
요약문최근 중증급성호흡기증후군 코로나바이러스 2(Severe acute respiratory syndrome corona-virus 2; SARS-CoV-2) 감염이 전 세계적으로 급속도로 확산되며 전례 없는 보건, 사회, 경제적 위기에 직면하고 있다. COVID-19는 SARS-CoV-2에 의해 발생하는 질환으로 무증상부터 경증 호흡기 증상, 급성 호흡곤란 증후군(ARDS), 사망에 이르는 증상을 보인다. 이렇듯 COVID-19이 급속도로 확산됨에 따라 COVID-19의 병태생리학적, 생물학적 이해를 높이기 위해 많은 연구들이 시도되고 있다. 본 리뷰에서는 SARS-CoV-2 감염에 따른 선천성 및 적응성 면역 반응에 대한 지금까지의 연구 결과를 정리하고자 한다. 또한 SARS-CoV-2 감염을 치료하기 위한 현재까지 치료 전략 및 백신의 근거와 임상 결과 및 개발 동향을 살펴보고자 한다.
Key Words: SARS-CoV-2, COVID-19, cytokine storm, remdesivir, COVID-19 vaccine
목 차
I. 서론 II. 본론 1. SARS-CoV-2의 감염 기전 2. SARS-CoV-2 에 대한 면역반응 2.1. 선천성 면역 2.2. 골수세포 2.3. NK 세포 2.4. T 세포 2.5. B 세포 BRIC View 동향리포트COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 2 / 23 3. COVID-19 치료제 개발 현황 3.1. 항바이러스제(Antivirals) 3.1.1. RdRp 저해제 3.1.2. Protease 저해제 3.2. 면역조절제 3.2.1. Chloroquine 3.2.2. Corticosteroid 3.2.3. IFN 3.2.4. Cytokine 저해제 3.3. 혈장치료 및 중화항제
3.3.1. 회복기 혈장치료(Convalescent plasma therapy) 3.3.2. 중화항체(nAb) 4. COVID-19 백신 개발 현황 III. 결론 IV. 참고문헌
I. 서론
2019년 12월 31일 중국 후베이 성 우한에서 폐렴 환자가 집단으로 발표되었다. 이후 2020 년 1월 7일 중국 보건당국은 이것이 새로운 코로나 바이러스(CoV)에 의한 것임을 확인하였고 중증 급성호흡기증후군 코로나바이러스 2(Severe acute respiratory syndrome coronavirus 2; SARS-CoV-2) 로 명명하였다. SARS-CoV-2로 인한 질환을 “COVID-19”이라 하며 2020년 3월 11일 세계보건기구 (WHO)는 COVID-19에 대한 pandemic을 공식 선언하였다.최근 20년간 CoV는 2003년 중증급성호흡기증후군(SARS, SARS-CoV-1), 2012년 중동호흡기증 후군(MERS), 2019년 COVID-19 등 치명적인 질환을 유발하였다. COVID-19는 무증상부터 미열, 기침, 호흡곤란, cytokine storm, 호흡부전, 사망에 이르는 증상을 나타낸다. SARS-CoV-2의 사망률은 3.3% 로, SARS-CoV-1 (9.6%)나 MERS-CoV (~35%)처럼 치명적이지는 않지만, 전 세계적으로 급속도로 확 산되며 보건, 사회, 경제적인 재앙을 가져왔다 [1]. COVID-19의 급속한 확산에 따라 치료제나 백신을 찾기 위한 많은 연구들이 시도되고 있다. 지금까지 FDA 정식 승인을 받은 치료제는 remdesivir가 유일하며 그 외 긴급사용 승인을 받은 임상 단계 치료제가 이용되고 있다. 항바이러스나 면역억제 기전을 가진 약물들이 가능한 치료제로 제시 되며 현재 임상에서 연구되고 있다 [2-5]. 체내 면역체계는 이러한 전염병에 대한 방어에 핵심적인 역할을 한다. 바이러스 감염에 따른 면역 반응을 증가 시켜 체내 병원균의 확산을 막을 수 있다. 그러나 일부 변종은 면역계 공격을 회 피해 체내에서 증식할 뿐만 아니라 폐에 염증 반응을 유도하여 폐렴을 유발할 수 있다. 또한 일부에 게서는 “cytokine storm”이라고 알려진 대규모 염증반응을 유발하여 심각한 병리학적 결과를 초래할
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 3 / 23 수 있다. 따라서 체내 면역반응의 기전에 대한 이해는 COVID-19에 대한 치료제 개발에 매우 중요하 다. 본 리뷰에서는 SARS-CoV-2 감염에 따른 체내 면역반응 및 COVID-19에 대한 다양한 치료제 및 백신 개발 동향을 살펴보고자 한다.
II. 본론
1. SARS-CoV-2의 감염 기전
SARS-CoV-2는 세포 표면에 angiotensin-converting enzyme 2 (ACE2) 및 TMPRSS2를 발현하 는 세포를 감염할 수 있다. 기도 상피세포, 폐포 상피세포, 혈관 내피세포, 폐 내의 대식세포
(macrophage)가 ACE2를 발현하는 것으로 알려져 있다. 숙주세포의 ACE2와 결합하는 바이러스 부위 는 바이러스 표면에 발현된 왕관 모양의 spike (S) 단백질이다. 최근, 숙주 세포 표면에 발현된 glu-cose regulated protein (GRP78)도 SARS-CoV-2 S 단백질과 상호작용하여 숙주 세포로의 바이러스 침 입(entry)에 관여하는 것으로 밝혀졌다. S 단백질은 S1과 S2의 2개의 subunit으로 구성되어 있으며 S1에 수용체-결합 domain (receptor-binding domain, RBD)이 있다. SARS-CoV-2와 SARS-CoV-1의 RBD는 유전적으로 72% 일치하지만, SARS-CoV-2의 RBD가 SARS-CoV-1 대비 높은 affinity를 가지고 MERS-CoV와 유사하게 S 단백질에 furin-like cleavage site를 포함한다. 이러한 특징이 SARS-CoV-1 대비 SARS-CoV-2의 전염력을 높이는 것으로 알려져 있다 [6-9].
감염된 세포 내에서 바이러스는 스스로를 복제하여 방출된다. 이로 인해 숙주 세포는 py-roptosis (병원체 감염 시 항균 반응의 일부로 나타나며 염증성 형태의 프로그램된 세포사멸)로 죽으 며 ATP, 핵산, ASC oligomer와 같은 damage-associated molecular pattern (DAMP)을 방출한다. 이것 이 인접한 표피 세포, 내피세포, 폐포의 대식세포에 인지되며 염증성(pro-inflammatory) cytokine 및 chemokine의 분비를 유발한다. 또한, SARS-CoV-2와 같은 RNA 바이러스는 바이러스 RNA와 같은 pathogen-associated molecular pattern (PAMP)가 숙주의 유형인식수용체(pattern-recognition recep-tor, PRR)에 결합하며 cytokine이 분비되도록 한다. 이는 단핵구(monocyte), 대식세포, T 세포를 감염 부위로 끌어들여 염증을 더욱 촉진시키고 염증성 feedback loop을 형성한다 [6-7, 10].
정상적인 면역 상태에서는 바이러스 감염 부위로 바이러스 특이적인 T 세포를 끌어들여 바 이러스가 퍼지기 전에 감염된 세포를 제거할 수 있다. 또한, 중화항체(neutralizing antibody, nAb)는 바이러스 감염을 막고 폐포의 대식세포는 중화된 바이러스와 세포사멸을 인지하여 대식작용
(phagocytosis)으로 제거할 수 있다. 이러한 면역작용은 바이러스를 제거하고 폐 손상을 최소화하여 감염으로부터 회복되도록 한다. 그러나, 면역반응에 이상이 있는 경우, 폐에 면역세포가 더욱 축적되 며 과도한 염증성(pro-inflammatory) cytokine이 방출되어, 폐 손상을 유발하게 된다. 이로 인한 cy-tokine storm은 다른 장기로 순환하며 다기관 손상을 유발한다 [6-7, 10].
다음 단락에서부터, SARS-CoV-2에 대한 숙주의 면역반응과 SARS-CoV-2는 어떤 기전으로 이를 회피하는지 알아보자.
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 4 / 23
2. SARS-CoV-2 에 대한 면역반응
2.1. 선천성 면역 선천성 면역(innate immunity)은 바이러스에 대한 1차 방어선으로 작용한다. 그러나 현재까 지 SARS-CoV-2에 대한 선천성 면역반응에 대한 연구는 매우 부족하다. 다만 CoV 간에 상동성이 높 고 선천성 면역 기전이 보존되어 있으므로, 다른 CoV와 유사할 가능성이 있다. SARS-CoV-2와 같은 RNA 바이러스는 바이러스의 single-stranded RNA (ssRNA) 및 double-stranded RNA (dsRNA)가 RIG-I like receptor (RLR), Toll-like receptor (TLR)과 같은 유형인식수용체(pattern-recognition receptor, PRR) 에 결합하며 면역반응이 시작된다. PRR이 활성화되면, 하위 기전 활성화를 통해 cytokine이 분비되도 록 한다. 그 중 type I/III interferon (IFN)이 항바이러스 작용에 가장 중요한 역할을 하며, tumor ne-crosis factor alpha (TNF-α), interleukin-1 (IL-1), IL-6, IL-18과 같은 염증성 cytokine도 방출되는 것으 로 알려져 있다. 이러한 인자는 적응성 면역(adaptive immunity)을 촉진하게 된다 [6, 10].바이러스 감염 초기에 IFN-I은 효과적으로 CoV 감염을 억제할 수 있다. SARS-CoV-2는 SARS-CoV-1 보다 IFN-I/III에 대해 더 민감한 것으로 알려져 있다. 현재 어떤 IFN-stimulated gene (ISG)가 이러한 효과에 기여하는지 연구되고 있다. 예를 들어, Lymphocyte antigen 6 complex locus E (LY6E)는 SARS-CoV-2의 S 단백질에 의한 세포막 융합을 저해할 수 있다 [11-16].
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 5 / 23
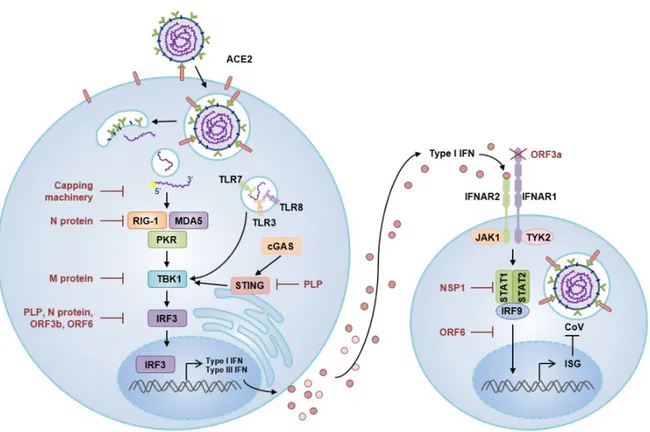
Cytokine은 바이러스 감염에 대한 주요 장벽으로 작용하기 때문에, CoV는 IFN-I을 억제하는 기전을 진화과정을 통해 발전 시켜 왔다. 실제로 중증 COVID-19 환자는 경증이나 중등도 환자에 비 해 IFN-I 생성 및 활성이 현저히 저하되어 있다 [17]. CoV는 PRR 인지, cytokine 분비에서 IFN 신호 전달로 이어지는 기전의 각 단계를 포함하여 여러 가지 기전으로 선천성 면역을 회피한다 (그림 1).
먼저, CoV는 PRR을 통한 면역 인지(sensing)를 회피한다. CoV와 같은 ssRNA 바이러스는 복 제 과정에 dsRNA를 형성하며 이는 endosome 내 TLR3 및 세포질 내 RIG-I, MDA5, PKR에 의해 인 지된다. ssRNA도 TLR7 혹은 TLR8, (잠재적으로는) RIG-I, PKR에 인지될 수 있다. CoV는 PRR에 의한 인지를 회피하거나, PRR의 작용을 저해하여 PRR의 활성을 막는 것으로 알려져 있다. PRR의 인지를 회피하는 기전으로는 dsRNA가 바이러스 복제 과정에 형성된 막-결합 요소에 의해 가려지거나, 숙주 의 mRNA와 유사한 구조(5’ 말단에 cap 형성)를 가지기도 한다. CoV는 또한 PRR의 활성을 지연시키 도록 진화되었다. 예를 들어, SARS-CoV-1 N (nucleocapsid protein) 단백질은 RIG-I의 활성을 저해한 다 [6-7, 10].
PRR이 활성화된 후, RLR 및 TLR은 세포 내 신호전달을 통해서 NF-kB와
interferon-regulatory factor family (IRF)와 같은 전사인자를 인산화하여, IFN과 염증성 cytokine의 발현을 촉진한 다. SARS-CoV-1 M (matrix protein) 단백질은 신호 중간체인 TBK1을 억제하는 것으로 알려져 있다. SARS-CoV-1의 papain-like protease (PLP), N, ORF3b, ORF6 단백질은 IRF3의 인산화와 핵으로의 이동 (nuclear translocation)을 막는 것으로 알려져 있다. SARS-CoV-1 PLP는 또한 stimulator of interferon gene (STING)을 저해한다. 현재까지 PRR 신호에 대한 SARS-CoV-2 단백질의 정확한 기능은 밝혀져 있지 않지만, 바이러스 단백질과 PRR 신호전달 간의 상호작용이 있는 것으로 보고되고 있다 [6-7, 10].
CoV 단백질은 또한 IFN 하위 기전을 저해하기 위해 수용체 IFNAR1/R2에서 전사인자 STAT 단백질에 이르는 신호전달 경로의 여러 단계를 저해한다. SARS-CoV-1의 경우, ORF3a로 IFNAR1의 분해를 유도하여 IFN의 수용체 결합을 막거나, NSP1을 통해 STAT1 인산화를 감소시키고, ORF6를 통 해 STAT1의 핵으로의 이동을 저해하여 IFN 신호전달에 의한 유전자 발현을 저해한다. 그러나 SARS-CoV-2의 ORF6는 SARS-CoV-1과 상동성이 69%로 낮으므로 동일한 기능을 가지지는 않을 것으로 보 인다. 실제로 2 감염은 STAT1 인산화를 저해하지 않는 것으로 알려져 있으며, SARS-CoV-2에 의한 선천성 면역반응 저해 기전에 대해서는 좀 더 많은 연구가 필요하다 [10, 12].
즉, CoV는 여러 가지 전략으로 면역 감지, 특히 IFN-I 기전을 회피하며, 이는 IFN-I이 항바이 러스 반응에 그만큼 중요함을 시사한다. 보다 중요한 것은 IFN-I이 분비되는 시기일 것이다. 질환의 초기에 IFN이 분비되면 항바이러스 작용을 하지만, 이후에는 오히려 병인이 될 수 있다. IFN에 의해 기도 상피부에 ACE2 발현이 증가하며 병인에 기여하는 것으로 알려져 있다 [6, 10].
CoV는 또한 IFN 기전은 저해하는 반면, 다른 염증성 반응은 촉진하여 병적인 염증반응을 유 발할 수 있다. 실제로 SARS-CoV-2 NSP9 및 NSP10은 NF-kB 억제자인 NKRF를 억제하여 IL-6, IL-8 생성을 유도하였다 [18]. 결국 이러한 염증반응은 COVID-19 환자에서 나타나는 ‘cytokine storm’에 기여하게 된다. 따라서 항바이러스 반응과 염증성 선천성면역 반응 사이의 균형을 이해하는 것은 COVID-19에 대한 효과적인 치료제 및 바이오마커를 개발하는데 필수적일 것이다. 또한 특정 타겟에 대한 면역억제 치료제를 개발하는 것이 보다 효과적일 것이다.
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 6 / 23
2.2. 골수세포
감염에 대한 점막 면역반응은 conventional 수지상세포(conventional dendritic cell, cDC), plasmacytoid DC (pDC), 대식세포와 같은 골수세포에 의해 조절된다. COVID-19 증후군의 특징인, 급 성호흡곤란증후군(acute respiratory distress syndrome, ARDS), cytokine 방출증후군(cytokine release syndrome, CRS), 림프구 감소증(lymphopenia)은 비정상적인 골수세포 반응에 의해 유발되는 것으로 보고되고 있다 [19].
바이러스에 감염된 폐 상피세포에서 방출된 IL-6, IL-1β, IFN-I/III는 염증성 단핵구, 백혈구, 림 프구를 감염 장소로 모으면서 조직 상주 대식세포가 염증성으로 변하도록 유도한다. 실제로 COVID-19 환자의 말초혈액 단핵세포(peripheral blood mononuclear cell, PBMC)에는
granulocyte-macrophage colony-stimulating factor (GM-CSF)를 분비하는 활성화된 CD4+ T 세포와 CD14+
HLA-DRlo 염증성 단핵구(inflammatory monocyte, IM)가 상당히 증가되어 있었다. 그리고 중증 COVID-19
환자의 폐 조직에는 조직-상주 폐포 대식세포(alveolar macrophage, AM) 대신 IM 및 Ficolin-1+ 단핵
구 유래 대식세포가 증가되어 있었다. 이와 동시에 폐포 열림(alveolar patency)을 저해하고 ARDS를 촉진하는 것으로 알려진 IFN 기전의 활성화와 단핵구의 증가가 확인되었다. 감염장소로 유입된 단핵
구는 IL-6, TNF-ɑ를 지속적으로 방출하여 과도한 염증반응을 유발한다. 실제로 여러 COVID-19 환자
군에서 염증성 cytokine인 IL-6의 체내 농도가 상당히 높았고 증상의 심각도와 상관관계가 있었다
[19, 20-23].
바이러스 감염에 대응하여 mononuclear phagocyte (MNP)는 IL, IFN-I, IFN-III 생성을 촉진하 여 inflammasome을 활성화하고 병원성 Th1, Th17 반응을 유도하며, 효과(effector) 면역세포를 모으 고, CRS를 유발한다. pDC와 같은 다른 골수세포도 IFN 의존적으로 virus를 조절할 것이다. 즉, 골수 세포는 ISG 신호전달을 통해 COVID-19 증상을 악화시킬 수 있다. 폐 상주 및 유입된 과립구가 어떤 역할을 하는지는 아직 연구가 필요하다. 초기에는 보호하는 역할을 하는 반면, 이후 호중구 (neutrophil)와 대식세포 간의 상호작용은 염증 반응을 촉진시키는 것으로 알려져 있다. 결론적으로, 골수세포가 바이러스 감염의 조기 감지 및 항바이러스 반응에 중요한 역할을 함에도 불구하고 골수 세포 간의 부적절한 상호작용은 COVID-19의 증상 악화와 관련이 있다 [24-25]. 2.3. NK 세포
일반적으로 자연살해(natural killer, NK) 세포는 cytokine 생성에 특화된 CD56brightCD16− NK
세포와 세포독성(cytotoxicity)에 특화된 CD56dimCD16+ 세포로 나뉜다. NK세포는 억제 수용체와 활성
수용체를 발현하여 세포독성 활성을 조절한다. 예를 들어, NKp46과 같은 활성 수용체로 바이러스 유 래 단백질과 스트레스에 의해 유도된 ligand를 인지하여 바이러스 감염 세포를 용해시킨다. 또한 SARS-CoV-2에 감염되며 분비된 IgG1, IgG3 항체는 감염 세포 표면이나 바이러스 입자에 결합하여
NK 세포의 Fc receptor에 인지되어 CD56dimCD16+ 세포를 활성화한다. 이는 항체 의존성 세포독성
(antibody-dependent cellular cytotoxicity, ADCC)을 통해 NK 세포의 cytokine 분비와 세포독성 작용 을 유도한다 [10, 26].
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 7 / 23 그러나 COVID-19 환자의 혈액 내 NK 세포는 감소되어 있으며, 이는 증상의 악화와 관련 있 는 것으로 여러 연구를 통해 밝혀졌다. 폐 NK 세포는 대부분 비상주세포(non-resident)로 바이러스 감염 시 단핵구에서 분비된 CXCR3 ligand (CXCL9-11)에 의해 혈액으로부터 유입된 것으로 보인다. 실제로 COVID-19 환자의 폐에 CXCR3 ligand를 분비하는 단핵구가 증가되어 있었다 [23, 27-30]. 또한 COVID-19 환자의 NK 세포는 세포독성 및 cytokine 분비 기능이 저하된 것으로 알려져 있다. COVID-19 환자의 혈액 내 NK 세포는 CD107a, Ksp37, granzyme B, granulysin의 발현이 감소 되어 있으며 이는 세포독성 기능 및 IFN-γ, TNF-α, chemokine 분비가 손상되었음을 의미한다. 여러 기전을 통해 NK 세포 기능이 저하되는 것으로 알려져 있다. 폐 NK 세포가 SARS-CoV-2 진입 수용 체인 ACE2를 발현하지는 않으므로 SARS-CoV-2가 직접 감염하여 세포사멸을 유도할 가능성은 낮다. CD16 및 KIR를 발현하는 NK 세포의 혈액 내 빈도가 SARS-CoV-2 감염 이후 감소하는 것으로 보아, NK 세포의 성숙도가 저하되거나, 성숙한 NK 세포가 폐 또는 다른 조직으로 이동하는 것으로 보인 다 [30-33]. 또한 COVID-19 환자의 NK 세포에 면역관문인자 발현이 증가하며 바이러스 회피에 기여하 는 것으로 보인다. 실제로 COVID-19 환자의 NK 세포와 CD8 T 세포에 세포 독성을 저해하는 것으 로 알려진 면역관문인자 NKG2A가 증가되어 있었다. COVID-19 환자의 NK 세포에 다른 면역 관문인 자인 LAG3, TIM3도 과발현되어 있었다 [17, 30, 35] 뿐만 아니라, 염증성 단핵구와 NK 세포 간의 상호작용이 NK 세포의 SARS-CoV-2 감염 세포 인지 및 세포독성을 저해하는 것으로 보인다. COVID-19 환자의 혈장 내 IL-6 농도는 NK 세포 수 감 소와 상관관계가 있었다. 또한 COVID-19 환자의 혈장에 TNF-α가 증가되어 있으며 단핵구에서 방출 된 TNF-α는 NK 세포의 수용체에 결합하여 NK 세포 활성을 조절하는 것으로 보인다. TNF-α는 NKp46 발현 감소를 포함하여 NK 세포 분화에 관여하는 것으로 알려져 있다. 따라서 IL-6 및 TNF-α 에 대한 저해제는 COVID-19 환자에서 NK 세포 기능을 강화할 수 있을 것이다. 체외(in vitro)에서 NK 세포에 IL-6를 처리하면 세포독성 기능(perforin, granzyme B 생성)이 저해되고 이는 tocilizumab (IL-6R blockade) 처리에 의해 회복되는 것으로 나타났다 [28, 34, 37-38]. 2.4. T 세포 T 세포는 항바이러스 면역반응을 조절하는 핵심적인 역할을 한다: CD4 T세포는 B세포의 항 체 생성에 도움을 주고 다른 면역세포의 반응을 조절하는 한편, CD8 T세포는 바이러스에 감염된 세 포를 죽여 virus량을 감소시킨다. 그러나, 비정상적인 T 세포 반응은 오히려 질환을 악화시킬 수 있 다 [6, 10]. COVID-19 환자에서의 T 세포 반응을 더 잘 이해하기 위해서는 (1) T 세포가 초기 바이러 스 조절과 조직 손상에 어떻게 기여하는지, (2) 기억 T 세포는 재감염 시 어떻게 보호 면역에 기여하 는지에 대한 이해가 필수적이다. 중증 및 중등도 COVID-19 환자에서 CD4와 CD8 T 세포 수가 현저히 감소된 림프구감소증 (lymphopenia)이 나타나는 것으로 잘 알려져 있다. 중환자실(ICU)에 입원한 환자의 CD8 T 세포 림프 구 감소 정도는 COVID-19 증상의 악화 및 사망률과 관련 있었다. 그러나 일반적으로 경증 환자에서 는 정상적이거나 약간 더 많은 수의 T 세포가 확인되었다 [33-34, 39-46].
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 8 / 23 중등도에서 중증 COVID-19 환자에서 혈액 내 T 세포 감소의 원인은 아직 밝혀지지 않았으 며, T 세포에 직접적인 바이러스 감염은 보고된 바 없다. 다만 혈액 내 T 세포 감소에 관여하는 몇몇 기전이 보고되고 있다. 먼저, 혈청 내 IL-6, IL-10, TNF-α가 림프구 감소증에 관여하는 것으로 보인다. 실제로 회복기 환자는 전체적인 염증성 cytokine의 농도가 낮아지고 이와 함께 T 세포 수도 회복되 었다. 이러한 가설을 뒷받침하여, IL-6 수용체 길항제인 tocilizumab은 혈액 내 림프구 수를 증가 시 켰다. 또한 T 세포가 감염 장소로 모이며 혈액 내 수가 감소하는 것으로 보인다. 실제로, COVID-19 환자 부검 결과 폐로 많은 수의 T 세포가 침투되어 있었다. 그러나, 또 다른 연구에서는 4명의 COVID-19 환자 조직 부검 결과, 호중구의 침투만 나타났다 [20, 23, 30, 44-50]. 따라서, COVID-19 환 자에서 흔히 관찰되는 림프구감소증의 원인과 영향에 대한 이해를 높이기 위해 후속 연구가 필요하 다. T 세포가 항암 바이러스 면역 반응에 중요하지만, 비정상적인 T 세포 반응은 COVID-19 환 자의 증상을 악화시킬 수 있다. 실제로 최중증 COVID-19 환자에서만 PBMC 내에 GM-CSF+ CD4 T 세포가 상당히 증가되어 있었다. GM-CSF+ CD4 T 세포는 다발성경화증과 같은 염증성 자가면역 질환 에 관여하고 혈액 내 GM-CSF+ CD4 T 세포의 높은 빈도는 패혈증의 나쁜 예후와 상관관계가 있는
것으로 알려져 있다. 또한 중증 COVID-19 환자에서는 Treg가 감소되어 있었다. Treg는 ARDS 염증 해결에 도움을 주는 것으로 알려져 있으므로, Treg가 감소하며 COVID-19 폐 증상이 악화될 것으로 보인다. 또한 인플루엔자 감염에 대해 항바이러스 기능을 가진 것으로 알려진 γδ-T 세포가 중증 COVID-19 환자에서는 감소되어 있었다. [36-37, 40, 51-52] 아직까지 SARS-CoV-2에 특이적인 T 세포의 면역성을 확인한 연구는 거의 없다. 경증에서 회복 중인 12명의 COVID-19 환자에서 바이러스 N, M, S 단백질에 특이적인 강력한 T 세포 반응을 확인하였고, 이후 회복한 환자의 1/3에서 N 단백질 특이적인 T 세포만 확인되었다. 또한 중등도에서 중증 ARDS 증상이 나타난 COVID-19 환자의 ICU 입원 후 약 2주 후에 PBMC를 유세포 분석한 결 과, 바이러스 특이적인 CD4와 CD8 T 세포 빈도는 평균적으로 각각 1.4%와 1.3%로 나타났고 이들은 대부분 CD4 Tcm (central memory)이거나, CD8 Tem (effector memory), Temra (effector memory RA) 세포였다. 특히, CD4와 CD8 T 세포가 둘 다 S 단백질 epitope에 선택적으로 특이성을 나타냈다. 또 다른 연구는 경증, 중증, 최중증 COVID-19 환자 18명 중 83%에서 S 단백질 특이적인 CD4 T 세포가 나타남을 확인하였다 [53-55]. 현재까지 COVID-19와 관련된 T 세포의 특정 표현형 및 기능 변화는 거의 알려지지 않았으 나, HLA-DR, CD38, CD69, CD25, CD44, Ki-67를 발현하는 활성화된 T 세포가 증가하는 것으로 보고되 고 있다. 일반적으로 COVID-19 중증도와는 무관하게 CD8 T세포가 CD4 T세포보다 활성화되는 것으 로 보인다. 또한 10명의 COVID-19 환자에서, 질환 초기 대비 증상이 나타나며 PD-1 발현이 증가하 였다 (Diao et al., 2020). PD-1 발현은 T 세포 탈진(exhaustion)과 관련 있지만, 그보다는 활성화된 효 과 T 세포에 발현된다는 점을 기억할 필요가 있다. 또한 여러 연구에서 OX-40, CD137, CTLA-4, TIGIT, NKG2a와 같은 다양한 공동자극(co-stimulatory) 및 억제(inhibitory) 인자의 발현이 높게 나타났다.
ICU 환자에서 CD28+ CD8 T 세포는 감소한 반면 PD-1+ TIM3+ CD8 T 세포는 증가되어 있었다. 이들
마커는 대부분 CD4 T 세포보다 CD8에서 더 높게 나타났으며, 경증 대비 중증 환자에서 증가하는 경향을 보였는데 이는 바이러스양의 차이 때문일 것이다. 최중증 환자에서는 CD4와 CD8 T 세포의 기능이 저하된 것으로 나타났으며, 다기능(polyfunctional) T 세포(1개 이상의 cytokine을 생성하는)
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 9 / 23 빈도도 감소되어 있었다. 마찬가지로, 중증 COVID-19의 CD8 T 세포는 CD107a 탈과립 (degranulation) 및 granzyme B (GzmB) 생성 감소와 함께 세포독성 기능이 감소되어 있었다. 이와 달리 다른 연구에서는 중증 환자에서 GzmB와 perforin이 CD8 T 세포에서 증가되어 있었다. T 세포 반응의 급격한 변화와 샘플 채취 시기의 차이를 고려한다면 상호 배타적인 결과로 해석될 필요는 없을 것이다 [23, 30, 36-37, 40, 43, 51, 54-57]. 요약하자면, 중증 COVID-19의 T 세포는 PD-1, TIM-3와 같은 탈진 경향을 보일 뿐만 아니라 전체적으로 다기능성과 세포독성 기능이 감소된 것으로 나타난다. 이와 달리 회복한 환자들은
fol-licular helper CD4 T 세포(TFH)가 증가하고 억제 마커 발현은 감소하며 Gzm A, GzmB, perforin과 같
은 효과 인자 발현이 증가하였다. 이러한 결과는 급성 SARS-CoV-2 감염에 대한 T 세포의 역학 (dynamics)을 보여주지만, 어떠한 결론을 내기에는 아직까지 상당한 한계가 있다.
2.5. B 세포
체액성 면역반응(humoral immune response)은 바이러스 제거에 중요한 역할을 한다. SARS-CoV-2는 강한 B 세포 반응을 유도한다. 감염 후 며칠 내 신속하게 바이러스 특이적인 IgM, IgG, IgA 및 중화항체 반응이 나타남을 확인하였다. SARS-CoV-2에 대한 항체 반응은 현재 상당히 잘 연구되 어 있다 [35]. 대부분의 COVID-19 환자에서 항체양전(seroconversion, 감염 후 체내에서 항원에 대한 반응 성 항체가 만들어지는 시기)은 증상이 나타난 후 7-14일 사이에 나타나고 체내 항체 titer는 바이러 스 제거 후 몇 주 동안 유지된다. 일반적으로 SARS-CoV-2 내부 N 단백질과 외부 S 당단백질에 결 합하는 항체가 검출된다. S 단백질의 RBD는 면역원성이 높고 이 domain에 결합하는 항체는 강력하 게 중화 시켜 바이러스와 숙주 ACE2와의 상호작용을 차단할 수 있다. 즉, SARS-CoV-2에 대한 중화 항체 반응은 ACE2와 RBD의 결합을 억제하는 것에 의존적인 것으로 보인다. 실제로, Anti-RBD nAb 가 대부분의 환자에서 검출되었다. 26명의 완치 환자 혈청 내 거의 모든 항체는 S1 및 RBD에 결합 하고 그중 단 3개만이 ACE2/RBD 결합을 억제할 수 있었다 [26, 58-66]. B 세포 반응은 기억면역에도 중요한 역할을 한다. 감염의 급성기와 회복기 단계에서 B 세포 는 형질세포(plasma cell)로 분화되어 항체를 지속 분비함으로써 혈청 내 기억면역을 형성한다. 1차 감염 시 형성된 기억 B 세포 또한 기억 면역의 한 축이 된다. 재감염 시 기억 B 세포는 높은 결합 친화도(affinity)를 가진 새로운 형질세포로 분화되어 빠르게 대응한다. 장기적인 기억 면역은 장기 생존하는 형질세포(long-lived plasma cell)와 기억 B 세포가 형성한다.
COVID-19는 발병 시기 때문에 아직 장기 기억면역 반응에 대해 알 수 없지만, 다른 CoV 연 구 결과로부터 유용한 정보를 얻을 수 있다. SARS-CoV-1 감염에 대한 초기 특이적인 IgG 및 중화항 체 반응은 감염 후 2-3년이 경과한 후 감소하여 감염자 25%에서는 거의 검출되지 않는, 비교적 짧 은 체액성 반응 기간을 보였다. 34명의 SARS-CoV-1 감염자에 대한 13년 간의 장기 연구 결과에서도 바이러스 특이 IgG는 몇 년 후에 감소하였다. 하지만, 감염 12년 후에 검출 가능한 바이러스 특이 IgG를 확인하였다. SARS-CoV-2 S 단백질에 특이적인 IgG는 증상이 나타난 후 최대 60일까지 혈청에 서 검출되지만, IgG titer는 증상이 나타난 8주 후부터 감소하기 시작했다 [36, 67].
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 10 / 23
장기 기억 면역은 기억 B 세포가 재활성화되며 유도할 것이다. 감염 후 2, 4, 6, 8개월 시점에 SARS-CoV-1 S 단백질 특이 IgG 기억 세포를 분석한 결과, 감염 후 2-8개월에서 점차 감소하여 약 90% 감소하는 것으로 나타났다. 또한 23명에서 감염 6년 후 기억 T 세포 반응은 강력하게 검출되는
반면 혈액 내 SARS-CoV-1 특이 IgG+ 기억 B 세포는 확인되지 않았다. SARS-CoV-1 연구로부터, 바
이러스 특이 항체 반응은 시간이 지남에 따라 약해지고 재감염으로부터 부분적인 보호만 한다는 것 을 알 수 있었다 [10]. 즉, 1차 감염 이후 SARS-CoV-2에 대한 면역력이 감소할 수 있음을 시사하며, 장기 기억면역을 이해하기 위해서는 추가적인 연구가 필요할 것이다. B 세포 반응이 바이러스 제거와 기억 면역에 중요한 역할을 하지만, 질환을 악화시킬 수도 있다. SARS-CoV-2에 대한 바이러스 특이 항체 양은 중화항체 반응과 상관관계가 있으며, 체내 바이 러스 량과는 역상관관계가 있음이 여러 연구를 통해 입증되었다. 중화항체 반응이 나타나 바이러스 감염력을 낮추더라도 대부분의 환자에서 다량의 nAb는 증상의 심각성과 관련이 있었다. 또한 바이 러스에 대한 항체 반응이 항체의존감염증강(antibody-dependent enhancement, ADE – 항체가 체내 바이러스 증식을 돕는 현상)을 통해 폐렴 증상을 악화시킬 수 있다. 이 현상은 바이러스 특이 IgG 비 중화항체가 대식세포 및 단핵구와 같은 Fc-receptor (FcR) 발현 세포를 통해 바이러스의 침투를 촉진하여 이들 세포의 염증이 활성화되며 나타난다. SARS-CoV-1에 감염된 붉은털원숭이에서 anti-S IgG는 폐에 단핵구 및 대식세포가 과도하게 축적되도록 하여 중증 급성 폐손상(acute lung injury, ALI)을 악화시켰다. 다소 안심이 되는 것은, SARS-CoV-2 RBD를 접종한 쥐의 혈청에서는 ADE가 확인 되지 않았으며 SARS-CoV-2 불활화 백신을 접종한 원숭이에서도 확인되지 않았다 [61-63, 68-70]. 현 재까지, SARS-CoV-2에 대한 항체가 COVID-19에서 나타나는 병리학적 특징에 기여한다는 증거는 없 다. 그러나 치료 전략을 개발하고 실험 디자인을 함에 있어서 이러한 가능성은 고려되어야 할 것이 다.
3. COVID-19 치료제 개발 현황
3.1. 항바이러스제(Antivirals) 항바이러스제는 바이러스 생활사(life cycle)를 기반으로 하여 하나 이상의 단계를 차단하는 합성의약품(small molecule)이다. 바이러스 간 복제 기전이 유사하므로 일부 항바이러스제는 다양한 바이러스 감염에 사용될 수 있다. 현재 SARS-CoV-2에 대해 시험한 항바이러스제의 대부분은 이전에 SARS-CoV-1, MERS-CoV, 다른 RNA 및 DNA 바이러스에 대해 개발된 항바이러스제이다 [6-7, 10]. 현 재 COVID-19를 대상으로 다양한 항바이러스제가 임상시험을 진행 중이다. 바이러스 융합(fusion) 저 해제인 arbidol (umifenovir), 기존 인플루엔자 치료제인 Ansun의 sialidase 융합단백질인 DAS181, anti-HIV protease 저해제인 lopinavir/ritonavir (LPV/r), 중증 influenza 감염에 대한 RdRp 저해제인 favipiravir, remdesivir, 기존 독감 치료제로 개발 중이던 바이러스 복제 저해제인 Merck의Mol-nupiravir와 같이 기존 항바이러스제의 용도변경이 이에 해당하며 임상 2/3상 혹은 임상 3상을 진행
중이다. 그 외 기존 만성 췌장염, 위절제 수술 후 역류성 식도염 등에 사용되던 약물인 Camostat
mesylate는 TMPRSS2 저해제로서 바이러스 감염을 차단하는 기전으로 임상 3상을 진행 중이고
di-hydroorotate dehydrogenase (DHODH) 저해제인 PTC299는 바이러스 복제를 억제함이 확인되어 임 상 2/3상을 진행 중이다(2020년 12월 5일 기준).
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 11 / 23
3.1.1. RdRp 저해제
CoV RNA-dependent RNA polymerase (RdRp)는 바이러스 RNA 합성을 촉진해 바이러스 복 제에 필수적이며 항바이러스제의 주요 표적이 되고 있다 [71].
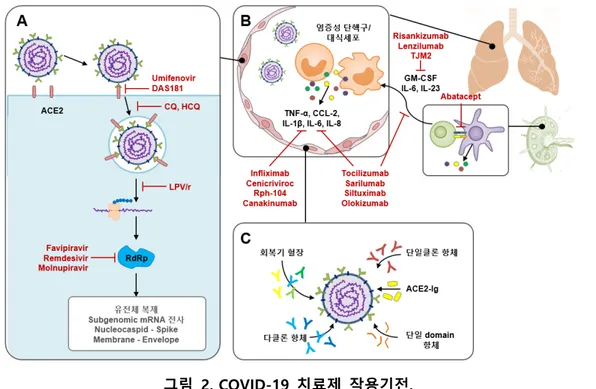
Gilead의 Veklury (remdesivir)는 adenosine triphosphate 유사체로서 RNA 가닥에 결합하여
추가 nucleotide가 첨가되는 것을 저해하여 RdRp 작용을 억제함으로써 바이러스 RNA 전사를 막는 다 (그림 2A). Remdesivir는 기존 에볼라 바이러스 치료제로 개발되던 약물이다. 미국 알레르기 감염 병 연구소(NIAID)가 1,000명 이상의 환자를 대상으로 진행한 대규모 임상에서 위약 대비 중증 COVID-19 환자의 회복 기간을 31%, 15일 대비 11일로 감소시키는 것으로 나타나 2020년 5월 1일 FDA로부터 COVID-19 중증 입원 환자에 대해 긴급 사용 승인(Emergency Use Authorization, EUA - 연구 진행 중인 단계로 대체 약이 없는 상황 등에서 의약품 사용이 가능하도록 하는 조치)을 받았다. 국내에도 7월 1일부터 COVID-19 치료제로 특례 수입되어 공급되고 있다. 그러나 일각에서는 Remdesivir 효과에 대해 의문을 품고 있다. 실제로 WHO는 전 세계 500개 병원에서 12,000여 명의 환자들을 대상으로 한 Solidarity 임상시험 중간결과에서 Remdesivir가 사망률이나 입원 기간 등에 영향을 미치지 않는 것으로 발표하였다. 그러나, FDA는 10월 22일 Remdesivir를 정식으로 승인하였 다. 효능에 대한 상반된 연구결과가 제시되고 있고 일부 환자에서는 메스꺼움과 급성 호흡부전 등의 안전성 논란이 있으나 뚜렷한 치료 대안이 없고 회복기간 단축에는 임상적 이점이 있어 정식사용 승인을 받은 것으로 해석되고 있다 [72-73].
Fujifilm의 Avigan (favipiravir)는 2014년 일본에서 승인받은 경구용 항바이러스제로 인플루
엔자 바이러스 복제에 필요한 RNA 중합효소를 선택적으로 억제하는 기전을 가지고 있다. 비중증 폐 렴 증상을 나타내는 COVID-19 환자 156명을 대상으로 한 임상 3상에서 favipiravir 투여군이 11.9일, 대조군 14.7일로 대조군 대비 회복 기간을 2.8일 감소시키며 1차 종결점을 충족시켰다(p=0.0136). Favipiravir는 10월 16일에 일본 후생노동성에 승인 신청을 했다.
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 12 / 23
3.1.2. Protease 저해제
RdRp 뿐만 아니라 3CL 또는 Main protease (Mpro) 또한 SARS-CoV-2에 대한 항바이러스제 개발의 표적이 되고 있다. 기존 anti-HIV protease 저해제인 AbbVie의 Kaletra (LPV/r)는 이전에 SARS-Cov-1 치료에서 효능을 보여 SARS-Cov-2에 대한 임상시험이 조기에 시작되었다 [74]. 그러나 영국의 176개 병원에서 11,800명 환자를 대상으로 한 대규모 임상시험인 RECOVERY 임상에서 LPV/r가 표준 요법 대비 임상적 유익성이 없는 것으로 나타났다. WHO 또한 Solidarity 연구에서 LPV/r와 hydroxychloroquine이 COVID-19 입원 환자의 사망률을 감소시키는데 실패한 것으로 나타 나 7월 4일 임상시험을 중단하였다. 국내에서도 COVID-19 상황 초기에는 중증 환자 치료에 쓰였으 나, 효과가 없거나, 미약하다는 연구 결과들이 이어지며 지난 6월 22일 신종감염병 중앙임상위원회 는 LPV/r가 효과가 없거나 미약할 것으로 추정되므로 투여 여부를 신중하게 결정하도록 권고하였다 3.2. 면역조절제 3.2.1. Chloroquine
Chloroquine (CQ)과 그 유도체인 hydroxychloroquine (HCQ)이 3월 19일 FDA에 긴급 사용 승인되어 COVID-19 치료제로 사용되고 있다. Bayer가 개발한 CQ는 1934년 상용화되어 말라리아 치 료 뿐만 아니라 류마티스 관절염 등 자가면역질환 치료에도 사용되고 있다. COVID-19에 대한 사용 은 과거 SARS-CoV-1를 비롯한 항바이러스제로 사용된 것에서 비롯되었다. CQ, HCQ는 lysosome의 활성을 저해하고 면역조절 효과가 있는 것으로 알려져 있다. in vitro 상에서 CQ, HCQ는 SARS-CoV-2 에 감염된 숙주 세포에서 endosome 성숙에 영향을 미쳐 바이러스가 endolysosome 내에 격리되도 록 하였다 [75-77]. 그러나, HCQ가 SARS-CoV-2를 저해하는 기전은 아직 명확하게 밝혀지지 않았다. COVID-19 치료에 HCQ와 CQ가 많이 사용되었음에도 불구하고 지금까지 임상적 유익성이 밝혀지지 않아 그 효능에 대해서는 여전히 논란이 남아 있다. FDA는 6월, 코로나19 치료 목적으로 허용했던 HCQ와 CQ에 대한 긴급 사용 승인을 취소하였다. 국내 식품의약품안전처도 6월 26일 보도 자료를 통해 국내 총 5건의 HCQ 임상시험이 승인되었으나, 치료적 유익성이 인정되지 않는 등 5건 모두 조기 종료하였다고 밝혔다. 3.2.2. Corticosteroid
Corticosteroid (CS)는 항염증 작용이 있어 ARDS 및 cytokine storm의 보조 치료제로 사용된 다. 특히 영국 옥스퍼드대 연구팀은 지난 6월 대규모 RECOVERY 임상에서 중증 환자를 대상으로 dexamethasone을 투여한 결과, 산소호흡기에 의지하는 환자의 사망률이 최대 40%, 기타 산소치료 를 받는 환자의 사망률은 최대 25%까지 감소하는 것으로 확인하였다. 이 결과로 영국에서는 dexa-methasone이 중증환자에 대한 표준치료제로 쓰이고 있다. 그러나, CS에 의한 전반적인 면역억제는 바이러스에 대한 면역반응 발달에 오히려 방해가 될 수 있다는 가능성도 제기되고 있다. 244명의 최 중증 COVID-19 환자를 대상으로 CS를 보조치료한 임상에서 28일 차 사망률에 차이가 없었고,
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 13 / 23
ARDS 환자에 대한 소집단 분석(subgroup analysis)에서 CS 치료와 임상 결과 사이의 연관성이 발견 되지 않았다 [78]. 현재 CS의 안전성과 유효성을 확인하기 위해 여러 임상이 진행되고 있으며 현재 까지 COVID-19에 대한 CS 사용 임상 결과는 약간의 임상적 유익성 또는 유의미한 효과가 없는 것 으로 나타났다. WHO는 9월 2일 중증 및 최중증 환자에게는 전신 CS 사용을 추천하지만 심각하지 않은 환자(경증 및 중등도)에게는 CS 사용을 제안하지 않는 가이드라인을 발표하였다. 동 가이드라 인에서 제시하는 CS에는 dexamethasone, hydrocortisone, prednisone, methylprednisolone의 4종이 해당된다.
3.2.3. IFN
IFN 기전도 COVID-19 치료제의 주요 타겟이 되고 있다. SARS-CoV-2 와 같은 RNA 바이러 스에 대한 숙주의 첫 번째 방어 수단은 IFN-I과 -III의 방출이다. IFN-I (IFNα/β) 수용체의 경우, 체내 전반적으로 발현되므로 항바이러스 효과 뿐만 아니라 면역세포를 활성화하여 질환을 악화시킬 수도 있다. 반면에 IFN-III (IFNλ)는 주로 상피세포와 제한된 면역세포에만 발현되고 면역조절 기능을 가지 므로 병원성 염증 작용을 유발하지 않으면서 항바이러스 효과를 유도할 수 있을 것이다. 실제로, SARS-CoV-2에 대한 면역 반응에서 IFN 신호전달이 손상되어 있으므로 [11, 24]. 이러한 연구들를 근 거로 IFN-I/III를 투여하는 임상이 진행되고 있다. 3.2.4. Cytokine 저해제
과도한 염증 반응과 IL-6, -8, -10을 포함한 염증성 cytokine의 증가는 COVID-19 증상의 심각 도와 상관관계가 있는 것으로 잘 알려져 있다. COVID-19 환자에서 나타나는 cytokine storm을 촉진 하는 기전이 명확하게 밝혀지지 않았지만, 바이러스 PAMP와 숙주의 위험신호(danger signal)에 의해 서 초기에 유발되는 것으로 보인다. 또한 COVID-19 cytokine storm의 염증성 cytokine이 단핵구 및 대식세포에서 방출되었음이 확인되고 있다 [20, 22, 45, 47, 79-83].
COVID-19 관련 CRS에서 IL-6가 중요한 역할을 하므로, IL-6를 타겟하는 항체가 후보 치료제 로 제시되고 있다 [80] (그림 2B). 항-IL-6R 항체로는 Roche의 Actemra (tocilizumab),
Sano-fi/Regeneron의 Kevzara (sarilumab)가, 항-IL-6 항체로는 Sylvant (siltuximab), R-Pharm의 Artlegia (olokizumab)이 COVID-19 CRS 및 폐렴 관리에 대한 유효성을 확인하기 위해 임상을 진행 중이다.
Tocilizumab과 sarilumab는 지난 7월 임상 3상에서 COVID-19 증상을 개선하지 못하고 임상 실패를 알린 바 있다. 그러나, 지난 9월 tocilizumab은 표준요법과 병용 투여한 임상 3상에서 표준요법 대비 기계적 인공호흡 또는 사망으로 진행될 가능성을 44% 감소시킴을 확인하였다.
IL-6 외에도 IL-1β, IL-23 GM-CSF, TNF-α와 같은 다른 cytokine 및 CCR2, CCR5와 같은 chemokine 관련 인자가 COVID-19 CRS를 치료하기 위한 타겟으로 제시되고 있다. 현재 기존 류마티 스관절염 치료제인 Janssen의 TNF-α 저해제 Remicade (infliximab), BMS의 T 세포 활성 억제제
Orencia (abatacept; 항원제시세포의 CD80/86에 결합하여 T 세포 활성 억제) 및 기존 비알콜성지방
간염(NASH) 치료제인 Abbvie의 CCR2/CCR5 저해제 Cenicriviroc이 입원 환자를 대상으로 임상 3상 (ACTIV-1)을 진행 중이다. 또한 Abbvie의 건선치료제인 IL-23 저해제 Skyrizi (Risankizumab) 및
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 14 / 23
Humanizen의 GM-CSF 저해제인 Lenzilumab이 임상2상(ACTIV-5)을 진행중이다. 또한 R-Pharm의 IL-1β 저해제 Rph-104, I-Mab의 GM-CSF 저해제인 TJM2 (TJ003234)이 중증 환자를 대상으로 임상
3상을 진행 중이다. 한편, 최근 Novartis의 IL-1β 저해제 Ilaris (canakinumab)는 입원환자를 대상으 로 한 임상 3상 중간분석 결과에서, 생존률 및 치사율 개선 효과를 입증하지 못하고 1차 종결점을 충족시키지 못했음을 발표한 바 있다.
그 외 현재 다양한 면역조절제가 COVID-19 환자를 대상으로 임상을 진행 중이다. Amgen의 건선약 항염증제인 Otezla (apremilast), Novartis/Incyte의 골수섬유증 치료제 JAK1/2 억제제인 Jakavi (ruxolitinib), Vanda의 neurokinin-1 수용체 저해제인 tradipitant, 기존 뇌출혈 및 뇌경색 후유증 치료 제인 Algernon의 N-methyl-d-aspartate (NDMA) 수용체 저해제인 Ifenprodil (NP-120)가 임상 3상을 진행 중이다.
3.3. 혈장치료 및 중화항체
3.3.1. 회복기 혈장치료(Convalescent plasma therapy)
SARS-CoV-2에 대해 스스로 nAb를 만들 수 있도록 백신을 개발하고 있지만, nAb를 투여하 는 치료법도 개발되고 있다 (그림 2C). 재조합 nAb가 효과적인 치료일 지더라도, 개발, 테스트, 생산 규모를 확장하기 위해서는 상당한 시간이 필요하다. 보다 빠른 전략으로는 SARS-CoV-2에 대한 높은 농도의 nAb를 생성하였던 완치자로부터 회복기 혈장(convalescent plasma, CP)을 채혈하여 COVID-19 환자에게 주입하는 수혈요법이 치료에 사용되고 있다. 적절하게 통제된 임상시험 결과는 부족하 나 CP 요법은 1918년 influenza, H1N1 influenza, SARS-CoV-1과 같은 여러 전염병에서 치료적 유익 성을 확인한 바 있다. 혈청학적 검사법(serological test)이 개발되어 회복한 COVID-19 환자 중 항체 titer가 높은 혈장을 선별할 수 있다 [84-86]. 현재 중증 COVID-19에 대한 CP 치료의 효능 및 안전성이 보고되고 있다. 통제되거나 무작 위 임상은 아니었지만, CP 치료가 안전하고 임상적 유익성이 있음이 확인되었다. FDA는 이를 근거로 8월 23일 CP 사용을 긴급사용 승인하였다 [87]. 9월 8일 인도의학연구위원회(ICMR)는 최초로 무작위 대조군 임상을 완료하고 결과를 발표하였다. 중증 환자 464명을 대상으로 한 임상에서 표준요법 대 비 사망률을 낮추지는 못했으나, 증상이 일부 개선된 것으로 나타났다. 전반적으로 CP 치료는 증상 을 개선시키고 안전한 것으로 나타났으나, 최적의 투여시기 및 양, 횟수, 적응증 등을 결정하기 위해 서는 적절히 통제된 임상연구가 보다 필요할 것이다. 3.3.2. 중화항체(nAb) 회복기 혈장에는 수십억 개의 서로 다른 항체가 섞여 있다. 일부는 SARS-CoV-2를 공격하지 만 대다수는 다른 병원균에 대한 항체이다. 따라서 회복기 혈장에서 가장 강력한 중화효과를 보이는 항체를 선별한 항체치료제가 개발되고 있다. 이러한 치료제의 효능은 SARS-CoV-1, MERS-CoV에서 입증된 바 있다. 현재 자연 감염 혹은 동물 예방접종을 통해 SARS-CoV-2에 대한 nAb를 생성하는데 초점을 맞추고 있다.
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 15 / 23
먼저, SARS-CoV-2 감염에서 회복된 환자들로부터 nAb를 얻기 위한 연구들이 진행되고 있다. RBD-특이 기억 B 세포를 분리하고 그 항체의 가변영역(variable region)을 복제하여 재조합 항체를 제조한다. SARS-CoV-1과 SARS-CoV-2는 80%의 상동성이 있으므로, COVID-19 치료제의 개발 가속화 를 위해 SARS-CoV-1 nAb에 대한 SARS-CoV-2와의 교차반응성(cross reactivity)도 확인되고 있다. SARS-CoV-1 완치자의 기억 B 세포로부터 분리한 25개 항체 중 8개는 SARS-CoV-2 S 단백질에 결합 하였고 그중 하나는 (s309) SARS-CoV-2를 중화시켰다. Vir Biotechnology는 s309를 기반으로 2개의 치료제 후보물질(VIR-7831, VIR-7832)을 개발하였고 현재 GSK/Vir의 VIR-7831 (GSK4182136)이 중 증 환자를 대상으로 임상 3상을 진행 중이다 [66, 88-89].
또한 동물 모델에서 SARS-CoV-2에 대한 nAb를 생성하고 있다. 한 연구에서는 중사슬의 가 변영역(variable heavy (VH) chain) 만을 포함하는 작은 항체인, 사람 nanobody를 낙타에서 합성하는 프로토콜을 개발하였다. SARS-CoV-2나 유도체를 이용하여 동물 모델에서 효과적인 nAb를 생성하는 데 초점이 맞춰져 있으며, 이미 Regeneron의 REGN-COV2이 임상시험에 진입하였다. 마지막으로, nAb를 개발하기 위한 또 다른 접근법으로 ACE2 단백질과 항체의 Fc 부분을 융합하는 연구가 시도 되고 있다. 실제로 ACE2-Fc 및 RBD-Fc는 in vitro 상에서 SARS-CoV-2를 중화시켰다 [90-92].
현재 중화항체로 다수의 임상이 진행되고 있다. Eli Lilly의 bamlanivimab (LY-CoV555)는 단 독 또는 etesevimab (LV-CoV016)과의 병용요법으로 COVID-19 외래 환자를 대상으로 임상2/3상 (ACTIV-2)을 진행 중이다. 중간분석 결과에서 병용 투여 11일 차에 바이러스 검출량이 유의미하게 감소되며 1차 종결점을 충족시켰다 (p=0.011). 이 결과를 바탕으로 지난 11월 9일 FDA는 경증에서 중등도 COVID-19 환자와 코로나19 양성 판정을 받은 12세 이상 어린이에 대해 긴급사용 승인하였 다. 다만, 입원 환자를 대상으로 LY-CoV555와 표준치료제인 remdesivir를 함께 투여하던 임상 2/3상 (ACTIV-3)은 안전성 문제로 잠정 중단되었다가 유효성 부족으로 중단되었다. Regeneron의
REGN-COV2는 REGN10933과 REGN10987이 포함된 항체 칵테일 치료제이다. 임상 2/3상을 진행 중이며,
바이러스 검출량이 감소하고 병원 방문이 유의미하게 줄어드는 긍정적인 결과를 확인하여 11월 21 일 FDA로부터 긴급사용승인을 받았다. 그러나, 입원환자에 대한 임상은 효능이 제한적이고 안전성 우려로 중단되었다. 항체치료제가 중증 환자보다는 초기 환자 또는 예방 요법에 집중해야 한다는 쪽 으로 전문가들의 의견이 기울고 있다. AstraZeneca의 AZD7442는 회복기 환자 혈청 유래 2가지 단 일클론항체로 이뤄진 항체 칵테일 치료제로 자사의 반감기 연장 기술을 접목하여 치료 지속성을 6 개월에서 12개월까지 기대하고 있다. 현재 중증 환자를 대상으로 임상 3상을 진행 중이다(ACTIV-3). 국내에서는 셀트리온 CT-P59가 경증 환자를 대상으로 진행한 임상 1상에서 안전성 및 위약군 대비 증상 회복 기간 44% 단축 효과를 확인하였다. 현재 경증 및 중등도 환자를 대상으로 임상 2/3상을 진행 중이다.
4. COVID-19 백신 개발 현황
SARS-CoV-2는 SARS-CoV-1과 마찬가지로 N, E (envelope), S, M 의 4개의 구조 단백질을 발 현한다. 이러한 단백질은 nAb 생성을 유도할 수 있는 잠재적인 항원이 된다. 따라서 우세한 중화 epitope (dominant neutralizing epitope)를 찾는 것이 백신 개발의 첫걸음이 된다. 그보다 앞서 불활 화 백신(inactivated virus)이 전세포 사백신(whole-killed virus) 보다 제조하기 쉬워 1세대 백신으로 사용될 수 있다. SARS-CoV-1에 대한 연구에서 formaldehyde, β-propiolactone, UV광과 같은 작용제 로 바이러스를 불활화하여 동물모델에 투여 시 nAb를 형성할 수 있음을 확인한 바 있다. 따라서 불
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 16 / 23 활화한 SARS-CoV-2도 백신으로 사용될 수 있다. 전세포 사백신이나 약독화 생백신(live-attenuated vaccine)은 단백질, 핵산, 다당류, 지질, 등 병원체의 모든 항원을 제시할 수 있다. 약독화 생백신은 감염 과정을 모방하여 TLR을 자극하고 장기 면역을 유발할 수 있으나, 병원성을 낮추거나 없애는 것 이 중요하다. 또한 사백신은 품질의 일관성을 유지하는 것이 어려운 단점이 있다. 따라서, 중화 epitope를 포함하는 단백질 일부를 기반으로 한 백신이 바이러스를 기반으로 한 백신 대비 안전하 고 효과적으로 사용될 수 있다 [7, 10]. 대부분의 CoV에 대한 백신은 S 단백질이 가장 유망한 타겟이 되고 있다. S 단백질은 바이러 스 진입과 면역반응 자극에 중요한 역할을 한다. 특히 ACE2 수용체에 결합하는 S 단백질의 RBD를 이용하면 바이러스가 숙주 세포로 진입하는 것을 막을 수 있다. 여러 연구를 통해 CoV의 S 단백질 RBD에 nAb 형성을 유도할 수 있는 주요 항원결정인자(antigenic determinant)가 포함되어 있음을 확 인하였다. 따라서 RBD를 포함하는 단백질이나 이에 대한 유전자 및 이 유전자를 전달하는 벡터는 효과적인 백신 개발에 활용될 수 있다 [7, 10] (표 1; 2020년 12월 5일 기준). 표 1. 임상 3상 단계 COVID-19 백신 개발 현황. 종류 후보물질 (기술-타겟) 개발사 개발단계 임상결과 핵산 백신 mRNA-1273 (mRNA-S 단백질) Moderna (미국) 3상 3상 결과 예방효율 94.1% BNT162b2 (mRNA-RBD) Pfizer/BioNTech (미국/독일) 2/3상 (영국 긴급사용 승인) 3상 중간결과, 예방효율 90% 바이러스 벡터 백신 Ad5-nCov (Ad5-RBD) CanSino (중국) 3상 (중국 군인 대상 승인) 2상 결과, 50~75% 중화항체 형성 Sputnik V (Ad5+Ad26 -S 단백질) Gamaleya Research Institute (러시아) 3상 (러시아 내 승인) 3상 중간 결과, 예방효율 92% JNJ-78436735 (Ad26+PER.C6 - S 단백질) J&J (미국) 3상 1/2a상 중간결과, 98% 중화항체 형성 AZD1222 (ChAdOx1 -S 단백질) AstraZeneca/ Oxford 대학 (영국/스웨덴) 2/3상 3상 중간결과, 예방효율 62~90% 재조합 단백질 백신 NVX-CoV2373 (재조합 S 단백질) Novavax (미국) 3상 임상1상 결과, 100% 중화항체 형성 CoVLP (재조합 S 단백질) GSK/medicago (캐나다) 2/3상 -
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 17 / 23 생백신/ 사백신 - 우한생명과학제품연 구소/Sinopharm (중국) 3상 (UAE 긴급 승인) 2상 결과, 90% 중화항체 형성 - Sinopharm/ 베이징 생명과학제품연구소 (중국) 3상 (UAE 긴급 승인) - CoronVac (SAS-CoV-2 불활화) Sinovac (중국) 3상 (중국내 긴급 승인) 1/2상 결과 90%중화항체 형성 Covaxin (SAS-CoV-2 불활화) Bharat Biotech (인도) 3상 - 용도변경 백신 BCG 백신 Murdoch Children’s Research Institute (호주) 3상
III. 결론
SARS-CoV-2의 급속한 확산은 기초과학 및 임상연구에 긴급성을 필요로 하였고 단 몇 개월 만에 SARS-CoV-2 감염에 대한 면역반응 이해에 상당한 과학적 진보가 있었다. SARS-CoV-1 및 MERS-CoV와 같은 과거 코로나바이러스에 대한 연구가 기반이 되었다. 실제로 COVID-19의 중증 증 상은 SARS-CoV-1 및 MERS-CoV의 CRS와 같은 CoV의 특정 면역병리와 유사하였다. 그러나 여러 측 면에서 SARS-CoV-2에 대한 면역반응은 다른 CoV와 달랐다. COVID-19 확진자는 상당수가 무증상으 로 다른 CoV 보다 잠복기가 길고 전염력이 높으며, 숙주 면역 반응에서도 상당한 차이를 보였다. 따라서 COVID-19에 대한 치료 전략을 보다 잘 수립하기 위해서는 숙주의 면역반응과 과도 한 염증반응에 의한 병리 기전에 대한 이해를 높일 필요가 있다. 본 리뷰에서는 바이러스의 면역 회 피 기전과 바이러스에 대한 과도한 염증반응 기전을 알아보았다. 과도한 염증 반응을 조절하는 것은 바이러스를 타겟하는 것 만큼 중요할 것이다. 바이러스 감염을 억제하고 면역 반응을 조절하는 치료 법은 여러 단계에서 증상의 악화를 막고 시너지 효과를 낼 것이다. 또한 보다 효과적인 치료제 개발 을 위해서는 정상적인 면역 반응과 비정상적인 면역반응이 나타나는 결정적인 요인에 대한 상세한 연구가 필요할 것이다IV. 참고문헌
[1] De Wit E. et al. SARS and MERS: Recent insights into emerging coronaviruses. Nat. Rev. Genet. 2016;14:523– 534.
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 18 / 23 https://www.covid19treatmentguidelines.nih.gov/antiviral-therapy/
[3] Duan K., et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc. Natl. Acad. Sci. USA. 2020;117:9490–9496.
[4] Administration UFad Coronavirus (COVID-19) Update: FDA Issues Emergency Use Authorization for Potential COVID-19 Treatment. Available online:
https://www.fda.gov/news-events/press- announcements/coronavirus-covid-19-update-fda-issues-emergency-use-authorization-potential-covid-19-treatment.
[5] Chaib F. WHO Welcomes Preliminary Results about Dexamethasone Use in Treating Critically Ill COVID-19 Patients. World Health Organization. Available online: https://www.who.int/news-room/detail/16-06-2020-who-welcomes-preliminary-results-about-dexamethasone-use-in-treating-critically-ill-covid-19-patients. [6] Tay MZ, et al. The trinity of COVID-19: immunity, inflammation and intervention. Nat Rev Immunol. 2020
Jun;20(6):363-374.
[7] Saha RP, et al. Repurposing Drugs, Ongoing Vaccine, and New Therapeutic Development Initiatives Against COVID-19. Front Pharmacol. 2020 Aug 19;11:1258.
[8] Ibrahim IM, et al. COVID-19 spike-host cell receptor GRP78 binding site prediction. J Infect. 2020 May;80(5):554-562.
[9] Ha DP, et al. The stress-inducible molecular chaperone GRP78 as potential therapeutic target for coronavirus infection. J Infect. 2020 Sep;81(3):452-482.
[10] Vabret N, et al. Immunology of COVID-19: Current State of the Science. Immunity. 2020 Jun 16;52(6):910-941.
[11] Blanco-Melo et al. Imbalanced Host Response to SARS-CoV-2 Drives Development of COVID-19. Cell. 2020 May 28;181(5):1036-1045.e9.
[12] Lokugamage et al. Type I Interferon Susceptibility Distinguishes SARS-CoV-2 from SARS-CoV. J Virol. 2020 Nov 9;94(23):e01410-20.
[13] Mantlo et al. Antiviral activities of type I interferons to SARS-CoV-2 infection. Antiviral Res. 2020 Jul;179:104811.
[14] Stanifer et al. Critical Role of Type III Interferon in Controlling SARS-CoV-2 Infection in Human Intesti-nal Epithelial Cells. Cell Rep. 2020 Jul 7;32(1):107863.
[15] Pfaender et al. LY6E impairs coronavirus fusion and confers immune control of viral disease. Nat Mi-crobiol. 2020 Nov;5(11):1330-1339.
[16] Zhao et al. LY6E Restricts Entry of Human Coronaviruses, Including Currently Pandemic SARS-CoV-2. J Virol. 2020 Aug 31;94(18):e00562-20.
[17] Hadjadj et al. Impaired type I interferon activity and inflammatory responses in severe COVID-19 pa-tients. Science. 2020 Aug 7;369(6504):718-724.
[18] Li et al. Virus-host interactome and proteomic survey of PMBCs from COVID-19 patients reveal poten-tial virulence factors influencing SARS-CoV-2 pathogenesis. Med (N Y). 2020 Jul 21. Online ahead of print. [19] Mehta et al. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet.
2020;395:1033–1034.
[20] Giamarellos-Bourboulis et al. Complex Immune Dysregulation in COVID-19 Patients with Severe Res-piratory Failure. Cell Host Microbe. 2020 Jun 10;27(6):992-1000.e3.
[21] Zhang et al. COVID-19 infection induces readily detectable morphologic and inflammation-related pheno-typic changes in peripheral blood monocytes. J Leukoc Biol. 2020 Oct 11;10.
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 19 / 23 [22] Zhou et al. Aberrant pathogenic GM-CSF+ T cells and inflammatory CD14+CD16+ monocytes in se-vere
pulmonary syndrome patients of a new coronavirus. bioRxiv. 2020 doi: 10.1101/2020.02.12.945576. [23] Liao et al. Single-cell landscape of bronchoalveolar immune cells in patients with COVID-19. Nat Med.
2020 Jun;26(6):842-844.
[24] Prokunina-Olsson et al. COVID-19 and emerging viral infections: The case for interferon lambda. J. Exp. Med. 2020;217:e20200653.
[25] Barnes et al. Targeting potential drivers of COVID-19: Neutrophil extracellular traps. J. Exp. Med. 2020;217:e20200652.
[26] Amanat et al. A serological assay to detect SARS-CoV-2 seroconversion in humans. Nat Med. 2020 Jul;26(7):1033-1036.
[27] Song et al. COVID-19 early warning score: a multi-parameter screening tool to identify highly sus-pected patients. medRxiv. 2020 doi: 10.1101/2020.03.05.20031906.
[28] Wang et al. Definition and Risks of Cytokine Release Syndrome in 11 Critically Ill COVID-19 Patients With Pneumonia: Analysis of Disease Characteristics. J Infect Dis. 2020 Oct 1;222(9):1444-1451.
[29] Yu et al. Immunodepletion with Hypoxemia: A Potential High Risk Subtype of Coronavirus Disease 2019. medRxiv. 2020 doi: 10.1101/2020.03.03.20030650
[30] Zheng et al. Functional exhaustion of antiviral lymphocytes in COVID-19 patients. Cell. Mol. Immunol. 2020;17:533–535.
[31] Wilk et al. A single-cell atlas of the peripheral immune response to severe COVID-19. medRxiv. 2020 doi: 10.1101/2020.04.17.20069930.
[32] Travaglini et al. A molecular cell atlas of the human lung from single cell RNA sequencing. Nature. 2020 Nov 18. doi: 10.1038/s41586-020-2922-4. Online ahead of print.
[33] Wang et al. Characteristics of peripheral lymphocyte subset alteration in COVID-19 pneumonia. J. In-fect. Dis. 2020;221:1762–1769.
[34] Wilk A.J., et al. A single-cell atlas of the peripheral immune response to severe COVID-19. medRxiv. 2020 doi: 10.1101/2020.04.17.20069930.
[35] Huang et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lan-cet. 2020;395:497–506.
[36] Guo et al. Tocilizumab treatment in severe COVID-19 patients attenuates the inflammatory storm in-cited by monocyte centric immune interactions revealed by single-cell analysis. bioRxiv. 2020 doi:
10.1101/2020.04.08.029769.
[37] Chen G., et al. Clinical and immunological features of severe and moderate coronavirus disease 2019. J. Clin. Invest. 2020 doi: 10.1172/JCI137244.
[38] Nie S., et al. Metabolic disturbances and inflammatory dysfunction predict severity of coronavirus dis-ease 2019 (COVID-19): a retrospective study. medRxiv. 2020 doi: 10.1101/2020.03.24.20042283.
[39] Zeng Q., et al. Mortality of COVID-19 is Associated with Cellular Immune Function Compared to Im-mune Function in Chinese Han Population. medRxiv. 2020 doi: 10.1101/2020.03.08.20031229
[40] Zhou Y., et al. Pathogenic T cells and inflammatory monocytes incite inflammatory storm in severe COVID-19 patients. Natl. Sci. Rev. 2020 doi: 10.1093/nsr/nwaa041. Published online March 13, 2020.
[41] Liu J., et al. Neutrophil-to-lymphocyte ratio predicts critical illness patients with 2019 coronavirus dis-ease in the early stage. J. Transl. Med. 2020;18:206.
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 20 / 23 Transduct. Target. Ther. 2020;5:33.
[43] Thevarajan I., et al. Breadth of Concomitant Immune Responses Prior to Patient Recovery: A Case Re-port of Non-Severe COVID-19. Nat. Med. 2020;26:453–455.
[44] Liu B., et al. Persistent SARS-CoV-2 presence is companied with defects in adaptive immune system in non-severe COVID-19 patients. medRxiv. 2020 doi: 10.1101/2020.03.26.20044768
[45] Diao B., et al. Reduction and Functional Exhaustion of T Cells in Patients with Coronavirus Disease 2019 (COVID-19) Front. Immunol. 2020 doi: 10.3389/fimmu.2020.00827. Published online May 1, 2020.
[46] Liu J., et al. Longitudinal characteristics of lymphocyte responses and cytokine profiles in the periph-eral blood of SARS-CoV-2 infected patients. EBioMedicine. 2020;55:102763.
[47] Wan S., et al. Characteristics of lymphocyte subsets and cytokines in peripheral blood of 123 hospital-ized patients with 2019 novel coronavirus pneumonia (NCP) medRxiv. 2020 doi: 10.1101/2020.02.10.20021832. [48] Chen X., et al. Restoration of leukomonocyte counts is associated with viral clearance in COVID-19
hospi-talized patients. medRxiv. 2020 doi: 10.1101/2020.03.03.20030437.
[49] Xu Z., et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir. Med. 2020;8:420–422.
[50] Tian S., et al. Pathological study of the 2019 novel coronavirus disease (COVID-19) through postmor-tem core biopsies. Mod. Pathol. 2020 doi: 10.1038/s41379-020-0536-x. Published online April 14, 2020.
[51] Qin C., Zhou L., Hu Z., Zhang S., Yang S., Tao Y., Xie C., Ma K., Shang K., Wang W. Dysregulation of Immune Response in Patients with COVID-19 in Wuhan, China. Clin. Infect. Dis. 2020 doi: 10.1093/cid/ciaa248. Pub-lished online March 12, 2020.
[52] Lei L., Qian H., Yang X., Zhou X., Zhang X., Zhang D., Dai T., Guo R., Shi L., Cheng Y. The phenotypic chang-es of γδ T cells in COVID-19 patients. medRxiv. 2020 doi: 10.1101/2020.04.05.20046433.
[53] Weiskopf D., Schmitz K.S., Raadsen M.P., Grifoni A., Okba N.M.A., Endeman H., van den Akker J.P.C., Mo-lenkamp R., Koopmans M.P.G., van Gorp E.C.M. Phenotype of SARS-CoV-2-specific T-cells in COVID-19 pa-tients with acute respiratory distress syndrome. medRxiv. 2020 doi: 10.1101/2020.04.11.20062349.
[54] Ni L., Ye F., Chen M.-L., Feng Y., Deng Y.-Q., Zhao H., Wei P., Ge J., Gou M., Li X. Detection of SARS-CoV-2-Specific Humoral and Cellular Immunity in COVID-19 Convalescent Individuals. Immunity. 2020 doi: 10.1016/j.immuni.2020.04.023. Published online May 3, 2020.
[55] Braun J., Loyal L., Frentsch M., Wendisch D., Georg P., Kurth F., Hippenstiel S., Dingeldey M., Kruse B., Fau-chere F. Presence of SARS-CoV-2 reactive T cells in COVID-19 patients and healthy donors. medRxiv. 2020 doi: 10.1101/2020.04.17.20061440.
[56] Yang X., Dai T., Zhou X., Qian H., Guo R., Lei L., Zhang X., Zhang D., Shi L., Cheng Y. Analysis of adap-tive immune cell populations and phenotypes in the patients infected by SARS-CoV-2. medRxiv. 2020 doi: 10.1101/2020.03.23.20040675.
[57] Zheng H.-Y., Zhang M., Yang C.-X., Zhang N., Wang X.-C., Yang X.-P., Dong X.-Q., Zheng Y.-T. Elevated ex-haustion levels and reduced functional diversity of T cells in peripheral blood may predict severe progres-sion in COVID-19 patients. Cell. Mol. Immunol. 2020;17:541–543.
[58] Haveri A., Smura T., Kuivanen S., Österlund P., Hepojoki J., Ikonen N., Pitkäpaasi M., Blomqvist S., Rönkkö E., Kantele A. Serological and molecular findings during SARS-CoV-2 infection: the first case study in Finland, January to February 2020. Euro Surveill. 2020;25:2000266.
[59] Lou B., Li T., Zheng S., Su Y., Li Z., Liu W., Yu F., Ge S., Zou Q., Yuan Q. Serology characteristics of SARS-CoV-2 infection since the exposure and post symptoms onset. medRxiv. 2020 doi:
COVID-19에 대한 면역반응 및 치료제/백신 개발 동향 정의경 Page 21 / 23 10.1101/2020.03.23.20041707.
[60] Tan W., Lu Y., Zhang J., Wang J., Dan Y., Tan Z., He X., Qian C., Sun Q., Hu Q. Viral Kinetics and Anti-body Responses in Patients with COVID-19. medRxiv. 2020 doi: 10.1101/2020.03.24.20042382.
[61] Okba N.M.A., Müller M.A., Li W., Wang C., GeurtsvanKessel C.H., Corman V.M., Lamers M.M., Sikkema R.S., de Bruin E., Chandler F.D. Severe Acute Respiratory Syndrome Coronavirus 2-Specific Antibody Responses in Coronavirus Disease 2019 Patients. Emerg. Infect. Dis. 2020;26 doi: 10.3201/eid2607.200841.
[62] Wölfel R., Corman V.M., Guggemos W., Seilmaier M., Zange S., Müller M.A., Niemeyer D., Jones T.C., Vollmar P., Rothe C. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020 doi:
10.1038/s41586-020-2196-x. Published online April 1, 2020.
[63] Zhao J., Yuan Q., Wang H., Liu W., Liao X., Su Y., Wang X., Yuan J., Li T., Li J. Antibody Responses to SARS-CoV-2 in Patients of Novel Coronavirus Disease 2019. Clin. Infect. Dis. 2020 doi: 10.1093/cid/ciaa344. Pub-lished online March 28, 2020.
[64] To K.K.-W., Tsang O.T.-Y., Leung W.-S., Tam A.R., Wu T.-C., Lung D.C., Yip C.C.-Y., Cai J.-P., Chan J.M.-C., Chik T.S.-H. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum anti-body re-sponses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect. Dis. 2020;20:565– 574.
[65] Wu F., Wang A., Liu M., Wang Q., Chen J., Xia S., Ling Y., Zhang Y., Xun J., Lu L. Neutralizing antibody re-sponses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their implications. medRxiv. 2020 doi: 10.1101/2020.03.30.20047365.
[66] Ju B., Zhang Q., Ge X., Wang R., Sun J., Ge X., Yu J., Shan S., Zhou B., Song S. Human neutralizing an-tibodies elicited by SARS-CoV-2 infection. Nature. 2020 doi: 10.1038/s41586-020-2380-z. Published online May 26, 2020
[67] Adams E.R., Anand R., Andersson M.I., Auckland K., Baillie J.K., Barnes E., Bell J., Berry T., Bibi S., Carroll M. Evaluation of antibody testing for SARS-Cov-2 using ELISA and lateral flow immunoassays. medRxiv. 2020 doi: 10.1101/2020.04.15.20066407.
[68] Li K., Chen D., Chen S., Feng Y., Chang C., Wang Z., Wang N., Zhen G. Radiographic Findings and oth-er Predictors in Adults with Covid-19. medRxiv. 2020 doi: 10.1101/2020.03.23.20041673.
[69] Quinlan B.D., Mou H., Zhang L., Guo Y., He W., Ojha A., Parcells M.S., Luo G., Li W., Zhong G. The SARS-CoV-2 receptor-binding domain elicits a potent neutralizing response without antibody-dependent en-hancement. bioRxiv. 2020 doi: 10.1101/2020.04.10.036418
[70] Gao Q., Bao L., Mao H., Wang L., Xu K., Yang M., Li Y., Zhu L., Wang N., Lv Z. Rapid development of an in-activated vaccine for SARS-CoV-2. bioRxiv. 2020 doi: 10.1101/2020.04.17.046375.
[71] Gao K., Nguyen D.D., Wang R., Wei G.-W. Machine intelligence design of 2019-nCoV drugs. bioRxiv. 2020 doi: 10.1101/2020.01.30.927889.
[72] Agostini M.L., Andres E.L., Sims A.C., Graham R.L., Sheahan T.P., Lu X., Smith E.C., Case J.B., Feng J.Y., Jordan R. Coronavirus Susceptibility to the Antiviral Remdesivir (GS-5734) Is Mediated by the Viral Pol-ymerase and the Proofreading Exoribonuclease. MBio. 2018;9:e00221. e18.
[73] Ledford H. Hopes rise for coronavirus drug remdesivir. Nature. 2020 https://www.nature.com/articles/d41586-020-01295-8
[74] Li Y., Xie Z., Lin W., Cai W., Wen C., Guan Y., Mo X., Wang J., Wang Y., Peng P. An exploratory random-ized controlled study on the efficacy and safety of lopinavir/ritonavir or arbidol treating adult patients hospital-ized with mild/moderate COVID-19 (ELACOI) medRxiv. 2020 doi: 10.1101/2020.03.19.20038984.