이학 석사학위 논문
고농도 포도당과 Palmitate에 의한
INS-1 베타세포의 세포사 기작 연구
아 주 대 학 교 대 학 원
의 학 과
이 연 정
고농도 포도당과 Palmitate에 의한
INS-1 베타세포의 세포사 기작 연구
지도교수 강 엽
이 논문을 이학 석사학위 논문으로 제출함.
2008년 8월
아 주 대 학 교 대 학 원
의 학 과
이 연 정
이연정의
이학
석사학위
논문을
인준함.
심사위원장 강 엽
인
심
사
위
원 이 관 우
인
심
사
위
원 정 윤 석
인
아 주 대 학 교 대 학 원
2008년 6월 23일
- 국문요약 -
고농도 포도당과 Palmitate에 의한 INS-1 베타세포의
세포사 기작 연구
당뇨병은 인슐린이 부족하거나 인슐린이 제대로 작용하지 못하여 혈액내의 포도당 농도가 높아져서 발생하는 만성대사질환이다. 인슐린 저항성 이외에도 포 도당자극인슐린분비(GSIS)의 감소, 인슐린 유전자 발현의 감소, 베타세포의 양적 감소에 의한 베타세포의 기능이상이 제 2형 당뇨병을 유발시키는 중요한 병인으 로 인식되고 있다. 이 중에서 베타세포의 양적감소는 베타세포의 복제 및 신생이 불충분하고 세포사가 상대적으로 많이 일어나서 나타나게 된다고 생각된다. 고혈 당과 함께 높은 농도의 FFA는 베타세포의 양적 감소를 유발한다고 생각하고 있 다. 포도당과 지방산에 의한 베타세포의 양적 감소의 기작은 첫 번째로 베타세포 가 지속적으로 포도당에 노출되게 되면 ROS가 생성되고, 이로 인해 산화적 스트 레스가 유발되어 지방산독성이 나타난다고 알려져 있다. 두 번째로 베타세포가 지속적으로 FFA에 노출되면 JNK, NF-κB, p38과 같은 여러 가지 stress 신호와 ER stress의 유발, 생존 신호인 AKT 신호의 감소 등에 의해서 베타세포에 지방 산독성이 나타난다고 알려져 있다. 세 번째로 포도당과 FFA가 동시에 지속적으 로 존재하게 될 때 ceramide의 합성, PKC 신호의 활성에 의한 포도당/지방산독 성이 나타나게 된다. 본 연구에서는 INS-1 베타 세포에서 포도당/지방산독성이 나타나는지 확인하고, 이때 어떤 기작으로 세포사멸이 유도되는지를 연구하였다. INS-1 베타세포에서 palmitate의 농도를 400 μM로 고정하고 포도당 농도 를 25 mM로 처리한 경우 INS-1 세포의 생존율이 감소하였다. INS-1 세포의 생 존율 감소는 DNA fragmentation의 증가, Caspase 3와 PARP의 활성화, DAPI염색을 통하여 핵이 응축되는 현상을 확인하여 apoptosis를 통한 세포사라고 밝 혔다. 산화적 스트레스와 스트레스 신호 관련 저해제에 의해서는 세포사 저해효 과가 나타나지 않았고, ER 스트레스, Ca2+ 신호 관련 약제에 의해서는 세포사 저 해효과가 나타났다. 베타산화를 촉진 시켜주는 bezafibrate 와 AICAR에 의해 INS-1 세포사멸 저해 효과가 가장 크게 나타난 사실을 확인하여 지방대사에 관 점을 두었다. ACC 저해제인 TOFA에 의해 세포사멸이 더 촉진되었고 지방합성 을 저해하는 FAS 저해제인 cerulenin에 의해 세포사 억제효과가 나타났다. 또한 지방합성을 촉진시키는 T0901317에 의해서는 오히려 세포사멸 억제효과가 가장 뛰어나게 나타났다. 이런 사실로 지방합성 자체가 HG/PA에 의해 유도되는 INS-1 세포사에 결정적인 역할을 하지 않는다고 생각된다. HG/PA에 의해서 TCA 회로 중간산물의 감소, palmitate와 pyruvate의 산화 감소, ATP 수준의 감 소가 일어나는 것을 확인하여 에너지 부족에 의한 세포사로 생각되며 TCA 회로 에서 anaplerosis의 유입을 증가시켜주는 Leu, BCH, KIC+MMS를 처리했을 때와 cataplerosis 유출을 저해하는 약제인 BTA를 처리 했을 때 세포사 저해효과가 나타났고, ATP의 감소를 회복시켰다. 당뇨병 동물 모델인 OLETF rat의 islets에 서도 HG/PA에 의한 INS-1 세포사에 저해효과가 있었던 약제들에 의해 세포사 저해효과가 나타났고, ATP 또한 감소시키지 않았다. 결론적으로 지방합성은 HG/PA에 의한 INS-1 세포사멸에 결정적인 역할을 하지 않고, 지방산의 베타산화 감소와 미토콘드리아의 대사이상에 의한 에너지 부족이 초래되어 apoptosis를 통한 세포사를 유발 시키는 것으로 추측된다. 핵심어: High glucose(HG), Palmitate(PA), anaplerosis, energy depletion
차 례
국문요약 ··· ⅰ 차례 ··· ⅲ 그림 차례 ··· ⅵ 표 차례 ··· ⅷ Ⅰ. 서론 ··· 1 A. 당뇨병 (Diabetes Mellitus)의 정의 ··· 1 B. 제2형 당뇨병에서 베타세포의 기능이상 ··· 2 1. 베타세포에서 포도당 대사 ··· 4 2. 베타세포에서 지방산 대사 ··· 6 3. 포도당독성 (Glucotoxicity) ··· 9 4. 지방산독성 (Lipitoxicity) ··· 10 5. 포도당/지방산독성 (Glucolipotoxicity) ··· 10 C. 연구목적 ··· 14 Ⅱ. 재료 및 방법 ···15 A. 재료 ··· 15 1. 재료 ··· 15 B. 방법 ··· 18 1. 췌장 소도 세포 및 세포주 배양 ··· 18 2. 췌장 소도 세포 분리 ··· 18 3. MTT assay ··· 184. Cell death detection assay ··· 19
5. TG staining ··· 19
7. RT-PCR ··· 20 8. Western blotting ··· 22 9. Palmitate oxidation ··· 22 10. Pyruvate oxidation ··· 23 11. Metabolite extraction ··· 23 Ⅲ. 결과 ··· 24 A. 고농도 포도당과 palmitate에 의해 INS-1 세포에서 포도당/지방산독성 (Glucolipotoxicity)이 나타남 ··· 24 B. 여러 가지 저해제를 이용한 INS-1 세포사의 작용기전 확인 ··· 27 1. HG/PA에 의한 INS-1 세포사에서 산화적 스트레스와 스트레스 신호의 영향 ··· 27
2. HG/PA에 의한 INS-1 세포의 세포사에서 ER stress와 Calcium의 영향 ··· 27 3. HG/PA에 의한 INS-1 세포사에서 지방산 대사의 영향 ··· 28 C. HG/PA에 의한 INS-1 세포사와 지방합성과의 연관관계 ··· 34 1. HG/PA에 의한 INS-1 세포사에서 T0901317에 의한 지방합성 유전자 발현의 증가 ··· 34 2. INS-1 세포에서 HG/PA에 의한 포도당 대사와 지방합성 관련 유전자 발현의 변화 ··· 35 D. 미토콘드리아 대사 이상에 의한 에너지 부족에 의한 세포사 ··· 40 1. TCA 회로의 anaplerosis/cataplerosis 조절에 의한 세포사 억제효과 ··· 40
2. TCA cycle components의 변화 ··· 43
3. HG/PA에 의한 INS-1 세포사에서 pyruvate 산화와 palmitate 산화의 감소 ··· 45
5. HG/PA를 처리한 INS-1 세포에서 여러 가지 약제들에 의한 ATP
수준의 변화 ··· 50
E. OLETF islets에서 HG/PA에 의한 세포사 ··· 52
Ⅳ. 고찰 ··· 54 A. HG/PA에 의한 INS-1 세포사 증가 ··· 54 B. HG/PA에 의한 INS-1 세포사에서 산화적 스트레스, 스트레스 신호, ER stress, Calcium, 지방산 대사의 영향 ··· 54 C. HG/PA에 의한 INS-1 세포사에서 지방합성과의 연관관계 ··· 56 D. HG/PA 에 의한 INS-1 세포사에서 미토콘드리아의 대사이상 ··· 57 Ⅴ. 결론 ··· 59 참고문헌 ··· 60
그림 차례
Fig. 1. Impaired Beta Cells in T2DM ··· 3
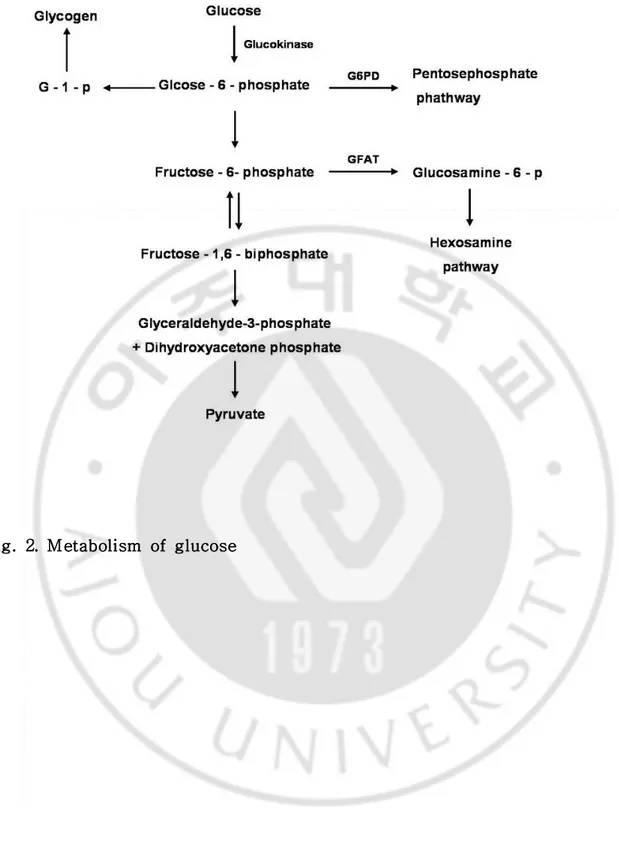
Fig. 2. Metabolism of glucose ···5
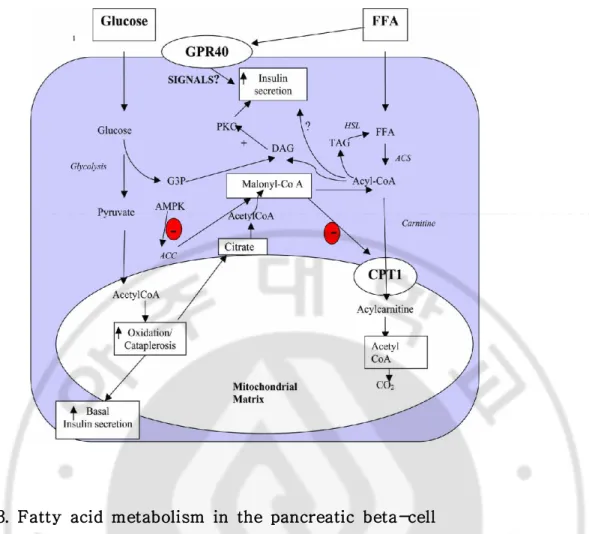
Fig. 3. Fatty acid metabolism in the pancreatic beta-cell ··· 8
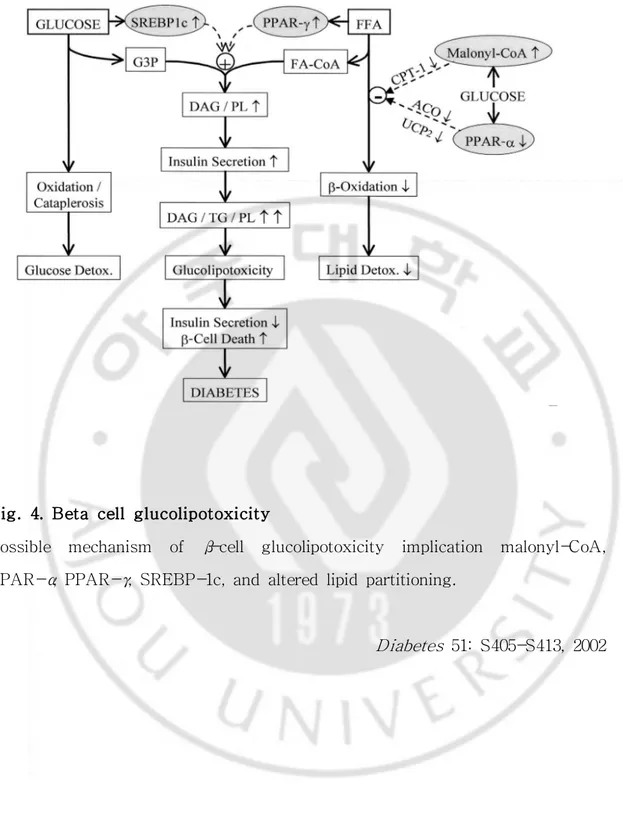
Fig. 4. Beta cell glucolipotoxicity ··· 13
Fig. 5. HG/PA-induced INS-1 beta cell death ··· 26
Fig. 6. Role of oxidative stress and stress signals in viability of the HG/PA treated INS-1 cells ··· 30
Fig. 7. Effect of ER stress and calcium signals on HG/PA treated INS-1 cells ··· 31
Fig. 8. Pathway of lipid metabolism ··· 32
Fig. 9. Effect of Lipid Metabolism in viability of HG/PA treated INS-1 cells ··· 33
Fig. 10. T0901317 increase TG accumulation in HG/PA treated INS-1 cells ··· 37
Fig. 11. T0901317 regulate lipid synthesis related gene expression ··· 38
Fig. 12. Effects of HG/PA on glucose metabolism and lipid metabolism related gene expression in INS-1 cells ··· 39
Fig. 13. Pathway of anaplerosis/cataplerosis in the beta cell ··· 41
Fig. 14. Effects of anaplerosis/cataplerosis in viability of HG/PA treated INS-1 cells ··· 43
Fig. 15. HG/PA induced the reduction of TCA cycle intermediates in INS-1 cell ··· 44 Fig. 16. Pyruvate oxidation is decreased in HG/PA treated INS-1 cells · 46 Fig. 17. Palmitate oxidation is decreased in HG/PA treated INS-1 cells 47
Fig. 18. ATP levels in HG/PA treated INS-1 cells ··· 49
Fig. 19. Effects of beta oxidation, TG accumulation, TCA cycle related molecules on ATP levels in HG/PA treated INS-1 cells ··· 52
Fig. 20. Effects of HG/PA on viability and ATP levels in pancreatic islets in OLETF rat model ··· 54
표 차례
Table 1. A list of the used inhibitors ··· 17 Table 2. Primers used for PCR analysis ··· 21
I. 서 론
A. 당뇨병 (Diabetes Mellitus)의 정의
당뇨병 (Diabetes Mellitus)은 췌장 (pancreas)에서 분비되는 인슐린 (insulin)이 부족하거나 인슐린이 우리 몸에서 제대로 작용하지 못하여 혈당이 에 너지로 이용되지 않고 혈액 속에 쌓여서 고혈당 증상을 나타내는 만성대사질환 이다. 정상인의 경우 체내에 포도당 (glucose)이 흡수되면 혈중 당 농도가 증가 하고 췌장 베타 (β)세포가 높아진 포도당 농도를 인식하여 인슐린을 분비하고 분 비된 인슐린은 간, 근육, 지방세포 등과 같은 표적세포에서 포도당의 흡수를 촉 진하여 혈당을 낮추게 된다. 반면 포도당 농도가 낮은 상황에서는 췌장 알파 (α) 세포가 글루카곤 (glucagon)을 분비하여 간에서 저장된 글리코겐 (glycogen)을 포도당으로 분해 시키고 포도당 신 합성 (gluconeogenesis)을 촉진시켜 혈액에 포도당을 공급하여 혈당을 조절하게 된다. 이러한 인슐린의 분비 및 작용이 저하 되거나 글루카곤의 분비가 증가해서 혈중 포도당 농도가 기저 농도에 비해 높은 상태로 지속적으로 유지되면 신장기능의 저하, 혈관 내에 당이 축적되어 발생하 는 동맥경화, 망막의 출혈로 인한 시력저하 등 여러 합병증이 함께 나타나기도 한다. 제2형 (Type 2) 당뇨병은 전체 당뇨병의 95% 이상을 차지하고 있고 주로 중년기 이후에서 나타나게 된다. 인슐린이 어느 정도 분비됨에도 불구하고 인슐 린의 작용이 적절하게 이루어지지 못해 발병하게 되며 발병 초기에는 인슐린 분 비 능력이 남아있으므로 인슐린 비의존형 당뇨병 (Non Insulin Dependent Diabetes Mellitus : NIDDM)으로 불리어지고 있다. 이러한 제2형 당뇨병은 인슐 린의 작용이상 즉, 간, 근육 및 지방조직 같은 말초 조직에서의 인슐린 저항성 (insulin resistance) 뿐만 아니라 인슐린을 분비하는 췌장 베타세포의 기능이상
(dysfunction) 및 양적 (mass) 감소로 인한 인슐린 부족 (insulin deficiency)이 동반되어 발병하는 것으로 인식하고 있다.
B. 제2형 당뇨병에서 베타세포의 기능이상
제2형 당뇨병 환자의 췌장 베타세포는 발병 전 혹은 초기에 인슐린 저항 성을 극복하고자 기저 인슐린의 분비 (basal insulin release)는 증가하지만 당뇨 병이 진행될수록 포도당자극인슐린분비 (GSIS: glucose-stimulate insulin secretion) 능력의 감소와 같은 인슐린 분비의 감소와 더불어 인슐린 mRNA, 인 슐린 단백질 양이 현저히 줄어드는 특징을 나타낸다. 여기서 인슐린을 생산하고 분비하는 베타세포의 손실은 제1형 당뇨병의 주된 병인으로 알려져 왔으나 최근 에는 베타세포의 손실이 제2형 당뇨병의 발병에도 결정적인 역할을 한다고 믿고 있다. 췌장 소도에서 베타세포의 양적 조절은 베타세포의 복제 (replication), 신 생 (neogenesis), 세포사 (apoptosis)의 균형에 의해 조절된다 (Rhodes 등, 2005). 제2형 당뇨병 환자는 베타세포의 복제 및 신생이 불충분하고 세포사가 상대적으 로 많이 일어나 베타세포가 양적으로 감소하여 발병한다(Rhodes 등, 2005). 당뇨 병으로 진행되기 전 과영양 및 비만 상태가 계속되면 베타세포 주위의 환경적 조건이 베타세포의 세포사를 유도하기 적당한 상태로 되며 이런 상태가 지속되 면 베타세포의 양적감소가 일어난다. 베타세포의 양적조절은 개인의 유전적 감수 성과 환경적 요인에 의해 조절되어 진다. 베타세포의 사멸을 증가시키는 환경적 요인으로 지방산의 세포독성, 특히 당 농도가 높은 상황에서 포도당/지방산독성 (glucolipotoxicity)이 중요한 역할을 한다고 생각된다 (Kanto 등, 2005; Prentri 등, 2002). 지방산은 그 자체로 베타세포에 독성을 보이는데 베타세포가 지속적으 로 지방산에 노출되면 세포내 대사과정이 지방산 산화에서 지방합성 과정으로 변환되며 이때 만들어지는 중간산물이 세포사 관련 신호를 활성화 시킬 수 있다 고 알려져 있다 (El-Assaad 등, 2003; Rocuit 등, 2000; Chen 등, 2005).
1. 베타세포에서 포도당 대사
포도당은 인슐린비의존성 포도당 수송체 (non-insulin-dependent glucose transpoter)인 GLUT2 (Glucose Transporter 2)에 의해 베타세포내로 수송된다. 이때 GK (glucokinase)에 의해 포도당이 glucose-6-phosphate로 인산화 되어진 다. 여기서 glucose-6-phosphate는 pentose phosphate 경로, glycogen 합성 경로 를 통해 대사 될 수 있다. glucose-6-phosphate가 인산화 되어 fructose-6-phosphate로 전환 되어지는데 이때 glutamine:fructose-6-phosphate amidotransferase (GFAT)에 의해 fructose-6-phosphate는 hexosamine 경로로 대사 될 수 있다. fructose-6-phosphate는 일련의 과정을 거쳐 glycolysis 마지막 산물인 pyruvate로 대사된다.
베타세포는 여러 면에서 다른 동물세포와는 차별성을 나타낸다. 첫 번째로 는 생리학적으로 적절한 범위의 (2~20 mmol/l)의 포도당 농도를 사용한다. 두 번 째로는 lactate dehydrogenase와 원형질막 monocarboxylate pyruvete/lactate 수 송체의 활성이 낮다. 반면 미토콘드리아의 malate/aspartate shuttle의 활성이 높 게 나타나 NADH의 미토콘드리아 산화를 원활하게 한다. 세 번째로 베타세포에 서는 PDH (pyruvate dehydrogenase)와 PC (pyruvate carboxylase)의 활성이 높 게 나타나 포도당과 pyruvate의 anaplerosis와 산화적 대사를 원활하게 한다. Pyruvate에서 형성된 acetyl CoA는 oxaloacetate와 만나 미토콘드리아의 TCA 회로에서 대사되어 citrate를 만들어 낸다. 이런 미토콘드리아의 대사를 통 해 NADH와 FADH2를 생산하게 된다 (Brennan 등, 2002). 이 모든 대사에 의해
미토콘드리아의 TCA회로, 산화적 인산화, ATP 생산을 증가시키게 된다. 이때 ATP/ADP의 비율이 증가되면 ATP-sensitive K+ channel이 닫히고, 원형질막의 탈분극화가 일어나 voltage-activated Ca2+ channel이 열리게 되어 세포내로 Ca2+ 이 유입된다(Matschinsky 등, 1996). 결국 Ca2+은 원형질막에서 인슐린을 가지고 있는 과립과 융합되어 진다 (Prentki 등, 1996; Roduit 등, 2004). 이로 인해 포도 당에 의한 인슐린 분비가 일어나게 된다.
2. 베타세포에서 지방산 대사
혈액 속에 순환하고 있는 lipoprotein이 lipoprotein lipase에 의해 glylcerol 과 fatty acid로 방출되면 fatty acid는 혈액에 존재하는 단백질인 serum albumin 과 결합한다. 수용성인 serum albumin 단백질은 지용성인 fatty acid를 베타세포 내로 이동시켜준다. Fatty acid는 albumin과 분리되어 확산에 의해 세포질로 수 송되어지거나 세포 표면의 receptor와 상호작용에 의하여 효과를 나타낼 수도 있 는데 GPCR (G-protein coupled receptor)인 GPR40가 long chain fatty acid의 receptor로 알려져 있다 (Itoh 등, 2003; Briscoe 등, 2003; Katsuma 등, 2005). 포도당 농도가 낮거나 cAMP에 의해 PKA가 활성화 되면 HSL (hormone sensitive lipase)을 활성화 시킨다. HSL은 NEFA (non-esterified fatty acid)의 생산 또는 다른 지방 신호 분자 (lipid signaling molecule)를 통한 인슐린 분비, 조절에서 지방분해에 관여하는 효소이다. HSL은 TG store를 분해 시켜 fatty acid를 방출하게 된다. 이 과정은 GSIS에 중요한 역할을 하게 된다. 실제적으로 HSL-knockout mice의 소도에서 GSIS가 감소되어 있다고 보고 되어 있다 (Roduit 등, 2001). 또한 포도당 농도가 증가하면 베타세포에서 HSL 유전자 발현 을 유도하게 된다 (Winzell 등, 2001).
포도당의 수준이 낮을 때 fatty acid는 ACS (acyl-CoA synthetase)에 의해 long chain acyl CoA로 전환되고 long chain acyl CoA는 CPT-1에 의하여 미토 콘드리아 내로 들어가서 베타산화가 일어나 에너지를 생산하게 된다. 미토콘드리 아에서의 지방산의 베타산화는 3단계로 일어나게 된다. 제 1단계, acetyl-CoA 형 태로 지방산이 분해 된다. 2단계에서는, acetyl-CoA의 아세틸 잔기가 시트르산 회로를 거쳐서 CO2로 산화된다. 이때 전자 운반체인 NADH와 FADH2가 생성되 는데, 이것들은 제 3단계에서 미토콘드리아의 호흡 사슬에 전자를 전해주고, 이 전자는 호흡 사슬을 거쳐서 산소로 전해진다. 이러한 과정을 거쳐 지방산 산화에 의해서 방출된 에너지는 ATP의 형태로 보존된다. 반면 포도당 수준이 높을 때는 malonyl CoA가 증가되어 CPT-1의 활성을
저해하고 세포질 내에 long chain acyl CoA가 축적된다. 이때 베타세포에서는 malonyl CoA가 지방산 대사를 포도당 대사로 전환시켜주게 된다. 포도당 대사에 의해 생산된 glycerol 3-phosphate는 세포질에 축적된 long-chain acyl CoA와 만나 베타세포에서 TG로 에스테르화 되어진다.
AMPK는 포도당 산화가 낮을 때 fatty acid를 산화시키는 대사로 전환 시 킨다. 반면 fatty acid, cholesterol 합성은 포도당 산화가 높을 때 진행된다. 기저 포도당 농도가 높아진 후에 포도당 수송과 포도당 산화는 증진되고 AMPK의 활 성은 감소하게 된다. 이때 ACC, HMG CoA reductase의 탈 인산화로 인해 활성 화되고, mTOR 또한 활성화 된다. 이로 인해 fatty acid, cholesterol, 단백질 합성 이 증가되고 동시에 fatty acid 산화는 감소하게 된다. 새로 합성된 fatty acid는 DAG와 같은 지방 신호분자를 만들어 낼 수 있는데 이로 인해 PKC가 활성 되 고 인슐린 분비가 증진되게 된다. 지속적으로 베타세포가 높은 농도의 포화지방 산에 노출되게 되면 포도당 산화가 저하되고 ATP/AMP 비율이 감소하여 AMPK가 활성화 된다. 이때 ACC의 인산화로 인해 ACC의 활성이 저해되고 지 방산 합성은 감소하게 되고 지방산 산화가 증진된다. AMPK는 lipogenic, glycolytic 효소를 조절하는 중요 전사인자인 SREBP1c. HNF-4α 등의 발현 변화 에 의해 지속적으로 베타세포의 기능을 조절하게 된다. 베타세포에서 SREBP1c 유전자를 과 발현 시켰을 때 TG 축적이 증가하고, 인슐린 분비가 저하된다고 알 려져 있다(Rutter등, 2003).
Fig. 3. Fatty acid metabolism in the pancreatic beta-cell
Fatty acids are ' activated' on the β-cell to become acyl-CoA. This acyl CoA may be oxidized in the mitochondrial matrix, or may be esterified in the cytosol to become TG. Glucose metabolism may also to give rise to cytosolic citrate via cataplerosis, which subsequently can be converted into acetyl-CoA and oxaloacetate by ATP-citrate lyase, and the conversion of acetyl-CoA into malonyl CoA via the action of ACC. NEFAs may also bind to GPR40 receptors and stimulate unknown signal transduction pathway(s).
3. 포도당독성 (Glucotoxicity) 포도당은 베타세포의 인슐린 유전자 발현과 분비에 있어서 주요 조절자이 다. 그러나 포도당이 베타세포에 지속적으로 노출되게 되면 인슐린 유전자 발현 감소에 의해 인슐린 합성 및 분비가 감소하게 되어 베타세포의 기능이상을 가져 오고 비가역적 독성을 나타내게 된다. 이러한 현상을 포도당독성 (glucotoxicity) 이라 한다 (Robertson 등, 2003). 만성적인 고혈당이 베타세포의 기능이상을 일으키는 데에 관계하는 생화학 적 기전으로는 최근 포도당 대사과정 중 활성산소 (Reactive Oxygen Species, ROS)의 과도한 발생으로 인해 일어나는 만성적 산화 스트레스 (oxidative stress)의 증가가 관련될 것이라는 증거들이 제시되고 있다 (Robertson 등, 2003; Robertson, 2004). 정상 농도의 활성산소는 세포의 항상성을 유지하는데 도움을 주지만, 만성적인 고혈당 상태에 베타세포가 노출되면 포도당의 산화적 인산화 (oxidative phosphorylation) 과정중의 미토콘드리아에서의 전자전달 과정, 글리세 르알데히드 자동산화 (glyceraldehyde autooxidation), hexosamine 형성경로, advanced glycation end product (AGE) 형성, protein kinase C의 활성화 등 여 러 경로를 통해 과량의 활성산소가 축적되고 이러한 활성산소는 잘 밝혀져 있지 않은 신호전달체계를 통해서, 당에 의해 조절되는 여러 베타세포 특이적 유전자 의 발현을 변화시키고 특히 PDX-1, MafA와 같은 인슐린 유전자 발현에 있어서 중요한 전사인자의 발현 및 활성을 변화시켜 인슐린 유전자 발현을 감소시킨다 고 알려져 있다 (Koji 등, 2003; Kaneto 등, 2001; Kaneto, 2002). 또한 베타세포 에서는 catalase, glutathion peroxidase와 같은 항산화효소의 발현이 비교적 낮기 때문에 산화적 스트레스에 민감하다고 알려져 있다 (Lenaen, 1996; Tiedge, 1997). 실제로 당뇨병 모델 쥐인 ZDF rat 또는 db/db mouse에서 고농도 포도당 에 만성적으로 노출될 때 베타세포에 N-acetyl-cystein (NAC)과 같은 항산화제 를 처리하거나 항산화효소를 과 발현시킬 때 당독성에 의해 발생한 베타세포의 기능이상이 일부 회복된다는 보고가 있다 (Kaneto 등, 1999; Tanaka 등, 1999;
Benhamou 등,1998).
현재까지 산화적 스트레스에 의한 인슐린 유전자 발현의 저해현상에 관련 된 신호전달체계 (signaling pathway)에서 대표적으로 알려진 것이 JNK (c-jun N-terminal kinase)인데, 실제로 산화적 스트레스에 의해 활성화된 JNK가, forkhead 전사인자인 Foxo1/FKHR을 매개로 핵 내에 존재하는 PDX-1을 세포질 로 이동시켜 인슐린 유전자 발현을 감소시키는 것으로 알려져 있다 (Kaneto 등, 2002; Kawamori 등,2006). 4. 지방산독성 (Lipitoxicity) 포도당과 마찬가지로 정상 상태에서 지방산은 베타세포의 필수적인 연료로 써 중요하다. 그러나 베타세포가 과량의 지방산에 지속적으로 노출되면 기저 인 슐린 분비는 증가하지만 포도당자극 인슐린 분비가 저해 받고, 인슐린 유전자 발 현의 저해와 베타세포의 세포사가 유발되는데 이러한 현상을 지방산독성 (lipotoxicity)이라 한다. 실제로 제 2형 당뇨병에서 지방 대사의 이상으로 혈중 유리 지방산의 과다하게 증가하여 인슐린 저항성과 베타세포의 기능이상을 유발 시키는 것으로 알려져 있다 (Unger, 1995). ZDF rat에서 과량 축적되는 TG의 경 우, 소도세포에서의 TG 합성효소인 diacylglycerol-acyltransferase-1의 과발현을 통한 TG 과량 축적 실험에서 인슐린 분비는 감소하나 인슐린 유전자 발현에는 영향을 주지 않았다 (Kelpe 등, 2002). 반면에 palmitate에 의한 de novo 합성을 통해 증가된 ceramide는 인슐린 분비에는 영향을 미치지 않고 JNK의 활성화에 의한 c-jun 의존적 혹은 비의존적 경로를 통하거나, PKB 저해에 의한 Foxo1 전 사인자의 핵내 이동을 유도하여 인슐린 프로모터 활성을 억제함으로써 인슐린 유전자 발현을 저해하는 것으로 추정하고 있다 (Kelpe 등, 2003) 5. 포도당/지방산독성 (Glucolipotoxicity) 과도한 포도당과 지방산에 의해 베타세포 기능에 비가역적 독성을 나타내
는 현상을 포도당/지방산독성 (glucolipotoxicity)이라 한다. 포도당/지방산독성은 지방산독성에 포도당 독성이 더해져 증대된 것으로 설명되고 있다. 포도당이 (2~10 mM)로 존재하거나 포도당 수준이 낮을 때 지방산이 높게 존재 하게 되면 베타세포에 독성을 나타내지 않지만 지속적으로 포도당과 지방산이 함께 베타세 포에 노출되면 지방합성 경로가 활성화 된다. 초기에는 베타세포가 이 상황을 극 복하기 위하여 인슐린 분비가 증가 하지만 계속적으로 세포질에 FA CoA가 쌓 이게 되고 중성지방 합성이 계속적으로 증가하게 되면 인슐린 분비도 저하된다. 결국에는 지방대사 주요 전사인자들의 활성과 지방대사 중간산물의 생성에 의해 베타세포는 과도한 연료 독성에서 벗어 날 수 없게 되어 베타세포에 독성을 가 져오게 되고 명백한 제 2형 당뇨병으로 발전하게 된다고 믿고 있다 (Prentki 등, 2002). 만성적인 고혈당과 증가된 지방산에 의해 베타세포의 지방대사가 활성화 된다. 이때 생성되는 중간산물들이 만들어 내는 신호에 의해 베타세포에 기능이 상을 일으키게 된다. 여기에 관계하는 세포내 매개인자로써 cholesterol 합성을 들 수 있다. 실제로 ATP-binding cassette transporter subfamily A member 1 (ABCA1) 유전자를 제거시킨 베타세포에서 cholesterol의 유출을 하지 못하여 세 포내에 cholesterol이 증가되고 인슐린 분비가 저하된다고 알려져 있다 (Brunham 등, 2007). 두 번째로 ceramide의 생성은 palmitate가 인슐린 유전자 저해 하도록 조절된다고 추측된다. Ceramide에 의해 조절되는 두 가지 주요 신 호 전달체계는 MAPK와 PI3K 경로를 들 수 있다. 인슐린 유전자의 전사는 전사 인자 활성의 영향에 의해 조절되어지는데 JNK는 대부분의 세포에서 ceramide에 의한 신호전달 경로로써 인슐린 유전자 전사를 억제 한다 (Mathias 등, 1998). 인슐린에 민감한 세포에서는 palmitate에서 ceramide를 형성하는 것은 PKB (AKT)활성을 억제시킨다고 알려져 있다. 이것은 아마도 PKCζ 활성에 의해 나 타나는 것으로 보인다 (Bourbon 등, 2000). 세 번째로 TG의 세포질 내 축적이 베타세포에 독성을 가져올 수 있다고 추측되어 진다. 실제로 ZDF rat에서 지속
적으로 glucose와 palmitate에 노출되었을 때 TG의 양이 증가 되어 베타세포의 기능이상을 가져오게 되며, islets에서 TG의 합성은 insulin 분비를 저하 시켰다 (Kelpe 등, 2002). 또한 아직 정확히 밝혀져 있지 않지만 TG로 에스테르화되기 전의 중간산물들인 lysophosphatidic acid, phosphatidic acid, diacylglycerols 등 이 베타세포 기능을 저하 시킨다고 믿고 있다 (Prentk 등, 2006).
Fig. 4. Beta cell glucolipotoxicity
Possible mechanism of β-cell glucolipotoxicity implication malonyl-CoA, PPAR-α, PPAR-γ, SREBP-1c, and altered lipid partitioning.
C. 연구 목적 베타세포의 양적 감소는 제2형 당뇨병 환자에게 나타나는 중요한 병인이다. 베타세포의 세포사 원인 중 하나가 포도당/지방산독성 (glucolipotoxicity)인데 이 기전은 명확히 밝혀져 있지 않다. 본 연구에서는 고농도포도당과 palmitate에 의 해 INS-1 세포에서 포도당/지방산독성이 나타나는 것을 확인하였고 그 기작이 기존에 보고되어있는 산화적 스트레스와 관련이 있는지, 다른 스트레스신호와 관 련이 있는지, Ca2+신호 또는 ER stress와 관련이 있는지, 지방합성경로의 중간대 사물질 생성과 관련이 있는지, 또는 다른 기작에 의해 세포사를 유도하는지 규명 하고자 하였다.
Ⅱ. 재료 및 방법
A. 재료 1. 재료
세포배양에 사용하는 Fetal Bovine Serum은 Sigma (Sigma-Aldrich Co, St. Lois, USA)에서 구입하였고, 항생제 (penicillin G, streptomycin)는 GibcoBRL (Invitrogen Co, Califonia, USA)에서 구입하였다. 세포 배양에 사용하 는 RPMI 1640과 포도당이 없는 RPMI 1640은 Sigma (Sigma-Aldrich Co, St. Lois, USA)에서 구입하였다. 췌장 소도세포 분리에 이용한 collagenase P는 Roche (Rochediagnostics GmbH, Mannheim, Germeny)에서 구입하였고, ficoll은 Sigma에서 구입하였다. NMMA, NAC, EGTA/AM, SB203580, SP600125, SN50 등의 저해제들은 Calbiochem (EMD Bioscience, Inc, Darmstadt, Germany)에서 구입하였다. etomoxir, bromopalmitate, orlistat, AICAR, lovastatin, fumonisin B1, myriocin, chelerythrine, T0901317, L-leucine, glutamine, pyruvate, methyl pyruvate, BCH, KIC, mono methyl succinate, BTA, PAA는 sigma에서 구입하 였고, cerulenin과 TOFA는 Cayman (Cayman Chemical, Michigan, USA)에서 구입하였고, hydroxycitrate로 사용한 CITRIMAX는 Bestlifevitamin (bestlifevitamin, USA)에서 구입하였다. RT PCR에 사용된 TRI Zol은 MRCGENE에서 구입하였고 RT-PCR kit는 Takara (Takara, Otus, Japan)에서 구입하였다. Western blot에 사용된 AKT, AMPK, mTOR, Caspase 3, PARP에 대한 항체는 Cell Signaling (Cell Signaling Technology Inc, Denver,USA)에서, actin에 대한 항체는 Sigma에서 HIF-1β에 대한 항체는 BD Bioscience Parmingen에서 구입하였다. ATP assay를 위한 CellTiter-Glo Luminescent cell viability assay kit는 Promega (Promega Co, Madison, WI 53711, USA)에서 구
입하였다. Pyruvate oxidation과 palmitate oxidation을 위한 [1-14C]Pyruvic acid, sodium salt와 [1-14C]Palmitic acid는 GE Healthcare에서 구입하였고, Perchloric acid는 Sigma에서 구입하였다.
Table 1. A list of used inhibitors Name Function NMMA NO inhibitor NAC Anti-oxidant GSH Endogenous anti-oxidant SN50 NF κB inhibitor SP00125 JNK inhibitor SB203580 p38 MAPK inhibitor
Dantrolin Ryanodine receptor Ca2+ channel blocker
EGTA Extracellular Ca2+ chelator
EGTA/AM Intracellular Ca2+ chelator
Nifedifine L-type Ca2+ channel blocker
Nimodipine L-type Ca2+ channel blocker
Bay K8644 L-type Ca2+ channel opener
Etomoxir CPT-1 inhibitor
Bromopalmitate Nonmetabolized palmitate analogue, CPT-1
inhibitor
Orlistat HSL inhibitor
Bezafibfate PPAR α agonist
AICAR AMPK activator
GW9662, Irreversible PPAR-γ antagonist
Troglitazone PPAR-γ agonist
HCA Citrate lyase inhibitior
Lovastatin HMG-CoA synthesis inhibitior
TOFA ACC competitive inhibitor
Cerulenin FAS inhibitor
C75 FAS inhibitor, CPT-1 stimulate
Fumonisin B1 Ceramide inhibitor
Myriocin Ceramide inhibitor
Chelerythrine PKC inhibitor
T0901317 LXR ligand agonist, general activator of
lipogenesis Pyruvate
Methyl pyruvate
Leucine Glutamate dehydrogenase activator
aminobicyclo-heptane-2-carboxylic acid(BCH) Non-metabolized leucine analog, Glutamate dehydrogenase activator Glutamine
a-ketoisocarproic acid (KIC) supply acetyl CoA
Mono methyl succinate supply succinate
BTA Tricarboxylate(citrate, isocitrate)
Carrier inhibitor
BM Dicarboxylate(malate) carrier inhibitor
B. 방 법
1. 췌장 소도 세포 및 세포주 배양
OLETF 췌장 소도 세포와 INS-1 세포주는 11 mM 포도당이 함유된 RPMI 1640 배지에 10% fetal bovine serum과 100 IU/㎖ penicillin과 100 ㎍/㎖ stretopmycin의 항생제를 첨가하여 5% CO2와 37℃의 온도를 유지하면서 배양기
에서 배양하였다.
2. 췌장 소도 세포 분리
췌장 소도 세포는 collagenase digestion 방법으로 분리하였다. 30~33주된 웅성 OLETF rat의 common bile duct에 0.75 ㎎/㎖의 collagenase를 10 ㎖ 주사 기로 주입하여 췌장을 분리해냈다. 37℃ water bath에서 7분에서 10분간 췌장 소 도 세포를 digestion 시키고, 차가운 HBSS를 30 ㎖ 넣어 효소 반응을 중지시키 고, 세차게 흔들어 준 후 500 x g에서 2회 세척한 후, 상등 액은 버리고 HBSS 10 ㎖을 더하여 pippeting 10회 정도 해준 후, 600 ㎛ mesh에 걸러서 digestion 되지 않은 exocrine 세포들은 제거 하였다. 걸러진 용액은 500 x g 로 원심 분 리하여 씻어내는 과정을 2회 반복하였다. 남은 침전물은 25% ficoll 용액에 섞은 후, 그 위에 23%, 21.5%, 20.5%, 11% ficoll 층을 만들고 3000 rpm에서 10분간 원심 분리 하였다. 11%와 20.5% 사이 층에 걸린 췌장 소도 세포를 걷어내어 RPMI 1640으로 세척한 후, 10% fetal bovine serum과 1% 항생제가 포함된 RPMI 1640 배지를 넣어주어 배양기에서 24시간 배양하였다.
3. MTT assay
96 well plate에 INS-1 세포를 5 x 104 개씩 분주하여 24시간 배양한 후 배 양액에 포도당과 여러 약제를 처리하고 30분 후에 palmitate를 처리하여 배양한 후, 18시간에서 24시간이 지난 후 배양액을 버리고 0.5 ㎎/㎖ MTT를 1시간 동 안 처리한다. 그 후에 MTT 용액은 버리고 isopropanol (0.1N HCl/isopropanol)
을 넣어주고 30분 반응 시킨 후에 spectrophotometer를 이용하여 측정 하였다 (630 nm, Bio-Rad, Hercules, CA).
4. Cell death detection assay
96 well plate에 INS-1 세포를 5 x 104 개씩 분주하여 24시간 배양한 후에 여러 농도의 포도당과 palmitate를 24시간 동안 처리하고 lysis buffer (0.1% tritonX-100, 0.1% sodium citrate)로 세포를 용해한 후에 원심분리 (700 x g, 5min)하여 핵을 가라앉히고 상층에 있는 nucleosome DNA를 sandwich ELISA 에 넣는다. 여기에는 anti-histone monoclonal antibodies가 코팅되어 있다. 여기 에 peroxidase-conjugated anti-DNA monoclonal antibodies를 넣으면 nucleosome DNA complex에 peroxidase가 남아있게 되고 이것을 측정하였다. (405 nm, 2,29-azino-di [3-ethylbenzthiazolinsulfonate] (ABTS) as the substrate).
5. TG staining
Microscope cover glass에 INS-1 세포를 3 x 105 개로 분주하여 유리에 세 포를 부착시켜 24시간 배양한다. 배양 후에 배양액에 포도당 25 mM, T0901317 1 μM 첨가해준 후, palmitate 400 μM을 넣고 1일, 3일 배양한다. 배양 후에 배양 액을 버리고 1X PBS로 2회 세척한 후, 10% formalin을 넣고 1시간동안 세포를 고정시킨다. 1X PBS로 두 번 세척한 후에 55% isopropanol에 녹여져 있는 0.3% Oil Red O 용액에 2시간 동안 염색시킨다. 1X PBS로 2회 세척한 후에 glass를 말린 후 슬라이드글라스에 고정시킨다.
6. ATP assay
96 well plate에 INS-1 세포를 5 x 104 개씩 분주하여 RPMI 1640 배양액 에 24시간 배양한 후에, 포도당과 palmitate 그리고 여러 약제를 18시간 처리한
후 새로운 RPMI 1640 배양액으로 교환하고 실온에서 30분 동안 안정화시킨다. pipett으로 세포를 떼어내어 1.5 ㎖ tube로 옮기고 동량의 CellTiter-Glo 시약을 넣는다. standard 는 100 μM ATP를 RPMI 1640 배양액에 희석하여 최종 농도 가 1 μM, 100 nM 10 nM이 되도록 만들어 sample과 같은 방법으로 배양액과 동량의 CellTiter-Glo 시약을 넣는다. 2분 동안 vortex 하여 세포를 lysis 시킨다. 상온에서 10분 동안 세포를 안정화 시킨 후에 luminometer로 값을 측정하였다. 7. RT-PCR
INS-1 세포를 12 well plate에 3 x 105개씩 분주하여 37℃, 5% CO2 배양기
에서 24시간 배양한 후, 배양액에 포도당을 25 mM이 되게 첨가해주고, palmitate 400 μM을 처리한 후 시간별로 세포를 수거하였다. 세포를 1X PBS로 세척한 후, RNA TRI Zol을 이용하여 RNA를 추출하여 정량하였다. 1 ㎍의 RNA를 1000U AMV 역전사 효소 0.5 ㎕, 2.5 mM dNTP 4 ㎕, Random 9mer 1 ㎕, RNase inhibitor 0.5 ㎕, MgCl2 4 ㎕, 10X RT buffer 2 ㎕와 혼합하여 30℃
10분, 42℃ 30분, 99℃ 5분 동안 역전사 반응을 시켜 cDNA를 합성하였다. 이렇 게 얻어진 cDNA로 아래의 primer들을 사용하여 PCR을 수행하였다. 1.5% agarose gel에서 PCR 반응물을 전기영동 하여 ethidium bromide로 염색하여 관 찰하였다.
Table 2. Primers used for PCR analysis. Name Sequence
Cyclophilin (Forward) 5'-CCA AAG ACA GCA GAA AAC TT-3'
Cyclophilin (Reverse) 5'-GAA ATT AGA GTT GTC CAC AG-3'
Glut2 (Forward) 5'-TGG GTT CCT TCC AGT TCG-3'
Glut2 (Reverse) 5'-AGG CGT CTG GTG TCG TAT-3'
Glucokinase (Forward) 5'-TGA CAG AGC CAG GAT GGA-3'
Glucokinase (Reverse) 5'-TCT TCA CGC TCC ACT GCC-3'
Insulin (Forward) 5'-CCA GGC TTT TGT CAA ACA GCA C-3'
Insulin (Reverse) 5'-CAG TTG CAG TAG TTC TCC AGT TG-3'
PDX1 (Forward) 5'-TGC TAA TCC CCC TGC GTG CCT GTA-3'
PDX1 (Reverse) 5'-CTC CTC CGG TTC TGC TGC GTA TGC-3'
PPAR α (Forward) 5‘-TGT CAC ACA ATG CAA TCC GTT T-3’
PPAR α (Reverse) 5‘-TTC AGG TAG GCT TCG TGG ATT C-3’
CPT1 (Forward) 5'-TAT GTG AGG ATG CTG CTT CC-3'
CPT1 (Reverse) 5'-CTC GGA GAG CTA AGC TTG TC-3'
UCP2 (Forward) 5'-AAA GAT ACT CTC CTG AAA GC-3'
UCP2 (Reverse) 5'-TTA CTA CGT TCC AGG ATC C-3'
PC (Forward) 5'-GCCAACAGAGGTGAGATTGCCATCC-3'
PC (Reverse) 5'-CATCTTGCGGACCACCTCTG-3'
PDK1 (Forward) 5'-ACC ATG CAG ACA AAG GCG TTT-3'
PDK1 (Reverse) 5'-TAT ACA CAG GGA GTC TTT CGA TG-3'
PDK2 (Forward) 5'-GCC ACG AGT CCA GCC TCA CTC-3'
PDK2 (Reverse) 5'-GAC AGG CAG GCG CTC CAC T-3'
ACC (Forward) 5'-CGT GTG TGG AAG TGG ACG-3'
ACC (Reverse) 5'-TCT CTG CAT AGC ACT GGC C-3'
FAS (Forward) 5'-CCC ATC TTC CTG CCT GTG-3'
FAS (Reverse) 5'-TGT GCT GTC TCC TCG-3'
ADD (Forward) 5'-GTA CTG CAG CCA CAC TTC AT-3'
ADD (Reverse) 5'-CAC ATC TGT GCC TCC TCC AC-3'
GPAT (Forward) 5'-CAA CAA CCT CAA CAT CCC CAT CTT C-3'
GPAT (Reverse) 5'-CAG TCT AGA CTA CAG CAC CAC GAA GCT CAG AAT G-3'
PAP (Forward) 5'-CAG GGA TCC ATG GAG CGG AGG TGG GTC TTC G-3'
PAP (Reverse) 5'-CAG TCT AGA AGC ATA GCA GTT AGG GTC GGT C-3'
DGAT (Forward) 5'-CAG ACG CGT GAC GAG GTG CGG GCC GAA GCC ATG-3'
DGAT (Reverse) 5'-CAG TCT AGA GGC TGG CCT TTG GCA GTA GCT C-3'
HMG CoA (Forward) 5'-GTG ATT ACC CTG AGC TTA GC-3'
8. Western blotting
INS-1 세포를 60 x 15 mm culture dish에 2 x 106 개씩 분주하고 24시간 배양한 후, 포도당 농도가 25 mM이 되게 배양액에 포도당을 첨가하고 palmitate 400 μM 처리하여 시간별로 각각의 세포들을 수거하여 RIPA buffer (1% triton X-100, 1% sodium deoxycholate, 50 mM NaCl2, 50 mM Tris-HCl, 1 mM
sodium vanadate, 2 mM PMSF)를 이용하여 세포로부터 단백질을 분리, 정량하 여 sample buffer (187 mM Tris-HCl pH 6.8, 10% SDS, 30% glycerol, 100 mM DTT, 0.3% bromophenol blue)에 희석하여 5분간 끓인 다음 8~12% SDS-pholyacrylamide gel에서 전기영동 한 후, gel 상의 단백질을 전기적으로 Immobilon membrane (Milipore, Bedford, MA)으로 이동시키고 5% skim milk로 한 시간 동안 blocking하였다. 각각의 항체와 4℃에서 12시간 동안 반응시키고 TBST(25 mM Tris-buffered saline, 0.3% Tween20) buffer로 세 번 세척하여 horseradish peroxidase가 결합된 2차 항체로 한 시간 동안 반응시킨 후, TBST 로 세 번 세척하여, ECL (enhanced chemiluminescence) system (Amersham Bioscience, Pittsburgh, USA)으로 항체와 결합된 단백질들을 조사하였다.
9. Palmitate oxidation
INS-1 세포를 12 well plate에 3 x 105 으로 분주하여 24시간 배양하고 포 도당 25 mM이 포함된 RPMI 1640 배양액으로 교환해준 후에 palmitate 400 μM 을 처리하여 시간별로 실험을 수행하였다. HG/PA를 처리한 배양액을 버린 후 KRB buffer로 2회 씻어낸 후, 2 mM 포도당, 1 mM carnitine, 0.5 μCi/ml [1-14C]palmitate 와 unlabeled palmitate 200 μM를 0.05% BSA가 포함된 KRB buffer를 넣고 2시간 배양하였다. 유리병 안에 두개의 LS vial tube을 넣고, 하나 의 LS vial tube에는 배양이 끝난 배양액을 옮겨 담고, 다른 한쪽의 LS vial tube에는 1M KOH 400 ㎕를 넣었다. 배양액이 들어간 LS vial tube에 차가운 40% perchloric acid를 150 ㎕ 더하여 반응을 정지시키고 유리병 마개를 닫고 봉
합하여 실온에서 16시간 동안 방치시켰다. LSC cocktail 4 ㎖과 반응이 끝난 KOH를 섞어서 lipuid scintillation counting하여 값을 측정하였다.
10. Pyruvate oxidation
INS-1 세포를 12 well plate에 3 x 105 으로 분주하여 24시간 배양하고 포 도당 25 mM이 포함된 RPMI 1640 배양액으로 교환해준 후에 palmitate 400 μM 을 처리하여 시간별로 실험을 수행하였다. HG/PA를 처리한 배양액을 버린 후 KRB buffer로 2회 세척한 후, 2 mM 포도당, 1 mM pyruvate, 0.1 μCi/ml [1-14C]pyruvate 포함된 KRB buffer를 넣고 2시간 배양하였다. 유리병 안에 LS vial tube를 두개를 넣고, 하나의 LS vial tube에는 배양이 끝난 배양액을 옮겨 담고, 다른 한쪽의 LS vial tube에는 1M KOH 400 ㎕를 넣었다. 배양액이 들어 간 LS vial tube에 차가운 40% perchloric acid를 150 ㎕ 더하여 반응을 정지시 키고 유리병을 마개로 봉합하여 실온에서 16시간 동안 방치시켰다. LSC cocktail 4 ㎖과 반응이 끝난 KOH를 섞어서 lipuid scintillation counting하여 값을 측정 하였다.
11. Metabolite extraction
INS-1 세포를 100 x 20 mm culture dish에 1 x 107 개씩 분주하여 24시간 동안 배양한 후 포도당 25 mM 과 palmitate 400 μM을 처리하여 시간별로 세포 를 수거하였다. 세포의 배양액을 버리고 차가운 PBS로 2회 씻어준 후 -20℃, 80% methanol을 더하여 액체질소 위에서 세포를 수거하여 1.5 ㎖ tube에 옮겨 담은 후, vortex 하여 6000 x g에서 원심분리 하여 상층액을 얻었다. 이 과정을 2회 더 반복하여 pooling extraction 시켰다. 모아진 sample은 45℃, 진공상태에 서 건조시켰다. 이것을 50% methanol로 다시 용해시키고 debris를 제거하기 위 하여 13000 x g에서 원심분리 하여 상층액을 얻고, 이 상층액에 internal standard mix를 더하여 대사체의 변화량을 LC-MS/MS로 분석하였다.
Ⅲ. 결 과
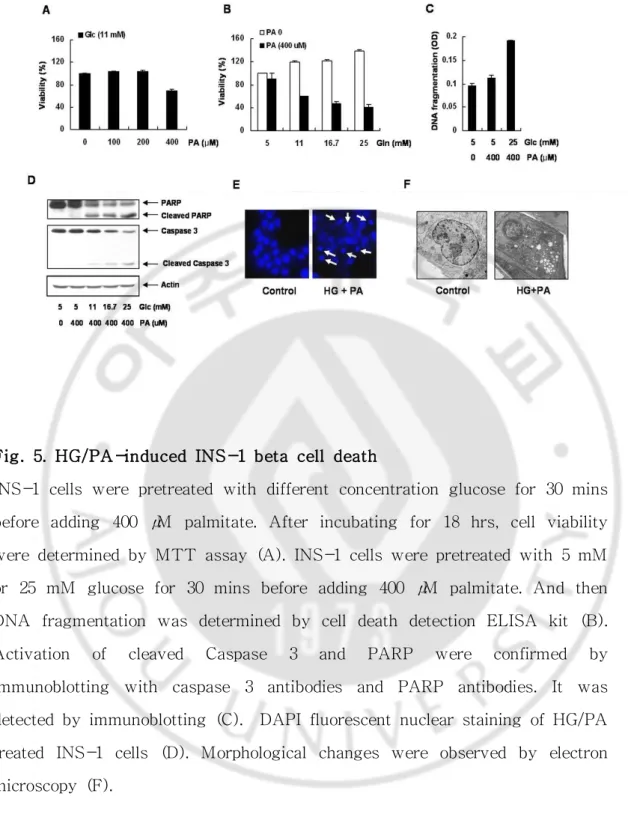
A. 고농도 포도당과 palmitate에 의해 INS-1 세포에서 포도당/지방산독성 (Glucolipotoxicity)이 나타남 INS-1 세포에서 포도당/지방산독성 (glucolipotoxicity)이 나타나는지 확인 하기 위하여 11 mM 포도당이 포함된 배지에서 INS-1 세포를 하루 동안 배양한 후, palmitate를 농도별로 처리하고 MTT assay 방법으로 세포의 생존율을 확인 하였다. 그 결과 11 mM 포도당만 처리한 INS-1 세포의 생존율을 100%로 정했 을 때 11 mM 포도당과 400 μM palmitate 농도에서 INS-1세포의 생존율이 70% 로 나타났다 (Fig 5-A). Palmitate의 농도를 400 μM로 고정시키고 포도당 농도 를 5 mM, 11 mM, 16.7 mM, 25 mM로 처리 하였을 때 INS-1 세포의 생존율은 90%, 60%, 47%, 40%로 나타나 포도당 농도에 의존적으로 세포의 생존율이 감 소하는 것을 확인하였다 (Fig 5-B). 이 결과로 인하여 INS-1 세포에서 포도당/ 지방산독성 (glucolipotoxicity)이 나타나는 것을 확인하였다.포도당/지방산독성에 의해 INS-1 세포사가 진행될 때 어떤 경로를 통해 세 포사가 진행되는지 알아보기 위하여 Cell death detection kit를 사용하여 DNA fragmentation을 측정하였다. palmitate 농도를 400 μM로 고정시키고, 포도당 5 mM 또는 25 mM 농도를 처리하여 18시간 후에 DNA fragmentation을 확인한 결과 25 mM 포도당과 400 μM palmitate를 처리한 세포가 5 mM 포도당만 처리 한 세포보다 DNA fragmentation이 1.8배 증가한 것을 확인하였다 (Fig 5-C). 또 한 apoptosis의 대표적인 단백질인 Caspase (cysteinyl aspartate-specific proteases)를 확인하고자 위와 같은 조건에서 18시간 배양 후, 세포를 수거하여 western blot으로 Caspase 3의 발현 양상을 확인하였다 (Fig 5-D). 포도당의 농 도가 높아짐에 따라 cleaved Caspase 3의 발현이 증가하였고, cleaved PARP 역
시 포도당 농도가 높아짐에 따라 발현양이 증가하는 것을 관찰하였다. 또 다른 세포사의 특징으로 세포사가 일어나면 핵이 응축되는 현상이 나타난다. INS-1 세포에 25 mM 포도당과 400 μM palmitate를 18시간 처리한 후 DAPI 염색을 하여 핵의 모양을 관찰하였다. 대조군은 정상적으로 핵이 존재하는데 비해 25 mM 포도당과 400 μM palmitate 처리한 세포에서는 핵이 응축되는 것을 확인하 였다 (Fig 5-E). 또한 HG/PA를 처리하고 18시간 후에 전자 현미경으로 세포를 관찰한 결과 핵이 응축되는 것을 확인하였고, ER membrane의 격리가 일어나는 것을 확인하였으며, 미토콘드리아의 크기가 커지는 것을 확인하였다 (Fig 5-F). 결론적으로 INS-1 세포에서 고농도 포도당과 palmitate에 의해 포도당/지방산독 성 (glucolipotoxicity)이 나타나며 이것은 apoptosis를 통한 세포사로 확인 되었 다.
Fig. 5. HG/PA-induced INS-1 beta cell death
INS-1 cells were pretreated with different concentration glucose for 30 mins before adding 400 μM palmitate. After incubating for 18 hrs, cell viability were determined by MTT assay (A). INS-1 cells were pretreated with 5 mM or 25 mM glucose for 30 mins before adding 400 μM palmitate. And then DNA fragmentation was determined by cell death detection ELISA kit (B). Activation of cleaved Caspase 3 and PARP were confirmed by immunoblotting with caspase 3 antibodies and PARP antibodies. It was detected by immunoblotting (C). DAPI fluorescent nuclear staining of HG/PA treated INS-1 cells (D). Morphological changes were observed by electron microscopy (F).
B. 여러 가지 저해제를 이용한 INS-1 세포사의 작용기전 확인
1. HG/PA에 의한 INS-1 세포사에서 산화적 스트레스와 스트레스 신호의 영향
포도당/지방산독성에 의한 베타세포의 세포사를 유도하는 매개인자로써 Reactive Oxigen Species (ROS)와 JNK, p38 MAPK와 같은 스트레스 신호 분 자, 또는 NF-κB의 활성 등이 알려져 있다. 이러한 매개인자들이 HG/PA에 의한 INS-1 세포사에 관계되어 있는지 확인하였다. INS-1 세포를 96 well plate에 분 주하여 하루 동안 배양한 후에 25 mM 포도당이 포함된 배지에 각각의 약제들을 첨가해주고 여기에 400 μM palmitate를 처리하여 18시간 후에 MTT assay로 세 포의 생존율을 확인하였다. 25 mM 포도당만 처리한 세포의 생존율은 100%로 나타났으며 25 mM 포도당과 400 μM palmitate에 의해서 세포의 생존율은 40% 로 나타났다. 이때 anti-oxidant인 NAC, GSH와 NO 저해제인 NMMA, P38 저 해제인 SB203580, JNK 저해제인 SP600125, NF-κB 저해제인 SN50에 의해서 HG/PA에 의한 INS-1 세포의 생존율에 큰 영향을 주지 않았다 (Fig 6).
2. HG/PA에 의한 INS-1 세포사에서 ER stress와 calcium의 영향
포도당/지방산독성에 의한 베타세포의 세포사 매개인자로 알려져 있는 ER stress와 calcium 신호가 HG/PA에 의한 INS-1 세포사에 관여하는지 알아보았 다. INS-1 세포를 96 well plate에 분주하고 하루 동안 배양한 후에 25 mM 포 도당이 포함된 배지에 ER stress 관련 약제인 chemical chaperon 4-PBA와 calcium 관련 약제들을 처리하고, 여기에 400 μM palmitate를 처리하여 18시간 후에 MTT assay로 세포의 생존율을 확인하였다. 그 결과 ER stress 관련 약제 인 4-PBA에 의해 INS-1 세포의 생존율은 51%로 나타났다. Ca2+관련 약제 중 intracellular Ca2+ chelator인 EGTA/AM에 의해 INS-1 세포의 생존율이 54%, L-type Ca2+ channel blocker인 nifedipine, nimodipine에 의해 세포의 생존율이
56%, 49%로 나타나 세포사멸 저해 효과를 보였고, L-type Ca2+ channel opener 인 BayK8644에 의해서는 세포의 생존율이 36%로 나타났고, ryanodine receptor Ca2+ channel blocker인 dantroline에 의해 세포의 생존율이 49%로 나타났다 (Fig 7).
3. HG/PA에 의한 INS-1 세포사에서 지방산 대사의 영향
베타세포가 포도당과 palmitate에 지속적으로 노출되면 베타세포의 대사는 지방산 산화 보다는 지방합성 경로로 활성화 되어 TG 에스테르화가 촉진된다. 그 과정 중에 생성되는 ceramide, cholesterol, arachidonic acid 와 같은 중간대사 산물이 만들어 내는 신호가 베타세포에 독성을 나타낸다고 알려져 있다. 이러한 지방합성 경로의 활성과 함께 생성된 중간대사산물들이 HG/PA에 의한 INS-1 세포사에 관여하는지 확인하기 위하여 지방대사 경로에 관여하는 여러 가지 저 해제 또는 활성제를 HG/PA와 함께 INS-1 세포에 처리하여 세포의 생존율을 확 인하였다. INS-1 세포를 96 well plate에 분주하여 RPMI 1640 배양액에 하루 동 안 배양한 후, 25 mM 포도당이 포함된 배양액에 여러 가지 저해제 또는 활성제 를 처리하고, 여기에 400 μM palmitate를 처리하여 18시간 후에 MTT assay로 세포의 생존율을 확인하였다. 그 결과 CPT-1을 저해하는 etomoxir 또는 bromopalmitate에 의해 지방산의 베타산화를 저해하였을 때 세포의 생존율은 etomoxir에 의해 28%, bromopalmitate에 의해 18%로 나타났다. 반면 지방산의 베타산화를 증가시킨다고 알려진 PPARγ agonist인 bezafibrate와 AMPK 활성제 인 AICAR에 의해 세포의 생존율은 각각 79%, 63%로 나타났다. 두 번째로 LC-CoA 합성을 저해하기 위해 그 위의 경로를 차단하였다. citrate lyase 저해제 인 HCA(hydroxycitrate)에 의해 세포의 생존율은 63%로 나타났고, ACC 저해제 인 TOFA에 의해 세포의 생존율은 27%, FAS 저해제인 cerulenin에 의해 세포의 생존율이 45%로 나타났다. 세 번째, 지방대사 중간산물이 HG/PA에 의한 INS-1 세포사에 관여하는지 알아보았다. HMG-CoA 합성을 저해하는 lovastatin을 처리
하여 cholesterol 합성을 저해하였을 때 세포의 생존율이 30%, ceramide 저해제 인 fumonisin B1, myriocin에 의해 세포의 생존율은 50%, 47%로 나타났고, PKC 저해제인 GF109203x에 의해 세포의 생존율이 58%, phospholipase A 저해제인 aristochic acid에 의해 세포의 생존율이 22%로 나타났다. 네 번째, TG에서 FFA 로 분해 되는데 작용하는 효소인 HSL (hormone sensitive lipase) 저해제인 olristat에 의해 세포의 생존율은 20%로 나타났다. 마지막으로 LXR agonist인 T0901317에 의하여 세포의 생존율이 94%로 나타났다.(Fig 9).
Fig. 6. Role of oxidative stress and stress signals in viability of the HG/PA treated INS-1 cells
INS-1 cells were pretreated with 25 mM glucose and several inhibitors for 30 mins before adding 400 μM palmitate. After incubating for 18 hrs, cell viability were measured by MTT assay.
Fig. 7. Effects of ER stress and calcium signals on HG/PA treated INS-1 cells
INS-1 cells were pretreated with 25 mM glucose and several Ca2+ related inhibitors for 30 mins before adding 400 μM palmitate. After incubating for 18 hrs, cell viability were measured by MTT assay. Values are means ± S.E. *,
Fig. 9. Effects of Lipid Metabolism in viability of HG/PA treated INS-1 cells
INS-1 cells were pretreated with 25 mM glucose and lipid metabolism related inhibitors for 30 mins before adding 400 uM palmitate. After incubating for 18 hrs, cell viability were measured by MTT assay. Values are means ± S.E. *
C. HG/PA에 의한 INS-1 세포사와 지방합성과의 연관관계 1. HG/PA에 의한 INS-1 세포사에서 T0901317에 의한 지방합성 유전자 발 현의 증가 T090317에 의한 LXR의 활성이 계속되면 베타세포에 지방 독성을 일으켜 서 베타세포 기능이상을 나타낸다고 알려져 있다 (Choe등, 2007). 그러나 앞에서 확인한 바와 같이 INS-1 세포에 HG/PA를 처리하여 세포사가 유도될 때, LXR agonist인 T0901317에 의해 세포사 저해 효과가 가장 크게 나타났다. 이 상황에 서 과연 T0901317에 의해 INS-1 세포에서 지방합성이 활성화 되고 있는지를 확 인하였다. INS-1 세포를 RPMI 1640 배양액에 하루 동안 배양하고 25 mM 포도 당이 포함된 배양액으로 교체해준 후 400 μM palmitate를 처리한 세포와 T0901317 1 μM과 25 mM 포도당이 포함된 배양액으로 교체해준 후 400 μM palmitate를 처리한 세포를 1일, 3일 배양하여 Oil Red O 염색을 통하여 TG 염 색을 수행하였다(Fig 10). 그 결과 HG/PA와 함께 1 μM T0901317을 처리한 세 포는 HG/PA만 처리한 세포보다 세포사가 일어나지 않았고, 세포내에 지방 granule 처럼 보이는 것을 현미경으로 관찰하였다. 세포내에 생성된 granule은 Oil Red O 염색에 의해 빨간색으로 염색되어 TG가 축적된 것으로 확인하였다 (Fig 10). INS-1 세포에 1 μM T0901317과 25 mM 포도당과 400 μM palmitate 를 처리했을 때 1일보다 3일째에서 TG 축적이 더 활발한 것을 확인하였다. 결론 적으로 T0901317은 HG/PA에 의한 INS-1 세포의 세포사를 억제하였으며 시간 이 지날수록 TG 합성이 활성화 되는 것을 확인하였다. 이와 같은 상황에서 T0901317에 의하여 지방합성 관련 유전자들이 증가하는지 확인하였다 (Fig 11). INS-1 세포를 RPMI 1640 배양액에 하루 동안 배양한 후에 5 mM 포도당 또는 25 mM 포도당만 처리 하였을 때, 5 mM 포도당 또는 25 mM 포도당이 포함된 배양액에 400 μM palmitate를 처리 하였을 때, 5 mM 포도당 또는 25 mM 포도 당이 포함된 배양액에 1 μM T0901317을 처리하고 400 μM palmitate를 처리하여
1일, 3일 배양한 후, 세포를 수거하여 세포에서 RNA를 추출하였고 RT-PCR 방 법으로 지방합성에 관여하는 여러 유전자들의 mRNA 변화량을 확인하였다. 25 mM 포도당만 하루 처리 했을 때 acetyl-CoA에서 malonyl CoA로 전환시켜 주 는 효소인 ACC (Acetyl-CoA Carboxylase)와 malonyl CoA에서 palmitoyl CoA 로 전환시켜주는 효소인 FAS (Fatty acid Synthase) 유전자의 mRNA 발현양이 가장 뚜렷하게 나타났고, 25 mM 포도당과 400 μM palmitate를 처리 하였을 때 ACC, FAS 유전자의 mRNA 발현양이 감소하였다. HG/PA에 T0901317을 처리 하였을 때 HG만 처리 했을 때 보다 ACC, FAS 유전자의 mRNA 발현양이 증가 하였고, T0901317에 의하여 ADD (SREBP-1c) 유전자의 mRNA 발현양이 가장 높게 증가하였다. 2. INS-1 세포에서 HG/PA에 의한 포도당 대사와 지방합성 관련 유전자 발 현의 변화 INS-1 세포를 RPMI 1640 배양액에 하루 동안 배양한 후, 25 mM 포도당 을 처리 또는 25 mM 포도당과 400 μM palmitate를 처리하여 INS-1 세포를 배 양하였다. 6시간 간격으로 0시간부터 24시간 까지 세포를 수거하여 RNA를 추출 하였고, RT-PCR 방법으로 베타세포 특이 유전자들과 지방산 베타산화에 관여하 는 유전자들, 지방합성에 관여하는 유전자들의 변화를 확인하였다. 그 결과 베타 세포 특이 유전자 중 포도당대사에 관여하는 GK (glucokinase) 유전자의 mRNA 양이 25 mM 포도당과 400 μM palmitate를 처리 하였을 때 시간이 경과함에 따 라 점차 감소하는 경향을 보였다. 또한 지방합성에 관여하는 여러 유전자들 중 지방합성에 결정적인 전사인자인 ADD, ACC, FAS 유전자의 mRNA의 양은 25 mM 포도당에 의해서 시간이 경과함에 따라 점차 증가하였고, 25 mM 포도당과 400 μM palmitate에 의해서는 시간이 경과함에 따라 점차 감소하는 경향을 보였 다. 또한 지방산의 베타산화에 관여하는 효소인 CPT-1 (Carnitine Palmitoyltransferase 1)과 UCP2 (Uncoupling protein 2) 유전자의 mRNA의 발
현 양에는 큰 변화가 없었다. 포도당 대사에 의해 생성된 pyruvate는 미토콘드리 아에서 oxaloacetate로 대사 되는데 여기에 작용하는 효소인 PC (pyruvate carboxylase)는 지방산 합성과 anaplerosis에 중요한 역할을 하며 포도당에 의한 인슐린 분비에도 필수적인 효소이다. PC 유전자의 mRNA 발현양은 25 mM 포 도당과 400 μM palmitate 처리에 의해 12시간 이후로 급격하게 감소하였다.
Fig. 10. T0901317 increase TG accumulation in HG/PA treated INS-1 cells
INS-1 cells were pretreated with 5 mM glucose or 25 mM glucose and T0901317 1 μM for 30 mins before adding 400 μM palmitate for 1days, 3days analyzed by Oil Red O staining.
Fig. 11. T0901317 regulate lipid synthesis related gene expression.
INS-1 cells were pretreated with 5 mM glucose or 25 mM glucose and treated with vehicle or 1 μM T0901317 for 30 mins before adding BSA or 400 μM palmitate for 1days, 3days. These gene expression monitored by RT-PCR.
Fig. 12. Effects of HG/PA on glucose metabolism and lipid metabolism related gene expression in INS-1 cells
INS-1 cells were treated with 25 mM glucose. In individual groups palmitate were added after 30 mins. After 0, 6, 12, 18, 24 hrs. RT-PCR were performed to check the mRNA levels.
D. 미토콘드리아 대사 이상에 의한 에너지 부족에 의한 세포사
1. TCA 회로의 anaplerosis/cataplerosis 조절에 의한 세포사 억제효과 미토콘드리아의 TCA 회로 중간산물들의 재공급 또는 증가에 (anaplerosis) 의해 미토콘드리아의 대사가 활성화 되고, 미토콘드리아에서 대사된 산물은 미토 콘드리아에서 세포질로 유출되어 (cataplerosis) 어떠한 신호를 전달하게 된다 (MacDonald, 2007). INS-1 세포에서 HG/PA에 의하여 지방합성 경로가 활성화 되는데, 지방합성 경로의 활성이 세포사를 유도하는데 중요하게 작용하지 않는 것으로 보여 지방합성 경로의 전 단계인 미토콘드리아 대사에 이상이 생겼을 것 으로 추측하였다. 이때 외부에서 TCA 회로의 중간산물을 증가 시켜주면 HG/PA 에 의한 INS-1 세포사에 저해효과가 나타나는지 확인하였다. INS-1 세포를 RPMI 1640 배양액에서 하루 동안 배양한 후, 25 mM 포도당이 포함된 배양액에 pyruvate, metyl-pyruvate, leucine, glutamine, leucine과 glutamine, BCH (aminobicyclo-heptane-2-carboxylic acid), KIC (α-ketoisocarproic acid), MMS (mono methyl succinate), KIC와 MMS 등의 아미노산을 처리하고, 여기에 400 μM palmitate를 처리하여 18시간 후에 MTT assay를 통하여 세포의 생존율을 확인하였다. 그 결과 HG/PA에 의해 INS-1 세포의 생존율이 40% 나타날 때 pyruvate와 methyl pyruvate에 의해서 세포의 생존율에 변화가 없었고, leucine 에 의해 INS-1 세포의 생존율은 58%, leucine과 glutamine에 의해서는 세포의 생존율이 52%, leucine의 analogue인 BCH에 의해 세포의 생존율이 84%로 나타 났다. KIC와 MMS에 의해서 세포의 생존율은 62%를 보였다. 또한 미토콘드리아 대사에 의해 생성된 citrate가 세포질로 빠져나가는 통로를 저해하는 약제인 BTA (1,2,3-benzentricaboxylate)를 INS-1 세포에 HG/PA와 함께 처리 하였을 때 INS-1세포의 생존율이 73%로 나타났다. 반면 PC의 저해제인 PAA(phenyl acetic acid)를 처리하여 pyruvate가 미토콘드리아 내로 대사되는 것을 저해 하였 을 때 세포의 생존율이 13%로 나타났다.
Fig. 14. Effects of anaplerosis/cataplerosis in viability of HG/PA treated INS-1 cells
INS-1 cells were pretreated with 25 mM glucose and anaplerotic/cataplerotic fuels or inhibitors for 30 mins before adding 400 μM palmitate. After incubating for 18 hrs, cell viability were measured by MTT assay. Values are means ± S.E. * P < 0.05 , ** P < 0.01 versus HG+PA.
2. TCA cycle components의 변화 INS-1 세포에서 HG/PA 처리에 의해 미토콘드리아의 대사 이상이 나타나 는지 확인하였다. 우선 세포내 에너지 생산 경로인 미토콘드리아의 TCA 회로가 원활히 돌아가고 있는지를 확인하기 위해 INS-1 세포에 HG/PA를 처리하여 시 간에 따라 TCA 회로의 중간산물들의 변화량을 확인하였다. INS-1 세포를 RPMI 1640 배양액에 하루 동안 배양한 후, 25 mM 포도당과 400 μM palmitate 를 처리하여 6시간 간격으로 0시간부터 18시간 까지 세포를 수거한 후, 대사체를 추출하였다. 추출한 대사체에서 LS-MS 방법을 통하여 TCA 회로 중간산물들의 변화량을 확인하였다 (Fig 14). 그 결과 malate, α-ketoglutarate와 malonyl-CoA 는 6시간에 약간 증가하였고, 그 이후로 양이 감소하였다. 그리고 citrate, acetyl-CoA는 시간이 경과함에 따라 서서히 지속적으로 감소하였고, malate의 양적인 변화가 가장 뚜렷하게 나타났다. 결론적으로 HG/PA에 의해 INS-1 세포 에서 TCA 회로의 중간 대사산물들은 시간이 경과함에 따라 모두 감소되었다.
Fig. 15. HG/PA induced the reduction of TCA cycle intermediates in INS-1 cells
INS-1 cells were incubated pretreated with 25 mM glucose for 30 mins before adding 400 μM palmitate. After 0, 6, 12, 18 hrs. Cells were harvested and metabolites extraction performed as described Material and Methods. The level of extracted metabolites determinded via LC-MS/MS.
3. HG/PA에 의한 INS-1 세포사에서 pyruvate 산화와 palmitate 산화의 감 소
미토콘드리아 대사 이상이 초래되면 미토콘드리아에서 pyrvate와 palmitate 의 산화가 감소될 것으로 생각하였다. HG/PA 처리에 의해 INS-1 세포에서 pyruvate와 palmitate의 산화가 감소되어 있는지 확인하였다. INS-1 세포를 RPMI 1640 배양액에 하루 동안 배양한 후, 25 mM 포도당과 400 μM palmitate 를 처리하여 6시간 간격으로 pyruvate 산화를 측정하였다. 이때 14C label 되어있 는 pyruvate가 세포내로 들어가서 산화되는 비율을 측정하였다. 이때 음성대조군 으로써 PC 저해제인 PAA 농도 10 mM을 2시간 처리한 세포에서는 pyruvate 산 화가 80% 감소한 것을 확인하였다. HG/PA 처리하고 0시간에서 pyruvate 산화 를 1로 보았을 때 시간이 경과함에 따라 pyruvate 산화가 지속적으로 감소하는 것을 확인하였다 (Fig 16). 또한 HG/PA에 의해서 INS-1 세포에 포도당/지방산 독성이 나타날 때 palmitate의 산화가 감소되어있는지 확인하였다. 14C label 되어 있는 palmitate를 이용하여 세포내로 palmitate가 들어가서 산화되는 정도를 측정 하였다. 25 mM 포도당과 400 μM palmitate를 처리하고 6시간 간격으로 18시간 까지 처리한 세포에서 14C label 되어있는 palmitate를 2시간 동안 반응시킨 후에 palmitate 산화를 측정하였다. 양성대조군으로써 palmitate의 지방산화를 촉진시 켜 주는 bezafibrate를 6시간 처리하였고, 또한 음성대조군으로써 지방산화를 억 제시키는 etomoxir를 6시간 동안 처리한 후, 14C label 되어있는 palmitate를 2시 간 동안 반응시켜 palmitate 산화를 측정하였다. HG/PA를 6시간 처리한 세포와 비교하여 bezafibrate를 처리한 세포에서 palmitate의 산화가 1.2배 증가하였고, etomoxir를 처리한 세포에서는 palmitate의 산화가 0.6배 감소하는 것을 확인하 였다. 또한 HG/PA를 시간별로 처리한 세포에서는 0시간을 기준으로 하여 값을 1로 정하였을 때 6시간에는 0.8, 12시간에는 0.6, 18시간에는 0.2의 값을 나타냈 다. 결론적으로 시간이 경과함에 따라 palmitate 산화되는 정도가 지속적으로 감소하였다 (Fig 17).