정책동향 2018년 12권 1호
1. 들어가며
2016년 1월 스위스 다보스에서 개최된 세계경제포럼에서 처음으로 언급된 4차 산업혁명
(the forth industrial revolution)은 이후 여러 분야의 화두로 언급되고 있다. 4차 산업혁명의 개념을 파악하기 위해서는 먼저 1차, 2차, 3차 산업혁명을 이해할 필요가 있다. 1차 산업 혁명은 1784년에 시작되어 물과 증기를 이용한 기계 생산 설비의 도입을 의미한다. 이어서 1870년에 시작된 2차 산업혁명은 노동 분업과 전기 도입으로 대량 생산 시대를 특징으로 한다. 3차 산업혁명은 1969년에 시작된 전자기술과 정보통신기술(Information Technology; IT)의 사용을 통한 제조업의 자동 생산시대로 구분할 수 있다. 이후 우리가 살고 있는 4차 산업혁명은 사이버 세계와 물리적 공간의 융합으로 두 세계의 경계가 소멸되는 시기로 규정 되고 있다. 예전에는 의약품이라고 하면, 화학적 의약품을 주로 의미하였으나 이제는 바이오 의약품을 거쳐 최첨단 의료기기와 화학적 의약품이 결합된 디지털 약의 출현을 앞두고 있다. 이러한 경계의 소멸은 엄청난 파장을 예고하고 있으며, 의료기술의 평가(Health Technology Assessment; 이하 HTA)에 있어서도 새로운 패러다임을 요구하고 있다.
최근 발표된 경제협력개발기구(Organization for Economic Cooperation and development; OECD) ‘New Health Technologies: Managing Access, Value and sustainability’(2017)
보고서에 따르면 과거의 의료기술의 가치는 연구자에 의해 까다롭게 통제된 무작위대조시험
(Randomized Controlled Trial; 이하 RCT)에서 도출된 효능(efficacy)을 근거 자료로 확보하고 기존의 의료기술 보다 저렴하게 공급될 때, 가치가 높게 평가되었다. 반면, 4차 혁명시대에
의료기술평가
(HTA)
에 있어서
Real World data의 활용 현황
변지혜부연구위원 건강보험심사평가원 의약기술연구팀
해외동향 없었던 RCT의 단점을 극복할 것으로 기대되면서, HTA의 패러다임 변화가 요구된다고 기술 하고 있다. 현재, 우리나라의 대표적인 RWD는 건강보험청구자료가 있다. 향후 건강보험 청구자료는 지금의 청구명세서 내용과 달리, 영상정보, 임상검사 수치 등 여러 자료원에서 다양한 방식으로 실시간 수집되는 실제 정보를 의미하게 될 것이다. 이에 본 고에서는 RWD의 최신 동향에 대해 알아보고자 한다.
2. RWD 사용에 관한 정책 및 활용 동향
RWD의 정의는 여전히 진행 중이다. 현재 RWD는 건강보험청구자료는 실제 임상 현장 에서 여러 다른 특성의 환자들을 대상으로 실시된 의료 행위에서 얻어진 자료로 보험 청구 자료나 임상 기록(clinical data from electronic health records)을 의미한다. 이러한 RWD를 통해 산출된 근거를 실제임상근거(Real World Evidence; 이하 RWE)라고 부른다. RWD와 RWE가 포함하는 데이터의 종류는 다음과 같이 정리해볼 수 있다.표 1. RWD와 RWE가 포함하는 데이터 비교
RWD(Real World Data) RWE(Real World Evidence)
포함되는 데이터의 종류
・ 청구데이터(claims data),
의무기록(electronic medical records, eHealth records), 설문조사(survey) ・ 사망지표(death index)
・ 웨어러블 센서기(wearables/secsors) ・ 사회관계망(social network) ・ 무작위대조시험과 연관된 의무기록
(RCT‘s leveraging EMRs)
・ 환자중심성과평가(patient centered outcomes assessments)
・ 실용임상시험(Pragmatic clinical trials; PCTs) ・ 전향적/후향적 관찰연구 (prospective/
retrospective observational studies) - 환자등록자료(registry) ・ 환자수준의 메타분석(patient level meta-analysis) ※참고 ・ RWE적용 범위 - 의료기기의 승인에 관한 FDA가이드라인 - 의약품 라벨: 비교 효과연구, 이밖에 RWE 사용이 확대 가능한 분야(약물감시결과, 임상사용 경험, 하위 인구집단에 적용 결과, 대체 가능한 용량조절 계획)에 대한 PDUFA법률 개정 연구 진행 중 - 관리 의료(managed care)의 의사결정
자료: Ramsey et al.(2017). Enhancing the Transparency and Credibility of Real Wrold Evidence in Health Care Decision Making
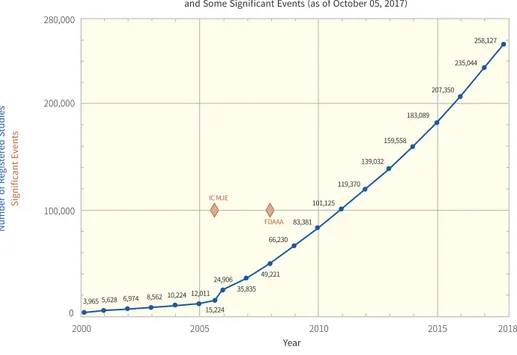
정책동향 2018년 12권 1호 이미 RWD는 여러 분야에서 활용되기 시작하였다. 주로 RCT 근거 창출에 한계가 있는 의료기기나 희귀의약품의 의사결정에서 RWD가 고려되고 있다. 특히, FDA는 의료기기의 허가과정에서 RWD 사용을 위한 가이드라인을 발표하였다. 의약품에서는 이스라엘의 테바가 IBM과 제휴하여, 테바의 의약품을 복용하는 환자 중 약 2억 명의 데이터를 모아 부작용 사례, 추가 적응증 확보 및 신약 개발을 진행하고 있다. 화이자는 자사가 보유한 암과 관련된 대규모 자료를 클라우드 기반 인공지능 플래폼인 IBM의 신약탐색용 왓슨을 이용하여 항암 신약 연구 개발에 착수하였다. 2017년 ISPOR(international society for pharmacoeconomics and outcomes research) 미팅에서 FDA 관계자인 Jacquline Corrigan-Curay, JD, MD가 발표한
자료에 따르면 RWD와 관련하여 신청된 레지스트리(registry) 등록 건수는 급격히 증가하고
있다.
그림 1. RWD와 관련한 레지스트리 구축 신청 건수
이러한 변화 속에 이 절에서는 현재 건강보험제도에서 RWD의 활용 정도와 규제 상황
등을 알아보기 위해 6개 HTA의 최신 정책 동향을 비교한 Makady(2017) 연구 결과를 소개
해보고자 한다. 이 연구에서 비교한 HTA 기관은 스웨덴의 The Dental and Pharmaceutical Benefits Agency(Tandvårdsoch-läkemedelsförmånsverket; 이하 TLV), 영국의 The National Institute for Health and Care Excellence(이하 NICE), 독일의 The Institute for Quality
IC MJE FDAAA 2000 0 100,000 Number of R egis ter ed S tudies Signific ant E vent s
Number of Registered Studies Over Time and Some Significant Events (as of October 05, 2017)
200,000 280,000 Source: https://ClinicalTrials.gov 2005 2010 Year 2015 2018 3,965 5,628 6,974 8,56210,224 12,011 15,224 24,906 35,835 66,230 83,381 101,125 119,370 139,032 159,558 183,089 207,350 235,044 258,127 49,221
해외동향
del Farmaco; 이하 AIFA), 네덜란드의 The National Healthcare Institute(Zorg-instituut
Nederland; 이하 ZIN) 등 이다. 이 연구에서는 이들 기관을 대상으로 급여 등재, 약물경제성 평가, 조건부 급여 시 RWD 활용에 대한 가이드라인, 정책 연구 보고서 발간 상황을 비교 하였다. 조사는 문헌조사와 기관 종사자의 인터뷰를 통해 진행되었다. 비교 결과, 6개 기관 모두는 정책 연구보고서나 가이드라인을 발간한 것을 확인할 수 있었다. 가이드라인에서는 RWD는 역학 정보인 유병률, 발생률, 사용된 자원, 비용 등의 정보를 제공하는데 사용될 수 있다는 내용을 명시하고 있다. 급여 등재 시 RWD 활용에 대해서, 기관 관계자들은 RWD가 의약품의 치료 효과(effectiveness)1) 평가에 사용될 수 있을 것이라고 답했다. 적용 범위는 RCT가 부재한 경우에 한해 사용될 수 있다고 하였다. RCT의 부재라 함은 두 치료 제의 직접적인 비교(head-to-head)가 없는 경우로, 이때 RWD가 간접비교 방법으로 사용될 수는 있을 것이지만 RWD의 근거 수준은 RCT의 보충자료에 불과하다고 답변하였다. 결과 적으로 HTA 기관 연구자들은 RWD의 근거 수준을 RCT 보다 낮은 단계로 평가하고 있었 으며, RCT를 대체하는 데이터가 아닌 RCT의 결과를 확인하거나 보완하는 자료로 평가하고 있었다. 그러나 희귀질환 치료제의 효과 평가와 관련한 RWD 활용에 대해서는 연구자마다 다르게 평가될 수 있다는 입장이었다. 한편, 약물경제성평가에 있어 RWD 활용을 묻는 질문에 약물경제성평가 연구를 진행하지 않는 1개 기관을 제외한 5개 기관의 연구자들은 급여 등재 때 보다 약물경제성평가에 있어 RWD 활용이 더 일반적이라고 답하였다. 예를 들면, 역학 자료로 유병률 및 발생률 자료, 직·간접비용의 산출, 청구데이터·레지스트리·병원의무 기록에서 확인할 수 있는 의료자원의 이용, 특히 치료제에 대한 복약 순응도의 평가 자료로 RWD 사용을 추천하고 있었다. 이들 중 한 기관에서는 경제성평가 연구에 있어 RWD자료를 이용하여 산출된 전이확률을 모형에 적용함으로써 시간 경과에 따른 효용 변화를 고려하기도 하였다. 하지만 약물경제성평가에서도 RWD의 근거 수준이 RCT 보다는 낮게 평가되는 입장을 보였다. 끝으로 조건부 급여에 있어서 RWD의 활용 정도를 비교해보았다. 조사대상 6개 HTA기관의 국가 중 3개국(스웨덴, 영국, 독일)에서는 조건부 급여가 실시되지 않고 있었다. 조건부 급여를 실시하는 나머지 3개국(프랑스, 이탈리아, 네덜란드)에서 RWD의 활용 정도를 비교한 결과, 이들 3개 기관에서 RWD를 수집하는 목적에 차이가 있었다. 네덜란드의 ZIN에서 의미하는 조건부 급여 의약품은 매우 혁신적이고 효과 데이터가 매우 부족한 경우이기 때문에 1) 연구자에 의해 통제된 임상시험의 결과로 얻어지는 효능(efficacy)과 실제 진료현장에서 얻어진 결과인 효과(effectiveness)는 구분하여 사용된다.
정책동향 2018년 12권 1호 RWD 수집 목적이 RCT를 보완할 수 있는 치료 효과 평가에 있었다. 프랑스 HAS의 조건부 급여에 대한 RWD 수집 목적은 건강보험시스템에서 실제 치료효과와 비용-효과성을 증명 하는 것으로 이 경우는 RCT보다 RWD가 더 선호되고 있었다. 이탈리아의 AIFA에서 RWD를 조건부 급여에 사용하는 목적은 여러 가지가 있었는데, 치료효과 평가, 비용-효과성 확인, 가격 재평가를 목적으로 RWD를 활용하고 있었다. 그러나 공통적으로 가이드라인에 따라 연구 프로토콜(protocol)이 계획되었는지, RWD로 도출된 근거(Real World Evidence; RWE)와
임상근거문헌 사이의 차이(gap)가 충분히 설명되는 자료인지 여부, 연구 프로토콜의 순응 도를 확인한다고 답하였다. 국가 HTA기관 별 RWD 정책 및 활용 정도를 다음 표로 정리 하였다. 표 2. 6개 HTA 기관의 RWD 정책 및 활용 정도 비교 HTA 기관명 국가 정책연구 보고서 또는 가이드라인 급여 등재 약물경제성평가 조건부급여 RWD 수용/요구 RWD 결론에 대한 평가 RWD 수용/요구 RWD 결론에 대한 평가 RWD의 목적 RWD가 의사결정에 미치는 영향 TLV 스웨덴 있음 특수한 상황에서 가능 신중한 평가 (희귀질환의 경우, 예외적으로 인정 가능) 특수한 상황에서 가능 신중한 평가, 믿을 수 있는 매개 변수에 대한 평가 급여제도가조건부 없음 NICE 영국 있음 상동 상동 상동 IQWiG 독일 있음 아니오 아니오 아니오 HAS 프랑스 있음 언급된바 없음 특수한 상황에서 가능 신중한 평가, 믿을 수 있는 매개 변수에 대한 평가 효과 (effectiveness), 비용 -효과성 확인 생성된 자료가 충분히 근거 자료의 갭을 설명 하는지, 연구 프로토콜에 순응도 정도 AIFA 이탈리아 언급된바 없음 효과 (effectiveness), 비용 -효과성 확인, 약가 재협상 생성된 자료가 충분히 근거 자료의 갭을 설명 하는지 여부 ZIN 네덜란드 신중한 평가 (희귀질환의 경우, 예외적으로 인정 가능) 효과 (effectiveness) 생성된 자료가 충분히 근거 자료의 갭을 설명 하는지, 연구 프로토콜에 순응도 정도 자료: Makady A et al.(2017)의 표1, 표3-5 결과를 재정리함.
주) HTA: Health Technology Assessment, TLV: Tandvårds- och läkemedelsförmånsverket, NICE: The National Institute for Health and Care Excellence, IQWiG: Institut für Qualität und Wirtschaftlichkeit im Gesundh-eitswesen, HAS:Haute Autorité de Santé, AIFA: Agenzia Italiana del Farmaco, ZIN: Zorg-instituut Nederland
해외동향
3. 나가며
앞서 살펴본 바와 같이, 비록 지금은 RWD가 RCT보다 낮게 평가되고 있었다. 하지만, 실제 임상 효과를 보여주는 RWD의 활용은 향후 더욱 증가할 것이며, 공공보건학적 측면 에서 매우 중요하다고 할 수 있을 것이다. 제약회사가 제출하기 어려운 만성질환 치료제의 장기간 사용으로 인한 부작용 연구, 고가 항암제나 의료기기 등을 모니터링한 RWD를 근거로 임상적 유용성 및 비용-효과성에 대한 공공 보건학적 의사결정을 생각해 볼 수 있다. 다만, 이러한 RWD는 민감한 개인정보가 포함되어 있기 때문에, 이를 관리·평가·활용하는 주체에 대한 고민도 함께 필요해 보인다. 이러한 고민은 이미 유럽 연합 보고서에 언급되어 있다. 보고서는 ‘자료가 어디로 흘러 들어가는 것이냐?’, ‘누가 그것을 사용하느냐?’, ‘무슨 목적으로 사용하느냐?’ 등과 같은 근본적인 질문을 제기함과 동시에 이에 대한 답변이 충분하지 않다고 지적하고 있다(김재용, 2018 재인용). 건강보험심사평가원(이하 심평원)은 1995년부터 전자청구 자료를 구축해 왔다. 심평원은 전국민 진료정보를 비롯하여 의약품 처방정보와 비급여 의약품의 사용 내역이 포함된 의약품 안심사용(Drug Utilization Review; DUR)정보 자료 등 보건의료 전반에 활용할 수 있는 다양한 보건의료빅데이터를 보유하고 있다. 이와 같은 보건의료빅데이터는 인공지능 기술과 결합하여 4차 산업혁명 시대의 우리나라의 핵심 자산이 될 것으로 기대되고 있다. 따라서 보건의료 빅데이터를 주도적으로 관리해온 심평원은 보건의료빅데이터를 활용하여 전국민의 보건의 료 향상에 기여할 수 있는 기반 마련을 위해 노력해야 할 필요가 있으며, 나아가 심평원을 포함한 정부와 공공기관은 보건의료빅데이터의 관리, 감독·활용의 주체자로 공익적·사회적 목적을 위해 필요한 자료는 개방하되 특정 기업의 이익창출에 활용되지 않도록 주의해야 할 것이다. 이를 위해서 기관 본래의 목적과 취지에 맞게 RWD 사용의 가이드라인을 수립하고, 분석 결과로 얻어진 공적인 이익이 사회 구성원에게 차별 없이 돌아갈 수 있는 관리 제도 마련을 위해 노력해야 할 것이다.정책동향 2018년 12권 1호 참고문헌 김재용. 공공보건 역량 강화를 위한 빅데이터 활용론. 의료와 사회 8호, 2018. 4차 산업혁명과 제약바이오산업. 한국제약바이오협회 정책보고서. 2017.9.vol 13 식품의약품안전처, 식품의약품안전평가원. 3D 프린터를 이용하여 제조되는 맞춤형 의료기기 허가심사 가이드라인. 2015. 12. 식품의약품안전처, 식품의약품안전평가원. 신개념 의료기기 전망보고서. 2017.12. 왓슨 쇼크… 10년 뒤 우리 동네 약사님은 로봇? 조선일보. 2017.1.16. 정현학, 최영임, 이상원. 4차 산업혁명과 보건산업 패러다임의 변화. 보건산업브리프 Vol. 215. 2016. 5. 23. 한국보건 산업진흥원 정용찬. 빅데이터: 커뮤니케이션 이해 총서. 커뮤니케이션북스. 2013.
유럽집행위원회 보건소비자보호총국(european commission directorate-General for health and consumers unit). The Use of Big Data in Public Health Policy and Research-Background information document. Brussels, 29
August 2014.
경제협력개발기구(OECD). New Health Technologies: Managing Access, Value and sustainability. 2017.
Jacqueline Corrigan-Curay, JD, MD, Center for Drug Evaluation And Research. FDA. ISPOR/ISPE Real-World Evidence in Health Care Decision Making. October 20, 2017.
Makady A, Ham RT, de Boer A, Hillege H, Klungel O, Goettsch W; GetReal Workpackage 1. “Policies for Use of Real-World Data in Health Technology Assessment (HTA): A Comparative Study of Six HTA Agencies”. Value Health. 2017 Apr;20(4):520-532.
Scott D. Ramsey. Richard J.Willke, PhD. Enhancing the Transparency and Credibility of Real Wrold Evidence in Health Care Decision Making. ISPOR special Task Force on RWE in Regulatory Decision Making Proposal. 2017 February 21.
Shirin Enshaeifar. Payam Barnaghi. Severin Skillman. Andras Markides. Tarek Elsaleh. Thomas Acton. Ramin Nilforooshan. Helen Rostill. Internet of Things for Dementia Care(http://epubs.surrey.ac.uk/841783/1/ TIHM_IEEEIC.pdf)